牛病毒性腹瀉病毒基因分型二重RT-PCR檢測方法的建立
崔 元 , 王建昌 , 王金鳳 , 袁萬哲,3
(1.河北農業大學動物醫學院, 河北保定071001;2.河北出入境檢驗檢疫局檢驗檢疫技術中心, 河北石家莊050051;3.河北省獸醫生物技術工程技術研究中心, 河北保定071001)
牛病毒性腹瀉病毒基因分型二重RT-PCR檢測方法的建立
崔 元1, 王建昌2, 王金鳳2, 袁萬哲1,3
(1.河北農業大學動物醫學院, 河北保定071001;2.河北出入境檢驗檢疫局檢驗檢疫技術中心, 河北石家莊050051;3.河北省獸醫生物技術工程技術研究中心, 河北保定071001)
為了同步檢測牛病毒性腹瀉病毒(BVDV)基因1型和基因2型并能夠加以區分,根據GenBank中已發表的BVDV基因1型和基因2型、牛藍舌病病毒(BTV)、口蹄疫病毒(FMDV)、豬瘟病毒(CSFV)、牛傳染性鼻氣管炎病毒(IBRV)的全基因序列,采用Primer Premier 5.0軟件,針對BVDV的高度保守的5′端非編碼區的核苷酸序列,設計了兩對特異性引物,二重RT-PCR方法擴增目的片段的大小分別為222 bp和119 bp,經過對反應體系和條件的優化,本研究建立了在同一反應體系中鑒別檢測BVDV基因1型和2型的RT-PCR方法,擴增出了與預期大小相符的目的片段。該方法便捷,特異性高,敏感性強,重復性好,可作為BVDV分型鑒定和快速診斷的有效方法。
BVDV; 二重RT-PCR; 基因性
牛病毒性腹瀉是由牛病毒性腹瀉病毒(BVDV)引發的牛的一種傳染病,臨床上可引起牛發熱、黏膜潰瘍、白細胞減少、腹瀉及懷孕母牛流產或產出畸胎等。成熟的BVDV病毒粒子呈直徑為40~60 nm的球形或圓形,囊膜表面有10~12 nm的環形亞單位,病毒基因組為單分子線狀正鏈單股RNA,大小約12.5 kb[1]。BVDV可在胎牛腎、睪丸、皮膚、肌肉、肺、脾、鼻甲、氣管細胞、豬腎細胞中增殖傳代[2]。
研究表明,BVDV在不同的毒株之間有著明顯的遺傳和抗原異質性特征,根據BVDV是否使細胞病變將其分為致細胞病變型和非致細胞病變型。BVDV基因組由5′-非翻譯區(5′-UTR)和3′-非編碼區(3′-NCR)組成,中間是一個大的開放閱讀框(Open reading frame, ORF),5′-UTR區具有很高的保守性,常根據此區域設計引物來檢測BVDV或進行基因型的區分[3]。二重RT-PCR的特點是能在同一PCR反應體系中同時檢測并鑒別兩種病原體,在臨床上具有很高的應用價值。本研究旨在建立一套可以同時檢測并區分BVDV兩種基因型的二重RT-PCR方法,為BVDV的檢疫、臨床鑒別診斷提供有效的檢測方法。
1 材料與方法
1.1 材料
OregonC24V株、890株均由新疆出入境檢驗檢疫局檢驗檢疫技術中心贈送;BTV、CSFV、FMDV、IBRV均由河北出入境檢驗檢疫局檢驗檢疫技術中心實驗室保存;基因組提取試劑盒、SanPrep柱式質粒DNA小量抽提試劑盒、pMD?19-T Simple Vector、Prime ScriptTMⅡ1st strand cDNA Synthesis試劑盒等。
1.2 方法
1.2.1 引物的設計與合成 根據GenBank中已發表的BVDV OregonC24V、SD0803、ZM-95等6株BVDV1型毒株和890、JZ05-1、XJ-04等6株BVDV2型毒株的全基因序列,用DNAStar 6.0軟件進行序列比對,使用Primer5.0軟件設計兩對分別針對BVDV1和BVDV2的特異性擴增引物F1/R1和F2/R2,引物序列見表1。
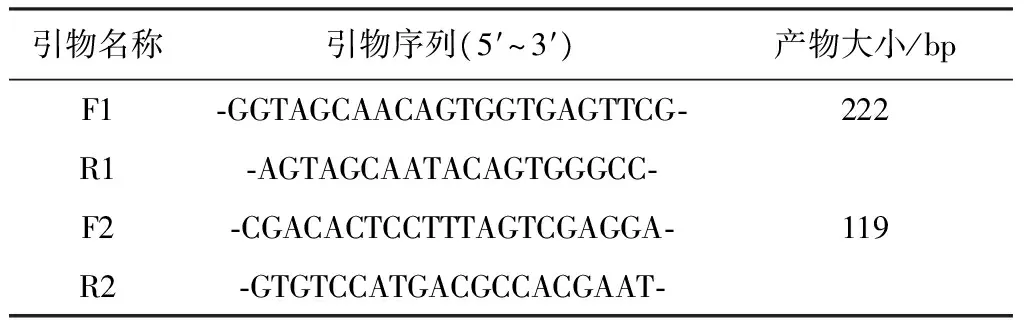
表1 試驗中所用引物序列信息
1.2.2 病毒核酸的提取 采用病毒DNA/RNA提取試劑盒,提取BVDV1、BVDV2、BTV、FMDV、CSFV、IBRV的DNA或RNA。
1.2.3 病毒cDNA的合成 使用Primer ScriptTMⅡ1st strand cDNA Synthesis試劑盒,將RNA反轉錄。反轉錄體系如下:Random 6mers(50 μmol/L)1.5 μL,dNTP Mixture(10 mmol/L)1 μL,RNA 5 μL,DEPC水2.5 μL,65 ℃ 5 min,立即冰浴;5×primer ScriptⅡBuffer 4 μL,Primer ScriptⅡRTase 1 μL,RI 0.5 μL,DEPC水4.5 μL;30 ℃ 10 min;70 ℃ 15 min。。
1.2.4 BVDV1和BVDV2二重RT-PCR反應條件的優化
1.2.4.1 引物濃度的優化 分別對F1/R1和F2/R2的濃度進行優化。PCR體系為25 μL,包括TaqMixture 12.5 μL,引物F/R(20 μmol/L)分別設定濃度為0.2、0.4、0.6、0.8 μmol/L,cDNA 1.0 μL,ddH2O 補足至25 μL。反應條件為94 ℃ 5 min;94 ℃ 30 s,53 ℃ 30 s,72 ℃ 30 s,35個循環;72 ℃ 5 min。電泳檢測,確定最佳引物濃度。
1.2.4.2 退火溫度的優化 使用最佳引物濃度,對二重RT-PCR進行退火溫度的優化。退火溫度設定為51 ℃、53 ℃、55 ℃、57 ℃、59 ℃,電泳檢測,選取最優退火溫度。
1.2.5 特異性檢測 以BVDV1、BVDV2、BTV、FMDV、CSFV、IBRV的基因組為模板,采用優化條件擴增,并用引物F1/R1擴增BVDV2陽性模板,用引物F2/R2擴增BVDV1陽性模板,以檢測該方法的特異性。
1.2.6 質粒構建 將BVDV1和BVDV2特異性片段連接到pMD19-T載體,轉化至DH5α感受態細胞,挑取陽性克隆,將菌液送至上海生工生物工程技術服務有限公司測序,測序結果進行BLAST比對分析。
采用SanPrep柱式質粒DNA小量抽提試劑盒提取BVDV1和BVDV2的質粒。
1.2.7 靈敏性檢測 測定構建質粒的濃度,換算成相應的拷貝數,進行10倍梯度稀釋,分別按最佳反應條件進行單重和二重PCR擴增。
1.2.8 重復性檢測 用優化后的二重RT-PCR方法進行3次重復檢測,以驗證建立方法的穩定性。
2 結果
2.1 引物濃度的優化結果 BVDV1反應體系中最優引物濃度為0.4 μmol/L(圖1),BVDV2反應體系中最優引物濃度為0.8 μmol/L(圖2)。因此二重RT-PCR方法的最佳反應體系為2×TaqPCR Master Mix 12.5 μL,F1/R1(20 μmol/L)0.5 μL,F2/R2(20 μmol/L)1 μL,cDNA 1 μL,ddH2O補足至25 μL。

圖1 BVDV1引物濃度優化結果
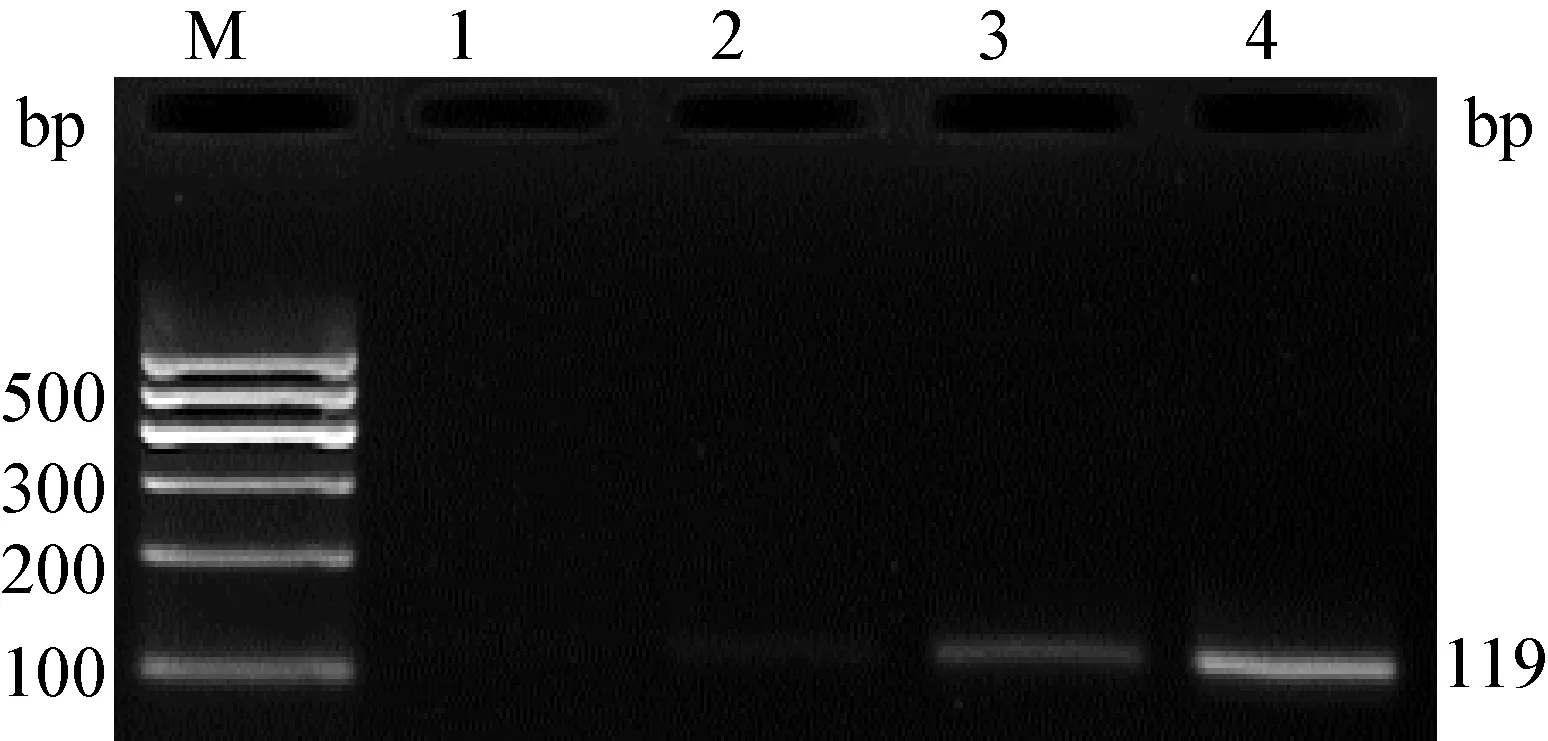
圖2 BVDV2引物濃度優化結果
2.2 退火溫度的優化結果 二重RT-PCR方法最佳退火溫度為51 ℃(圖3)。最佳反應條件為94 ℃ 5 min;94 ℃ 30 s,51 ℃ 30 s,72 ℃ 30 s,35個循環;72 ℃ 5 min。
2.3 特異性的檢測 結果顯示,BVDV1和BVDV2的目的片段大小分別為222 bp和119 bp,與預期大小相符,兩對引物之間無非特異性擴增,且分別用兩對引物擴增不同基因型的陽性模板均未出現條帶。測序結果經BLAST分析證實與已發表序列一致。用此方法檢測BTV、FMDV、CSFV、PRV均未出現條帶,表明本方法具有良好的特異性(圖4)。
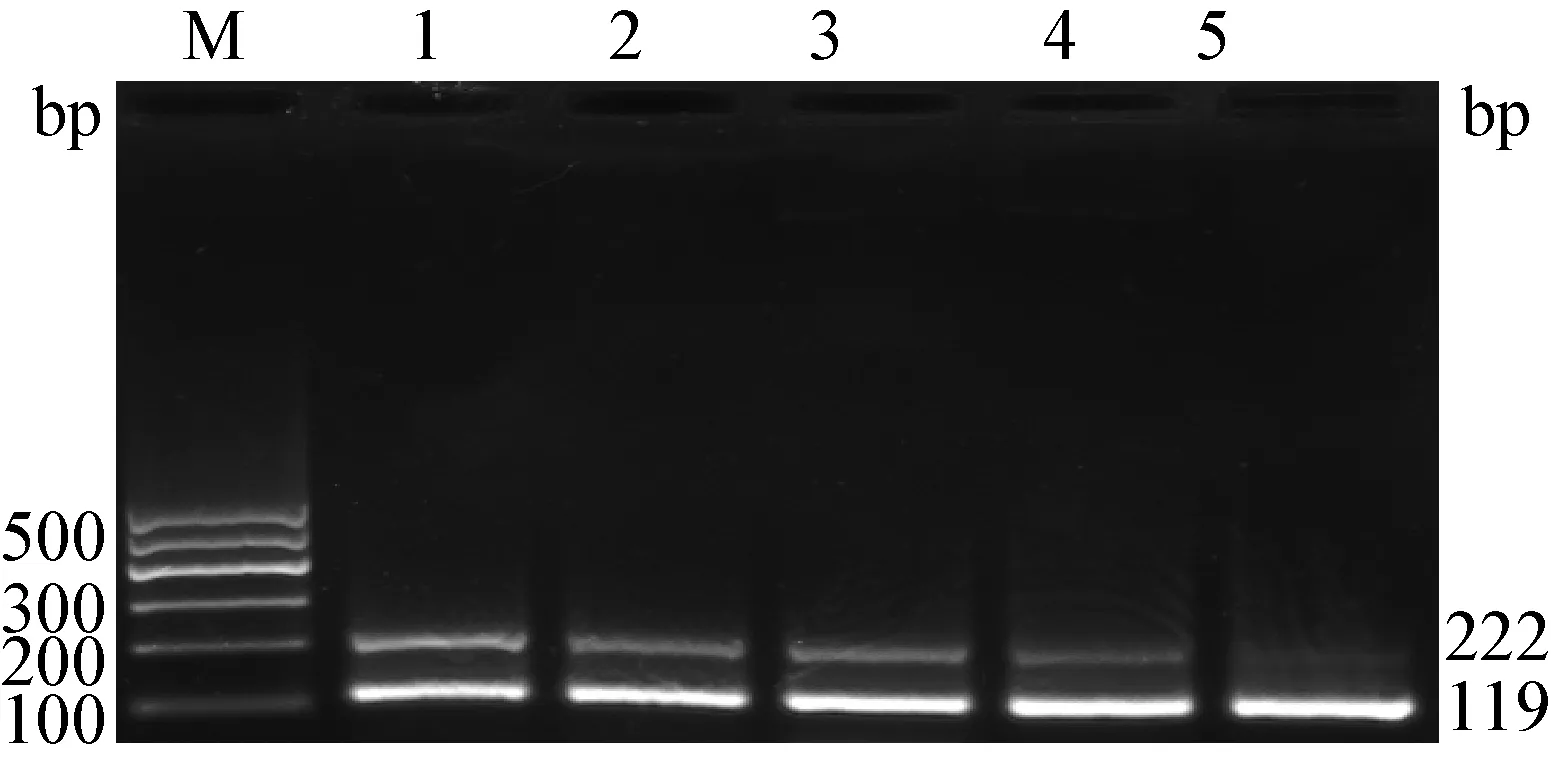
圖3 BVDV1和BVDV2二重RT-PCR方法退火溫度優化結果
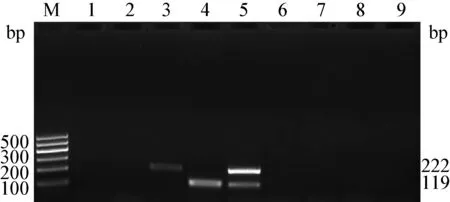
圖4 BVDV二重PCR特異性擴增結果
2.4 靈敏性的檢測 根據優化條件對10倍梯度稀釋后的質粒進行擴增,結果顯示,單重PCR(圖5,圖6)和二重PCR(圖7)最低檢測限均為103copies,二者的靈敏性結果一致,表明同一體系中兩個基因型間未產生明顯的相互抑制,靈敏性較高。
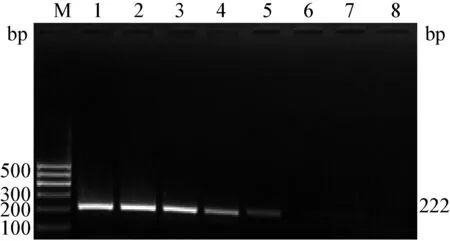
圖5 BVDV1 RT-PCR靈敏性結果
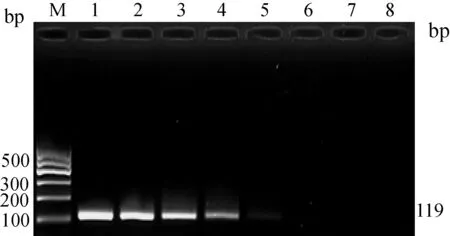
圖6 BVDV2 RT-PCR靈敏性結果
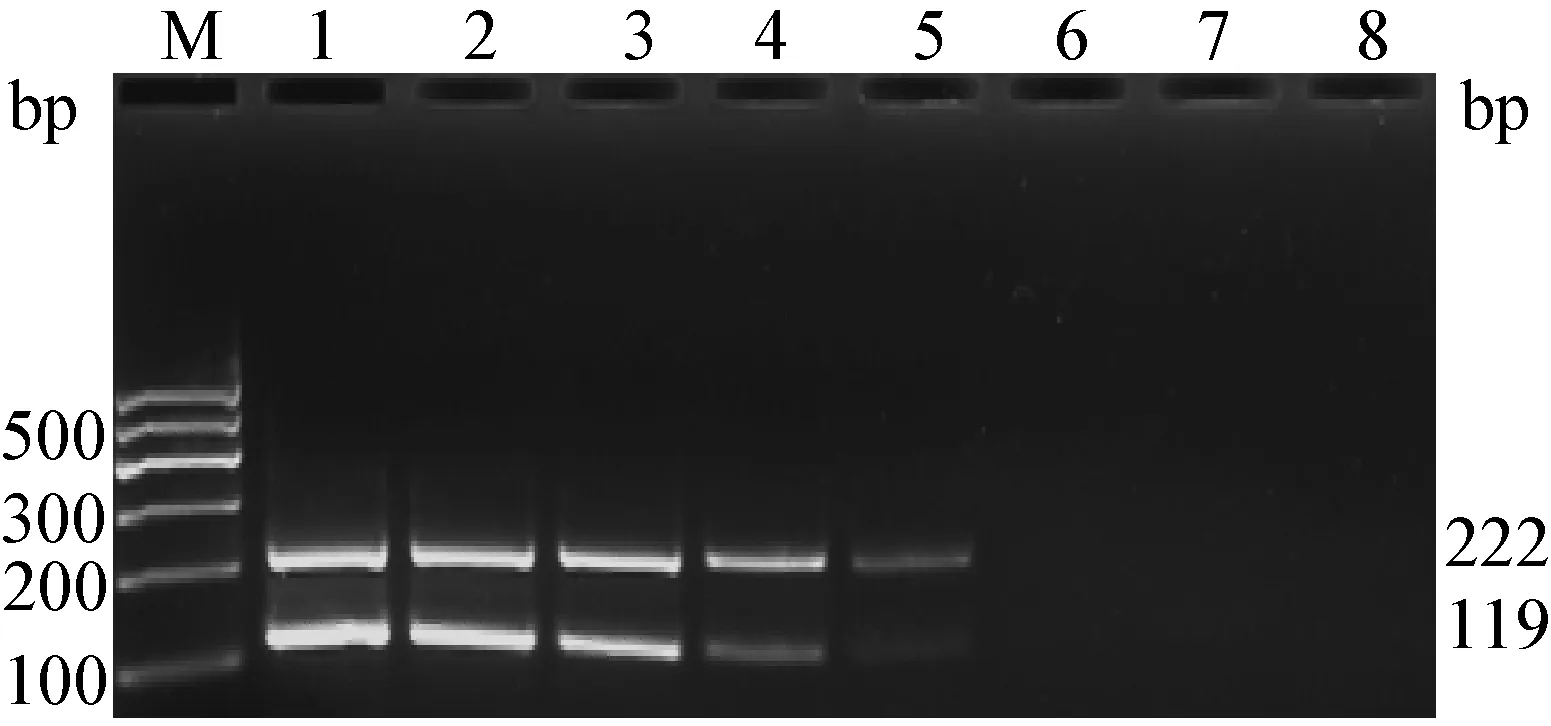
圖7 二重RT-PCR靈敏性結果
2.5 重復性檢測 應用建立的BVDV二重RT-PCR方法進行3次重復檢測,均出現目的基因條帶,表明重復性較好。
3 討論
BVDV的5′-UTR區域高度保守、穩定[4],本試驗對BVDV多株病毒基因組的5′-UTR區域的核苷酸序列進行比對和分析,設計出2對特異性引物,分別用于檢測兩種基因型,保證了建立方法的特異性。以OregonC24V株和890株的RNA反轉錄后獲得的cDNA為模板進行RT-PCR,結果表明,應用上述引物可分別擴增出與預期大小相符的DNA片段,對其序列進行測定和分析,結果顯示OregonC24V株和890株分別屬于BVDV1和BVDV2,該結果與文獻報道一致。表明該RT-PCR方法可特異性將BVDV分為兩種基因型,其分類結果與文獻報道相一致。
在本試驗中,引物設計是重點和難點。由于BVDV基因組5′-UTR區域較短,且兩種基因型的同源性較高,因此,在能夠區分兩種基因型的同時,又能夠使兩對引物的退火溫度接近、引物長度18~25 bp、G+C的含量在50%左右、堿基分布均勻,并且擴增出的目的片段的長度有一定差距成了本研究的重點和難點。此外,引物濃度與模板量之間存在相互制約的關系,引物濃度不足可導致擴增效率降低,過高則易出現二聚體。在本研究最初建立的二重RT-PCR方法中,使用了同等物質的量的引物,但擴增結果不理想,即使在優化反應條件后仍存在單個基因擴增條帶不明顯的情況,為解決這一問題,分別對引物不同濃度的擴增效果進行了對比,并據此改變了PCR體系中兩對引物的比例,最終達到平衡,得到了良好的擴增結果。
目前實驗室常用的用來檢測BVDV的方法有病毒的分離鑒定、瓊脂擴散試驗、酶聯吸附試驗、熒光定量RT-PCR等。其中ELISA能夠檢測組織器官或培養物中有無BVDV,并且能夠監測牛群中BVDV的抗體水平及潛伏感染的比率[5],此方法已廣泛應用,但在諸多檢測方法中,血清學檢測方法與RT-PCR方法相比敏感性較低,與豬瘟病毒存在抗體的交叉反應[6],多存在費力耗時、準確率低等缺點。隨著分子生物學的發展和RT-PCR檢測技術的日益成熟,在眾多檢測方法中其被認為是一種準確性高、重復性好、快速、特異、靈敏的檢測方法,可廣泛應用于病原體的檢測、基因表達等諸多領域[7]。總之,本研究建立的BVDV二重RT-PCR檢測方法具有操作簡便快捷、檢測結果特異性高、敏感性好、重復性好、檢測應用范圍廣等優點,可作為BVDV分型鑒定和快速診斷的有效方法。
[1] 殷震,劉景華. 動物病毒學[M]. 2版.北京:科學出版社, 1997: 645-652.
[2] 李慶超.牛病毒性腹瀉病毒JZ05-1株基因分型、全基因序列測定及分析[D].北京:中國農業科學院, 2010.
[3] 王璐.牛病毒性腹瀉病毒E0基因的表達及間接ELISA檢測方法的建立[D].烏魯木齊:新疆農業大學, 2012.
[4] 李寧.牛病毒性腹瀉病毒RT-PCR方法的建立與gP48基因克隆及原核表達[D].保定:河北農業大學, 2012.
[5] 張儉偉,趙宏坤,楊少華,等.RT-PCR快速檢測牛病毒性腹瀉病毒方法的建立與應用[J].中國獸醫學報,2008, 28(4): 367-370.[6] 孫宏進.基因2型牛病毒性腹瀉病毒的分離與鑒定[D].揚州:揚州大學, 2010.
[7] 孟雨.牛病毒性腹瀉病毒RT-PCR檢測方法的建立及5′-UTR基因遺傳變異分析[D].楊凌:西北農林科技大學, 2010.
YUAN Wan-zhe
Establishment of a RT-PCR assay for simultaneous dutecion of BVDV
CUI Yuan1, WANG Jian-chang2, WANG Jin-feng2, YUAN Wan-zhe1,3
(1.College of Veterinary Medicine, Agricultural University of Hebei, Baoding 071001, China; 2.Inspection and Quarantine Technical Center of Hebei Entry-Exit Inspection and Quarantine Bureau, Shijiazhuang 050051, China; 3. Hebei Engineering and Technology Research Center of Veterinary Biotechnology, Baoding 071001, China)
In order to detect and distinguish the genome sequences of genotype 1 BVDV and genotype 2 BVDV simultaneously, two pairs of primers that the specific to the 5'-untranslated region of BVDV were designed by Primer Premier 5.0, according to the complete sequences of BVDV1, BVDV2, BTV, FMDV, CSFV and IBRV in GenBank. The 5'-untranslated region of BVDV was the highest conservative region in the BVDV complete genome. The target fragments’ sizes were 222 bp and 119 bp. After the optimization of the reaction conditions, we set up a method which can distinguish genotypes of BVDV using RT-PCR just in one reaction system. This established assay can detect BVDV1 and BVDV2 specifically, sensitively and reproducibly, which is an efficient assay for BVDV detection and genotyping.
BVDV; duplex RT-PCR; genotype
2016-09-23
國家質量監督檢驗檢疫總局科技計劃項目(2015IK093)
崔元(1993-),女,碩士生,研究方向為預防獸醫學,E-mail:1277107388@qq.com
王建昌(1981-),男,助理研究員,博士,研究方向為預防獸醫學,E-mail:jianchangwang1225@126.com
袁萬哲,E-mail:yuanwanzhe@126.com
S855.3
A
0529-6005(2017)07-0020-04
注:王建昌與崔元對本文具有同等貢獻

