CD31、CD34和CD133蛋白在嬰幼兒血管瘤組織中的表達及意義
馮雷,羅亞楠,賀月華,王林杰,朱璐,雷水生
(1廣州醫科大學附屬第五醫院,廣州510700;2廣州醫科大學)
CD31、CD34和CD133蛋白在嬰幼兒血管瘤組織中的表達及意義
馮雷1,羅亞楠1,賀月華1,王林杰2,朱璐1,雷水生1
(1廣州醫科大學附屬第五醫院,廣州510700;2廣州醫科大學)
目的 觀察CD31、CD34和CD133蛋白在嬰幼兒血管瘤(IH)組織中的表達,并探討其臨床意義。方法 收集IH患兒存檔蠟塊50例(增生期25例,消退期25例)、瘤旁正常皮膚組織5例,采用免疫組化SP法檢測組織中內皮祖細胞(EPCs)標志物CD31、CD34和CD133蛋白,采用HPIAS-1000圖文報告管理系統對CD31、CD34和CD133蛋白的表達進行定量分析。結果 增生期血管瘤組織CD31、CD34和CD133蛋白的陽性面積率分別是23%±3%、19%±4%、37%±2%,積分光密度(IOD)分別是0.26±0.06、0.23±0.03、0.52±0.02,均高于消退期血管瘤組織和瘤旁正常皮膚組織(P均<0.05),而消退期血管瘤組織和瘤旁正常皮膚組織中CD31、CD34和CD133蛋白的IOD和陽性面積率比較差異無統計學意義(P均>0.05)。結論 EPCs標志物CD31、CD34和CD133蛋白在增生期血管瘤組織中高表達,其在血管瘤的發生發展中起著重要作用。
血管瘤;內皮祖細胞;CD31蛋白;CD34蛋白;CD133蛋白;嬰幼兒
嬰幼兒血管瘤(IH)是一種良性血管性腫瘤,以血管內皮細胞異常増殖為病理持征,好發于嬰幼兒出生時或出生后3~6個月,發病率為1%~2%,在白種人群中可以髙達12%[1],但其發病機制尚不明確。內皮祖細胞(EPCs)是一類能夠參與循環增殖并能分化為血管內皮細胞的干細胞,目前認為CD34、CD133共同標記的即為EPCs[2]。同樣的,也有研究表明,EPCs同樣表達CD31。EPCs在血管瘤中含量極微,卻獨具自我更新、無限增殖、多向分化的能力。2015年12月~2016年4月,我們觀察了IH組織中CD31、CD34和CD133蛋白的表達情況。現報告如下。
1 材料與方法
1.1 標本來源 收集廣州醫科大學附屬第五醫院病理科2010~2015年IH存檔蠟塊50例,患兒中男22例,女28例;年齡1月~2歲,平均1.3歲;依據Mulliken分類增生期血管瘤25例、消退期血管瘤25例;術前均未行任何輔助性治療。另取瘤旁正常皮膚組織5例作為對照。
1.2 CD31、CD34和CD133蛋白檢測方法 兔抗人CD31、CD34單克隆抗體(美國GeneTex公司),兔抗人CD133多克隆抗體(美國Proteintech公司),山羊抗兔二抗(美國Bioword公司),DAB顯色試劑盒(北京中杉生物技術有限公司),超敏即用型SP通用型免疫組化試劑盒(福州邁新公司)。蠟塊常規脫水,透明及HE染色。采用免疫組化SP法檢測CD31、CD34與CD133蛋白,用PBS代替一抗作為陰性對照,以購買的陽性片作為陽性對照。CD31、CD34和CD133以細胞核或胞質出現棕黃色顆粒為陽性細胞,采用HPIAS-1000高清晰度彩色病理圖文報告管理系統進行蛋白定量分析。光鏡下每張切片隨機選取5個完整且不重疊的高倍鏡視野(×200),測定每個視野下陽性反應的積分光密度(IOD)、陽性反應面積和所有細胞總面積,計算陽性面積率。陽性面積率(%)=單位面積中陽性反應的總面積/單位面積中細胞的總面積×100%。
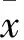
2 結果
增生期血管瘤組織CD31、CD34和CD133蛋白的IOD和陽性面積率均高于消退期血管瘤組織和瘤旁正常皮膚組織(P均<0.05),而消退期血管瘤組織和瘤旁正常皮膚組織比較無統計學意義。詳見表1。
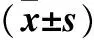
表1 IH及瘤旁正常皮膚組織CD31、CD34和CD133蛋白表達比較
注:與瘤旁正常皮膚組織比較,*P﹤0.05;與消退期IH組織比較,#P﹤0.05。
3 討論
目前認為,內皮細胞過度增殖、血管快速生長是IH病理組織學的最大特點。IH的自然病程大致分3個階段:①增殖期。大多出現在出生后的第1年,此階段以大量毛細血管內皮細胞快速增殖且不規則分布為主要特征,少見典型血管樣結構。②消退期。大多在1歲左右開始,持續3~5年;其間血管瘤增殖減慢或停止,血管瘤內皮細胞凋亡,血管樣結構增多,細胞外基質纖維和脂肪組織增生。③消退完成期。大多在5~8歲,血管瘤增生組織被纖維脂肪殘余及毛細血管替代,病灶處常伴有皮膚松弛、色素沉著以及瘢痕殘余。然而,其他脈管性腫瘤和血管畸形自然病程中增殖可在兒童和成人的任何階段發生,不會出現自行消退現象。
自1997年Asahara等用免疫磁珠法第一次從外周血分選出CD34+細胞,并發現這種細胞可以參與損傷后血管的新生,比新生微血管內皮在形態學和蛋白質的表達模式上表現出更多胚胎性,稱其為EPCs[3]。EPCs能夠循環增殖并分化為血管內皮細胞參與生理性血管形成,而且在病理狀態下能被動員而增強代償性血管重建能力并參與腫瘤血管生成。CD133是新近發現的干細胞標記,不表達于成熟內皮細胞,被認為是目前區分EPCs與內皮細胞最主要的標記[4]。研究表明,純化的CD133+細胞在體外能分化為內皮細胞。在分化過程中,EPCs明顯失去CD133,并開始表達成熟內皮細胞特有的表面標志,如血管性血友病因子(vWF)。EPCs作為內皮細胞的前體細胞,功能上接近于干細胞[5],不僅參與胚胎時期的血管生成,而且參與出生后的生理性和病理性血管新生。Yu等[6]發現,CD133主要存在于增殖期血管瘤,并在其標本中發現同時表達CD133和血管內皮生長因子受體(KDR)的EPCs,因此推測EPCs可能與血管瘤早期的快速增殖有關。Zou等[7]發現,EPCs表達CD105、CD31、CD34、KDR、VWF、CD146等,但是并沒有CD14、CD45、α平滑肌肌動蛋白(α-SMA)的表達,并且很多細胞能表達CD133,這與先前的研究相符的[8,9]。同樣,Kleinman等[10]研究發現,內皮細胞集落形成細胞(ECFCs)能表達CD31,而ECFCs是EPCs的一種亞型。從這些研究中不難發現CD31、CD34、CD133都是EPCs的標記物。本研究結果顯示,CD31、 CD34和CD133蛋白質在增生期血管瘤組織中高表達,從而證實增生期血管瘤中存在EPCs。有研究[10]顯示,IH患兒血循環中EPCs數量超出正常者15倍。EPCs在血管瘤中含量極微,卻獨具自我更新、無限增殖、多向分化的能力。因此,我們推測其可能是IH發生的根源,始動IH的發生發展,血管瘤內皮細胞可能由滯留在胚胎血管發育早期的EPCs演化而來,但具體的分子機制還有待于進一步闡明。
[1] Leaute-Labreze C, Prey S, Ezzedine K, et al. Infantile haemangioma: part Ⅰ. Pathophysiology, epidemiology, clinical features, life cycle and associated structural abnormalities[J]. J Eur Acad Dermatol Venereol, 2011,25(11):1245-1253.
[2] Lin CP, Lin FY, Huang PH, et al. Endothelial progenitor cell dysfunction in cardiovascular diseases: role of reactive oxygen species and inflammation[J]. Biomed Res Int, 2013,2013:845037.
[3] Asahara T, Murohara T, Sullivan A, et al. Isolation of putative progenitor endothelial cells for angiogenesis[J]. Science, 1997,275(5302):964-967.
[4] Yin AH, Miraglia S, Zanjani ED, et al. AC133, a novel marker for human hematopoietic stem and progenitor cells[J]. Blood, 1997,90(12): 5002-5012.
[5] Ingram DA, Caplice NM, Yoder MC. Unresolved questions, changing definitions, and novel paradigms for defining endothelial progenitor cells[J]. Blood, 2005,106(5):1525-1531.
[6] Yu Y, Flint AF, Mulliken JB, et al. Endothelial progenitor cells in infantile hemangioma[J]. Blood, 2004,103(4):1373-1375.
[7] Zou HX, Jia J, Zhang WF, et al. Propranolol inhibits endothelial progenitor cell homing: a possible treatment mechanism of infantile hemangioma[J]. Cardiovasc Pathol, 2013,22(3):203-210.
[8] Yoder MC, Mead LE, Prater D, et al. Redefining endothelial progenitor cells via clonal analysis and hematopoietic stem/progenitor cell principals[J]. Blood, 2007,109(5):1801-1809.
[9] Ingram DA, Mead LE, Tanaka H, et al. Identification of a novel hierarchy of endothelial progenitor cells using human peripheral and umbilical cord blood[J]. Blood, 2004,104(9):2752-2760.
[10] Kleinman ME, Tepper OM, Capla JM, et al. Increased circulating AC133+CD34+endothelial progenitor cells in children with hemangioma[J]. Lymphat Res Biol, 2003, 1(4):301-307.
廣東省企業技術研發與升級改造專項基金項目計劃(2013B021800191)。
雷水生(E-mail: leishuisheng@126.com)
10.3969/j.issn.1002-266X.2017.18.034
R739.5
B
1002-266X(2017)18-0092-03
2016-10-26)

