阿利吉侖治療中青年高血壓的效果及其對患者RASS的影響
袁會玲,張曉華,田勇,楊洪霞,卜瑞紅,劉紅彬,解彥格
(石家莊市第三醫院,石家莊050011)
阿利吉侖治療中青年高血壓的效果及其對患者RASS的影響
袁會玲,張曉華,田勇,楊洪霞,卜瑞紅,劉紅彬,解彥格
(石家莊市第三醫院,石家莊050011)
目的 觀察阿利吉侖治療中青年高血壓的臨床效果以及對患者腎素-血管緊張素-醛固酮系統(RAAS)的影響。方法 將106例中青年高血壓患者隨機分為觀察組和對照組各53例,觀察組口服阿利吉侖,對照組口服依那普利。兩組均4周為1個療程,共觀察2個療程。治療前及治療后第8周行動脈血壓監測,治療前及治療后第4、8周取血檢測血漿腎素活性(PRA)、血管緊張素Ⅱ(AngⅡ)、醛固酮(ALD) ,觀察治療期間降壓藥物不良反應,治療前及治療后半年行心臟彩色超聲檢查。結果 觀察組收縮壓下降值、舒張壓下降值、脈壓下降值和收縮壓谷峰比值高于對照組,差異有統計學意義(P均<0.05)。治療第4周,觀察組血漿PRA、AngⅡ、ALD水平低于治療前(P均<0.05);治療第8周,兩組血漿PRA、AngⅡ、ALD水平均低于治療前,且觀察組低于對照組(P均<0.05)。治療后半年時,觀察組舒張末期室間隔厚度、左心室內徑、左心室后壁厚度及A/E小于對照組,左心室射血分數高于對照組,差異有統計學意義(P均<0.05)。兩組藥物不良反應發生率比較,差異無統計學意義。結論 阿利吉侖調控中青年高血壓效果較好,能明顯阻斷RAAS活性,保護靶器官,且安全性良好。
高血壓;中青年;阿利吉侖;依那普利;腎素-血管緊張素-醛固酮系統
研究報道顯示,腎素-血管緊張素-醛固酮系統(RAAS)異常激活在高血壓發生及維持中起關鍵作用[1]。RAAS活性高低與多種因素有關,其中年齡是影響該系統活性的主要原因且與RAAS活性呈負相關[2],可能與高齡患者腎臟球旁細胞合成與分泌腎素功能降低及交感神經緊張性下降引起腎素分泌功能衰減有關,所以中青年高血壓患者通常存在RAAS活性異常增高的特征[35]。阿利吉侖是一種可直接抑制腎素活性(PRA)的新型長效降壓藥物[4],但有關其對中青年高血壓患者RAAS影響的報道甚少[5]。2015年12月~2016年6月,我們觀察了阿利吉侖治療中青年高血壓的效果及對患者RAAS的影響。現報告如下。
1 資料與方法
1.1 臨床資料 納入標準:①符合2010年版中國高血壓防治指南中原發性高血壓診斷標準;②年齡20~32歲;③近2周未使用降壓藥物;④臨床資料完整;⑤神志清楚,生命體征穩定,具有一定語言表達能力。排除標準:①嚴重腎功能異常和雙側腎動脈狹窄、高鉀血癥;②妊娠或哺乳期婦女;③近1個月服用影響RAAS水平的藥物;④對實驗藥物過敏。選取同期石家莊市第三醫院收治的中青年高血壓患者106例,男76例、女30例,年齡18~55歲,BMI為22~25 kg/m2,病程1~14年,收縮壓140~200 mmHg、舒張壓80~110 mmHg,合并糖尿病21例、高脂血癥18例、腦卒中后遺癥12例、冠心病22例。將患者隨機分為觀察組和對照組各53例,兩組臨床資料具有可比性。本研究經醫院倫理委員會批準,患者均簽署知情同意書。
1.2 治療方法 兩組采用同樣的基礎治療,包括改變生活習慣、調整飲食、合理運動等常規降壓干預以及控制血糖、血脂等對癥處理;觀察組口服阿利吉侖早晨8:00~10:00口服150 mg、1次/d,對照組早晨8:00~10:00口服依那普利10 mg、1次/d。兩組均4周為1個療程,共觀察2個療程。
1.3 血壓監測 治療前后采用動態血壓監測儀監測24 h動態血壓,計算收縮壓、舒張壓和脈壓下降值,以及收縮壓、舒張壓谷峰比值。
1.4 外周血RAAS活性測定 治療前及治療后第4、8周,清晨8:00~10:30空腹取外周靜脈血15 mL,置含有乙二胺四乙酸的試管中,離心后留取血漿。采用放射免疫分析法測定RAAS系統活性,包括血漿PRA、血管緊張素Ⅱ(AngⅡ)和醛固酮(ALD)。試劑盒由北京北方生物技術研究所提供,嚴格按照試劑盒說明書操作。
1.5 心臟結構與功能觀察 治療半年后行心臟彩超檢查,檢測舒張末期室間隔厚度(IVSTd)、左心室內徑(LVEDd)、左心室后壁厚度(LVPWTd)以及左心室射血分數(LVEF)、A/E。
1.6 不良反應觀察 記錄兩組服藥期間出現的不良反應,治療后第4、8周檢測血常規、血生化等實驗室指標。
2 結果
2.1 兩組治療前后收縮壓、舒張壓、脈壓下降值及收縮壓、舒張壓谷峰比值比較 觀察組收縮壓下降值、舒張壓下降值、脈壓下降值和收縮壓谷峰比值高于對照組,差異有統計學意義(P均<0.05);舒張壓谷峰比值與對照組比較,差異無統計學意義(P>0.05)。見表1。
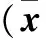
表1 兩組治療前后收縮壓、舒張壓、脈壓下降值及收縮壓、舒張壓谷峰比值比較±s)
注:與對照組比較,aP<0.05。
2.2 兩組治療前后外周血RAAS活性比較 治療第4周,觀察組血漿PRA、AngⅡ、ALD水平低于治療前(P均<0.05);治療第8周,兩組血漿PRA、AngⅡ、ALD水平均低于治療前,且觀察組低于對照組(P均<0.05)。見表2。
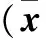
表2 兩組治療前后外周血RAAS活性比較±s)
注:與同組治療前比較,aP<0.05;與同組治療第4周比較,bP<0.05;與對照組同時點比較,cP<0.05。
2.3 兩組治療前后心臟彩超檢查結果比較 治療后半年時,觀察組IVSTd、LVPWTd、LVEDd、A/E小于對照組,LVEF高于對照組,差異有統計學意義(P均<0.05)。見表3。
2.4 兩組治療期間降壓藥物不良反應比較 觀察組出現頭暈1例、腹瀉2例,不良反應發生率為5.66%;對照組出現咳嗽2例,不良反應發生率為3.77%;兩組不良反應發生率比較,差異無統計學意義(P>0.05)。
3 討論
研究[6]顯示,血壓調節需通過長期調節、短期調節完成,前者依靠腎對細胞外環境液體水平調節完成,后者通過神經調節短時間內完成,以使機體適應血壓波動、保證血管內必要的血容量。但是,長時 間血壓變化,短期調節機制則往往難以維持其正常范圍,所以腎臟對體液調節顯得尤為重要[7];影響腎臟調節因素較多,以RAAS為主,包含有PRA、AngⅡ、ALD[8]。研究發現,PRA由近球小體中近球細胞產生,自腎靜脈進入循環系統,致血管緊張素原被催化生成AngⅠ;AngⅠ在血管緊張素轉換酶作用下進一步轉化為AngⅡ,與血管平滑肌中AT1受體結合引起血管收縮、促進腎上腺皮質分泌ALD,造成水鈉潴留。一旦該系統活性過度增強,則會轉變為高血壓。所以,原發性高血壓的發生發展與RAAS密切相關[9,10]。尤其中青年高血壓患者存在不同程度交感神經活性亢進現象,RAAS激活極為顯著[11]。
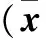
表3 兩組治療前后心臟彩超檢查結果比較±s)
注:與同組治療前比較,aP<0.05;與對照組同時點比較,bP<0.05。
基于上述認知,我們認為RAAS中PRA、AngⅡ、ALD的恒定有利于維持血壓穩定、調節內環境及阻斷心室重塑和血管硬化進展等[12]。目前,臨床常用于干預RAAS活性的降壓藥物包括血管緊張素轉換酶抑制劑(ACEI)和血管緊張素Ⅱ受體拮抗劑(ARB),但研究表明其對RAAS阻斷是不完全的,所以影響了降壓效果。然而,PRA抑制劑能阻斷該系統始動因素,可以從根本上抑制RAAS異常激活[13]。本研究結果表明,觀察組收縮壓下降值、舒張壓下降值、脈壓下降值和收縮壓谷峰比值高于對照組,差異有統計學意義。治療第4周,觀察組血漿PRA、AngⅡ、ALD水平低于治療前;治療第8周,兩組血漿PRA、AngⅡ、ALD水平均低于治療前,且觀察組低于對照組。治療后半年時,觀察組IVSTd、LVPWTd、LVEDd及A/E小于對照組,LVEF高于對照組,差異均有統計學意義。兩組藥物不良反應發生率比較,差異無統計學意義。表明阿利吉侖調控中青年高血壓效果較好,能明顯阻斷RAAS活性,保護靶器官,且安全性良好。究其原因,是因為阿利吉侖作為第一個PRA抑制劑,能從RAAS最上游的限速酶PRA入手,通過調控PRA活性,自源頭上減少AngⅡ生成和ALD分泌,以全面抑制RAAS活性,阻斷心室重構、心力衰竭發生[14]。并且,阿利吉侖作為一種新型高效PRA抑制劑,具有生物利用度高、起效迅速、生物半衰期長等優勢,能避免AngⅡ、ALD逃逸[15];相比ACEI和ARB類降壓藥物而言,其能最大程度地阻斷RAAS異常激活,從而使患者獲取更大收益。另外有研究表明,阿利吉侖對PRA具有高度選擇性,Ang是腎素惟一的天然底物。阿利吉侖與PRA間的高度選擇性,保證了這種藥物良好的安全性,有利于臨床進一步推廣應用[16]。
[1] Parving HH, Brenner BM, McMurray JJ, et al. Cardiorenal end points in a trial of aliskiren for type 2 diabetes[J]. N Engl J Med, 2012,367(23):2204-2213.
[2] 張方怡,張巖.腎素抑制劑阿利吉侖對心血管、腎臟、肝臟病變改善作用的研究進展[J]. 中國臨床藥理學與治療學,2015,20(7):808-813.
[3] Ohsawa M, Tamura K, Kanaoka T, et al. Addition of aliskiren to Angiotensin receptor blocker improves ambulatory blood pressure profile and cardiorenal function better than addition of benazepril in chronic kidney disease[J]. Int J Mol Sci, 2013,14(8):15361-15375.
[4] 蔡曉娜,屈百鳴.以腎素-血管緊張素-醛固酮系統為靶點的高血壓治療新方法[J].中西醫結合心腦血管病雜志,2015,13(1):63-67.
[5] Susantitaphong P, Sewaralthahab K, Balk EM, et al. Efficacy and safety of combined vs.single renin-angiotensin-aldosterone system blockade in chronic kidney disease:a meta-analysis[J]. Am J Hypertens, 2013,26(3):424-441.
[6] Fernandez Juarez G, Luno J, Barrio V, et al. Effect of dual blockade of the renin-angiotensin system on the progression of type 2 diabetic nephropathy: a randomized trial[J]. Am J Kidney Dis, 2013,61(2):211-218.
[7] 李素娟.腎素抑制劑阿利吉侖在高血壓治療中的應用進展[J].醫學綜述,2015,21(7):1251-1252.
[8] Kishina M, Koda M, Kato J, et al. Therapeutic effects of the direct renin inhibitor,aliskiren,on nonalcoholic steatohepatitis in fatty liver Shionogi ob/ob male mice[J]. Hepatol Res, 2014,44(8):888-896.
[9] 申晨,龔開政.新型降壓藥——直接腎素抑制劑阿利吉侖的降壓及靶器官保護效應[J].心血管病學進展,2013,34(5):675-678.
[10] Hsieh YC, Chan CC, Lee KC, et al. Aliskiren reduces portal pressure and intrahepatic resistance in biliary cirrhotic rats[J]. J Chin Med Assoc, 2012,7(5):501-508.
[11] 王飛宇,白元,蔡亞梅.直接腎素抑制劑阿利吉侖治療高血壓病的研究進展[J].藥學服務與研究,2014,14(2):118-121.
[12] Hermanowicz JM, Hermanowicz A, Buczko P, et al. Aliskiren inhibits experimental venous thrombosis in two-kidney one-clip hypertensive rats[J]. Thromb Res, 2013,131:39-44.
[13] 方少華,林英鵬,覃嬋娟,等.新型抗高血壓藥阿利吉侖的心腎保護作用研究進展[J].中國藥房,2012,23(18):1704-1706.
[14] 袁志華,丁琪,靳松.阿利吉侖治療高血壓療效及安全性系統評價及Meta分析的再評價[J].中國循證心血管醫學雜志,2015,7(5):601-604.
[15] Aihara Y, Yoshiji H, Noguchi R, et al. Direct rennin inhibitor,aliskiren,attenuates the rogression of nonalcoholic steatohepatitis in the rat model[J]. Hepatol Res, 2013,43(11):1241-1250.
[16] 吳鴻誼,周京敏.腎素抑制劑阿利吉侖[J].上海醫藥,2013,34(17):6-8.
河北省石家莊市科技局指導性計劃課題(151461503)。
張曉華(E-mail: zhangxiaohualy@163.com)
10.3969/j.issn.1002-266X.2017.18.021
R459.7
B
1002-266X(2017)18-0060-03
2017-01-10)

