急性缺血性腦卒中患者血清HCY、GDF-15、GFAP水平與神經功能及預后的關系
周靜,羅勇,姚珊,張丹丹
(遵義市第一人民醫院,貴州遵義563002)
急性缺血性腦卒中患者血清HCY、GDF-15、GFAP水平與神經功能及預后的關系
周靜,羅勇,姚珊,張丹丹
(遵義市第一人民醫院,貴州遵義563002)
目的 探討急性缺血性腦卒中患者血清同型半胱氨酸(Hcy)、生長分化因子15(GDF-15)、神經膠質纖維酸性蛋白(GFAP)與神經功能及預后的關系。方法 采用ELISA法測定120例急性缺血性腦卒中患者(卒中組)及100例正常健康人(對照組)血清HCY、GDF-15、GFAP水平,比較不同腦梗死體積、神經功能缺損程度評分(CSS)、預后的急性缺血性腦卒中患者血清HCY、GDF-15、GFAP水平變化,分析血清HCY、GDF-15、GFAP水平與患者腦梗死體積、CSS的關系。結果 卒中組入院時血清HCY、GDF-15、GFAP水平高于對照組(P均<0.05),且隨著CSS及腦梗死體積的增加患者血清HCY、GDF-15、GFAP水平升高(P均<0.05)。與急性腦卒中存活者相比,死亡者血清HCY、GDF-15、GFAP水平升高(P均<0.05)。相關性分析顯示,急性缺血性腦卒中患者血清HCY、GDF-15、GFAP水平均與CSS及腦梗死體積呈正相關(P均<0.05)。結論 急性缺血性腦卒中患者血清HCY、GDF-15、GFAP水平隨著神經功能缺損程度及梗死體積增加而升高,可作為患者病情轉歸及預后的評價指標。
急性缺血性腦卒中;同型半胱氨酸;生長分化因子15;神經膠質纖維酸性蛋白;神經功能;腦梗死體積;預后
急性缺血性腦卒中是臨床常見的腦血管疾病,病死率和致殘率較高,嚴重危害患者生命健康[1]。目前該類疾病尚沒有統一有效的治療方案,盡早診斷并及時干預對改善患者預后具有重要意義。血清標志物檢測便捷、快速,近年逐漸成為評價神經系統疾病病情進展及預后的重要手段。研究發現[2],血清同型半胱氨酸(Hcy)水平與神經系統疾病發生及病情進展關系密切,可作為神經系統疾病患者預后的獨立危險因素。血清生長分化因子15(GDF-15)屬于轉化生長因子β家族成員之一,具有促炎、促凋亡作用,同時可參與缺血再灌注過程[3]。神經膠質纖維酸性蛋白(GFAP)作為近年新發現的神經系統疾病血清標志物,其可誘導缺血性腦卒中炎癥反應,加重患者病情[4]。為此,本研究將探討血清HCY、GDF-15、GFAP水平與急性缺血性腦卒中患者神經功能及預后的關系,為急性缺血性腦卒中早期診斷及預后評價提供指導。
1 資料與方法
1.1 臨床資料 納入標準:①新發急性缺血性腦卒中;②符合全國第4次腦血管疾病會議中對缺血性腦卒中的診斷[5];③頭部CT或MRI檢查確診;④發病72 h內入院。排除標準:①頭顱惡性腫瘤或其他部位惡性腫瘤腦轉移者;②自身免疫性疾病或全身系統性感染者;③合并腦外傷者;④入組前接受過抗凝、抗血栓治療者。選取2015年10月~2016年10月遵義市第一人民醫院收治的急性缺血性腦卒中患者120例(卒中組),男 68例、女 52例,年齡(58.2±3.8)歲,送院時間(3.5±0.7)h;根據發病后3~7 d頭部CT計算腦梗死體積[6]:小梗死(<5 cm3)48例,中等梗死(5~15 cm3)44例,大梗死(>15 cm3)28例;神經功能缺損程度評分(CSS)[7]:輕度損傷(0~15分)42例,中度損傷(16~30分)38分,重度損傷(16~30分)40例。另選取同期在本院體檢健康者100例作為對照組,男50例、女50例,年齡(57.8±3.2)歲。兩組性別、年齡具有可比性(P均>0.05)。
1.2 血清HCY、GDF-15、GFAP檢測方法 卒中組于入院后次日清晨,隨后每隔一天抽取血液3 mL,對照組于體檢當天清晨空腹抽取靜脈血3 mL,分別置于肝素抗凝試管中靜置1~2 h,以3 000 r/min離心處理10 min后留取血清,并置于-20 ℃冰箱中保存待測。應用ELISA法測定兩組血清HCY、GDF-15、GFAP水平,HCY試劑盒購于上海基免實業有限公司,GDF-15試劑盒購于上海信裕生物科技有限公司,GFAP試劑盒購于上海酶聯生物科技有限公司,操作過程嚴格按照試劑盒說明書進行。
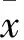
2 結果
2.1 卒中組不同腦梗死體積與對照組血清HCY、GDF-15、GFAP水平比較 卒中組入院時血清HCY、GDF-15、GFAP水平高于對照組(P均<0.05),且隨著腦梗死體積增加,患者血清HCY、GDF-15、GFAP水平升高(P均<0.05)。見表1。
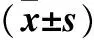
表1卒中組不同腦梗死體積與對照組血清HCY、 GDF-15、GFAP水平比較
注:與對照組比較,aP<0.05;與小梗死比較,bP<0.05;與中等梗死比較,cP<0.05。
2.2 卒中組不同CSS與對照組血清HCY、GDF-15、GFAP水平比較 卒中組入院時血清HCY、GDF-15、GFAP水平高于對照組(P均<0.05),且隨著CSS增加,患者血清HCY、GDF-15、GFAP水平升高(P均<0.05)。見表2。
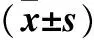
表2卒中組不同CSS與對照組血清HCY、GDF-15、 GFAP水平比較
注:與對照組比較,aP<0.05;與輕度損傷比較,bP<0.05;與中度損傷比較,cP<0.05。
2.3 卒中組不同預后患者血清HCY、GDF-15、GFAP水平比較 120例腦卒中患者,住院期間死亡25例、存活出院105例。與存活患者比較,死亡患者血清HCY、GDF-15、GFAP水平升高(P均<0.05)。見表3。
2.4 卒中組患者血清HCY、GDF-15、GFAP與CSS及腦梗死體積的關系 Pearson相關分析顯示,急性 缺血性腦卒中患者血清HCY、GDF-15、GFAP水平與CSS呈正相關(r分別為0.362、0.338、0.340,P均<0.05),與腦梗死體積亦呈正相關(r分別為0.312、0.328、0.339,P均<0.05)。
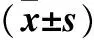
表3腦卒中組不同預后患者血清HCY、 GDF-15、GFAP水平比較
注:與存活患者比較,aP<0.05。
3 討論
目前大量臨床研究表明[8,9],炎癥反應所致的腦血管動脈硬化在腦卒中發生過程中起重要作用,同時炎癥反應還會加劇腦卒中病情的進展,影響腦卒中患者的預后。因此,通過測定腦卒中患者血清相關細胞因子水平將有助于對患者病情及預后進行評價。
Hcy是由甲硫胺基酸經甲基代謝產生的含硫氨基酸,目前多項研究證實Hcy是引起動脈粥樣硬化的危險因素。其在機體中可介導氧自由基及炎癥因子生成,從而引起血管內皮損傷,導致機體慢性炎癥浸潤[10]。岳偉等[11]認為,Hcy是心腦血管疾病發生的獨立危險因素,在動脈粥樣硬化、腦卒中患者中血清Hcy水平顯著升高,且與動脈粥樣硬化程度呈正相關。本研究中卒中組血清Hcy水平高于對照組,死亡者水平顯著高于存活者,且血清Hcy水平與腦卒中患者腦梗死體積及腦損傷程度呈正相關,提示血清Hcy水平與急性缺血性腦卒中發生及病情進展有密切的關系。其機制可能為高Hcy水平可損傷血管內皮細胞,抑制腦血管平滑肌細胞中鎂離子生成,促使血管平滑肌增生,引起動脈粥樣硬化[12];此外,Hcy氧化可促進過氧化自由基生成,促進酯類物質氧化代謝,加重血管內皮細胞氧化損傷,從而影響患者預后。
GDF-15屬于分泌蛋白,是近年新發現的神經缺損功能標志物。Groschel等[13]對腦卒中患者采用免疫組化法觀察病變部位附近神經原發現,在病變神經組織中GDF-15蛋白表達水平顯著升高,而在無病變的腦組織中并未檢測到GDF-15。Schopfer等[14]通過建立腦卒中小鼠模型發現,GDF表達與腦卒中發生有密切的關系;在阻斷小鼠大腦中動脈后24 h,小鼠腦組織中GDF-15蛋白表達水平顯著升高。本研究發現,卒中組血清GDF-15水平顯著高于對照組,且與患者腦梗死體積、CSS及預后有密切的關系。其機制可能為GDF-15可調節器官生長及分化,在抑制機體炎癥反應中起到重要的作用;當腦損傷發生后機體自我保護功能將被啟動,機體會大量釋放GDF-15以抑制損傷后炎癥反應對腦組織的損傷,因此使得血液中GDF-15水平升高。
星形膠質細胞是中樞神經系統重要的組成成分之一,占成人腦細胞總和的40%。GFAP是星形膠質細胞骨架組成的重要成分,可作為星形膠質細胞活化及特異性標志物。腦卒中發生后會刺激星形膠質細胞生成,從而刺激GFAP合成,導致血清GFAP水平顯著升高。近年有研究指出[15],腦損傷后動態觀察血清GFAP水平可為腦損傷早期診斷提供指導。Xiong等[16]研究也指出,腦卒中后48 h內血清GFAP水平顯著升高,且GFAP水平與腦梗死體積呈正相關。本研究卒中組血清GFAP水平高于對照組,死亡者高于存活者,且GFAP與腦卒中患者腦梗死體積及腦損傷程度呈正相關,提示血清GFAP水平與急性缺血性腦卒中發生及病情進展有密切的關系。
綜上所述,血清HCY、GDF-15、GFAP水平與急性缺血性腦卒中患者神經功能缺損程度及梗死體積有密切的關系,可作為急性腦梗死患者病情轉歸及預后的評價指標。
[1] 韓巨.急性缺血性腦卒中的治療[J].中華老年心腦血管病雜志,2014,16(5):559-560.
[2] 張曉璇,仲崇科,曹星華,等.老年急性缺血性腦卒中患者血同型半胱氨酸水平與不良結局的關系[J].中國老年學雜志,2015,35(10):2660-2662.
[3] 盧昌均,韋冰心.血清生長分化因子-15水平與急性缺血性腦卒中的相關性研究[J].中國循環雜志,2015,30(9):872-874.
[4 ] 項薇,潘速躍,武肖娜,等.阿托伐他汀鈣對急性腦卒中患者血清膠質纖維酸性蛋白、腫瘤壞死因子-α、神經元特異性烯醇化酶含量及神經功能變化的影響[J].中國老年學雜志,2016,36(10):2392-2394.
[5] 中華醫學會神經病學分會,中華醫學會神經病學分會腦血管病學組.中國急性缺血性腦卒中診治指南2014[J].中華神經科雜志,2015,48(4):246-257.
[6] Wong EH, Pullicino PM, Benedict R, et al. Deep cerebral infarcts extending to the subinsular region[J]. Stroke, 2001,32(10):2272-2277.
[7] 李晻,楊期東,杜小平,等.腦卒中臨床神經功能缺損程度評分標準在小腦出血中的臨床應用[J].卒中與神經疾病,2001,8(5):286-288.
[8] Dunbar M, Mineyko A. Biomarkers of inflammation in pediatric arterial ischemic stroke[J]. Pediatr Neurol Briefs, 2016,30(11):41-43.
[9] Amadatsu T, Morinaga J, Kawano T, et al. Macrophage-Derived angiopoietin-like protein 2 exacerbates brain damage by accelerating acute inflammation after ischemia-reperfusion[J]. PLoS One, 2016,11(11):166285-166287.
[10] 邱毅,吳波,白昌睿,等.腦卒中患者血清 Hcy、NSE、PAF 水平變化及臨床意義[J].疑難病雜志,2016,15(4):347-350.
[11] 岳偉,吳昊,石志鴻,等.血漿同型半胱氨酸水平與急性缺血性腦卒中患者的卒中復發及死亡關系的研究[J].中華神經醫學雜志,2016,15(7):654-659.
[12] Yao ES, Tang Y, Xie MJ, et al. Elevated homocysteine level related to poor outcome after thrombolysis in acute ischemic stroke[J]. Med Sci Monit, 2016,22(4):3268-3273.
[13] Groschel K, Schnaudigel S, Edelmann F, et al. Growth-differentiation factor-15 and functional outcome after acute ischemic stroke[J]. J Neurol, 2012,259(8):1574-1579.
[14] Schopfer DW, Ku IA, Regan M, et al. Growth differentiation factor 15 and cardiovascular events in patients with stable ischemic heart disease (The Heart and Soul Study)[J]. Am Heart J, 2014,167(2):186-192.
[15] Luger S, Witsch J, Dietz A, et al. Glial fibrillary acidic protein serum levels distinguish between intracerebral hemorrhage and cerebral ischemia in the early phase of stroke[J]. Clin Chem, 2016,23(5):96-98.
[16] Xiong L, Yang Y, Zhang M, et al. The use of serum glial fibrillary acidic protein test as a promising tool for intracerebral hemorrhage diagnosis in Chinese patients and prediction of the short-term functional outcomes[J]. Neurol Sci, 2015,36(11):2081-2087.
貴州省遵義市科技計劃課題(遵義科合社字2014-27號)
羅勇(E-mail: 56493350@qq.com)
10.3969/j.issn.1002-266X.2017.18.016
R743.3
B
1002-266X(2017)18-0046-03
2016-12-13)

