苯并芘和4-溴聯苯醚聯合暴露對大鼠卵巢功能的影響及機制探討
鄧玉潔,劉慧,羅友紅,史文杰,龐偉毅
(桂林醫學院,廣西桂林 541004)
·基礎研究·
苯并芘和4-溴聯苯醚聯合暴露對大鼠卵巢功能的影響及機制探討
鄧玉潔,劉慧,羅友紅,史文杰,龐偉毅
(桂林醫學院,廣西桂林 541004)
目的 觀察苯并芘和4-溴聯苯醚(BDE-3)單獨及聯合暴露對雌性大鼠卵巢功能的影響,并探討其可能的損傷機制。方法 將60只大鼠隨機分為4組,于動情期A、B、C、組分別給予溶于玉米油的苯并芘、BDE-3、苯并芘聯合BDE-3 5 mg/(kg·d)等容灌胃法染毒暴露,D組給予玉米油5 mg/(kg·d),連續灌胃28 d。于動情間期眼球取血,脫椎處死并獲取卵巢組織。采用ELISA 法檢測血清孕酮,分別采用熒光定量PCR、Western blot法檢測卵巢組織中的芳香烴受體(AhR)mRNA、細胞色素P450家族成員1A1(CYP1A1)蛋白。結果 A、B、C組血清孕酮水平及卵巢組織AhR mRNA、CYP1A1蛋白相對表達量均較D組增高,且C組各指標均高于A、B組(P均<0.05);A、B組比較,差異無統計學意義。結論 苯并芘和BDE-3暴露對卵巢功能產生損傷效應,且聯合暴露可產生協同作用;其損傷機制可能是通過AhR調控CYP1A1表達,從而增強對卵巢組織的毒性效應。
苯并芘;4-溴聯苯醚;孕酮;芳香烴受體;細胞色素P450;大鼠
苯并芘是多環芳烴類(PAHs)中具有典型代表性的一種環境污染物,可刺激芳香烴受體(AhR)使其從細胞質轉入細胞核,與芳香族化合物受體核轉運蛋白(ARNT)結合并激活DNA上特定基因,如細胞色素P450家族成員1A1(CYP1A1)等,使DNA構象發生改變,引起相應靶基因的表達異常,從而對細胞產生毒性效應[1,2]。多溴聯苯醚(PBDEs)是公認的持久性有機物污染物,4-溴聯苯醚(BDE-3)是PBDEs脫溴最終降解的產物之一,具有生殖毒性、胚胎毒性、神經發育毒性以及內分泌干擾效應[3~5]。由于PAHs和PBDEs共存于大氣、水體和土壤環境中,毒效應譜有較大重疊,易在生物體內蓄積,影響人類健康。因此,研究二者的聯合作用具有重要意義。2015年11月~2016年6月,我們觀察了苯并芘和BDE-3單獨及聯合暴露前后雌性大鼠血清孕酮水平變化,探討其對卵巢功能的影響及其可能的機制。
1 材料與方法
1.1 材料
1.1.1 實驗動物 健康雌性SD大鼠60只,體質量(180±20)g,8周齡,購自桂林醫學院實驗動物中心,合格證號SCXK桂2007-0001,飼養于桂林醫學院公共衛生學院實驗中心。
1.1.2 主要試劑 玉米油(Acros公司),苯并芘、二甲基亞砜(DMSO)、BDE-3(Sigma公司);大鼠孕酮試劑盒(北京華英技術研究所),Allprep組織/細胞RNA/DNA/Protein 分提試劑盒(北京艾德萊生物科技有限公司);Fast Quant RT Kit、SuperReal PreMix Plus(北京天根生化科技有限公司),引物由蘇州泓迅生物科技有限公司合成;蛋白質定量試劑盒(北京普利萊基因技術有限公司),兔抗鼠CYP1A1多克隆抗體(Millipore公司),兔抗鼠β-actin多克隆抗體(Novusbio公司)。
1.1.3 主要儀器 微量核酸蛋白測定儀(Thermo公司),實時熒光定量PCR儀(ABI公司),全波長酶標儀(Thermo公司),Wes全自動蛋白質印跡定量分析系統(Protein Simple公司)。
1.2 實驗方法
1.2.1 動物分組與染毒處理 將大鼠隨機分為4組,每組15只。于動情期A、B、C、組分別給予溶于玉米油的苯并芘、BDE-3、苯并芘聯合BDE-3 5 mg/(kg·d)等容灌胃法染毒暴露,D組給予玉米油5 mg/(kg·d),連續灌胃28 d。染毒結束后,于動情間期眼球取血,脫椎處死并獲取卵巢組織。
1.2.2 血清孕酮檢測 將全血以3 000 r/min離心5 min,取上層血清,用ELISA法檢測血清孕酮。
1.2.3 卵巢組織AhR mRNA檢測 采用熒光定量PCR法。采用Allprep劑盒提取卵巢組織的總RNA,按Fast Quant RT Kit合成cDNA,再用SuperReal PreMix Plus以cDNA為模板進行熒光定量PCR擴增。AhR上游引物5′-GGCCAAGAGCTTCTTTGATG-3′,下游引物5′-TGCCAGTCTCTGATTTGTGC-3′,產物長度93 bp;β-actin上游引物5′-CTACAATGAGCTGCGTGTG-3′,下游引物5′-TGGGGTGTTGAAGGTCTC-3′,產物長度121 bp。反應體系:2×SuperReal PreMix Plus 12.5 μL,正反向引物各0.75 μL,cDNA模板1 μL,50×ROX Reference Dye 0.05 μL,RNase-free ddH2O 9.95 μL。反應條件:95 ℃預變性15 min; 95 ℃ 10 s,60 ℃ 30 s,40個循環。PCR實驗數據采用相對定量,以2-ΔΔCt法計算。
1.2.4 卵巢組織CYP1A1蛋白檢測 采用Western blot法。用Allprep試劑盒提取卵巢組織的蛋白并溶于1% SDS溶液中,按BCA法測定蛋白濃度。按Wes配套試劑盒操作步驟制備樣品(終濃度為0.2 μg/μL),再按說明將樣品、生物素、封閉液、一抗、HRP標記的二抗及化學發光液抗體等試劑加入上樣板,室溫離心5 min(2 500 r/min)后上機進行全自動蛋白質印跡定量分析。Compass軟件將采集的熒光信號轉換為蛋白分子量數據及相應的表達圖譜,以樣本蛋白與內參蛋白的峰值面積比值表示該蛋白的相對表達量。
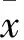
2 結果
各組大鼠血清孕酮水平及卵巢組織中AhR mRNA、CYP1A1蛋白相對表達量比較。見表1。
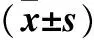
表1各組大鼠血清孕酮水平及卵巢組織AhR mRNA、 CYP1A1蛋白相對表達量比較
注:與D組比較,*P<0.05;與A組比較,#P<0.05;與B組比較,△P<0.05。
3 討論
大量研究[6~8]顯示,PAHs和PBDEs已成為多種腫瘤的危險因素,與乳腺癌、卵巢癌等的發生密切相關。孕酮由卵巢和腎上腺產生,在應激反應和下丘腦-垂體-腎上腺/性腺軸的調節方面具有重要作用。研究顯示,環境內分泌干擾物具有非單調劑量-效應性,表現為低劑量促進而高劑量抑制。研究發現,將小鼠出生前暴露于己烯雌酚(DES) 中,DES對前列腺發育產生低劑量增殖、高劑量抑制的倒U形劑量-效應關系。Tian等[9]研究發現,苯并芘染毒第3天櫛孔扇貝孕酮水平下降,而在第10天孕酮水平上升。表明苯并芘嚴重干擾了孕酮的正常波動,導致卵巢功能障礙。本研究結果顯示,苯并芘和BDE-3暴露大鼠血清孕酮水平增加,可能是低劑量暴露呈現的激活效應。
AhR是一類配體激活轉錄子,參與數種基因的調控,如外源性代謝酶CYP450中CYP1A1的形成,可在卵巢中分泌類固醇的間質細胞、卵泡顆粒細胞和黃體細胞中表達;被激活的CYP1A1能將環境中的多種有機物質如PAHs轉化為細胞毒素或其他致癌物質,從而增加癌癥發生危險。有研究[10,11]顯示,苯并芘能激活AhR誘導CYP450轉錄表達,將苯并芘代謝為活性化合物7,8-二氫二醇-9,10-環氧苯并(a)芘,與DNA形成加合物,導致卵巢顆粒細胞中活性氧的形成,從而損傷卵巢功能。Sobinoff等[7]發現,在卵巢中苯并芘通過激活AhR誘導CYP450代謝和氧化應激反應,使基因表達、細胞周期、細胞生長發育和細胞間的信號傳導等受影響,可激活未成熟的原始卵泡、損傷卵母細胞并使生長卵泡發生閉鎖,導致組織發生損傷效應。有研究[12,13]顯示,PBDEs可能通過激活AhR或誘導CYP450高表達等發揮致癌、致突變功能。Talsness等[14]研究發現,孕期雌性大鼠暴露于PBDEs,可導致卵巢細胞結構異常,影響生殖功能。目前國內外關于苯并芘的研究較多,BDE-3的研究較少,而同時探討兩者在哺乳動物體內聯合效應的研究更少。本研究結果顯示,苯并芘、BDE-3染毒的大鼠血清孕酮及卵巢組織中AhR和CYP1A1表達水平均較未染毒大鼠明顯增高,且聯合暴露較于苯并芘和BDE-3的單獨作用各指標增高更明顯。因此,我們認為苯并芘和BDE-3暴露對卵巢功能產生損傷效應,且聯合暴露可產生協同作用;其損傷機制可能是通過AhR調控CYP1A1表達,從而增強對卵巢組織的毒性效應。然而,關于兩者協同效應的機制尚需進一步研究。
[1] Barouki R, Coumoul X, Fernandez-Salguero PM. The aryl hydrocarbon receptor, more than a xenobiotic-interacting protein[J]. FEBS Lett, 2007,581(19):3608-3615.
[2] Stejskalova L, Dvorak Z, Pavek P. Endogenous and exogenous ligands of aryl hydrocarbon receptor: current state of art[J]. Curr Drug Metab, 2011,12(2):198-212.
[3] Birnbaum LS, Staskal DF. Brominated flame retardants: cause for concern[J]. Environ Health Perspect, 2004,112(1):9-17.
[4] 萬斌,郭良宏.多溴聯苯醚的環境毒理學研究進展[J].環境化學,2011,30(1):143-152.
[5] Darnerud PO, Risberg S. Tissue localisation of tetra- and pentabromodiphenyl ether congeners (BDE-47, -85 and -99) in perinatal and adult C57BL mice[J]. Chemosphere, 2006,62(3):485-493.
[6] Guo J, Xu Y, Ji W, et al. Effects of exposure to benzo[a]pyrene on metastasis of breast cancer are mediated through ROS-ERK-MMP9 axis signaling[J]. Toxicol Lett, 2015,234(3):201-210.
[7] Sobinoff AP, Pye V, Nixon B, et al. Jumping the gun: smoking constituent BaP causes premature primordial follicle activation and impairs oocyte fusibility through oxidative stress[J]. Toxicol Appl Pharmacol, 2012,260(1):70-80.
[8] Aschebrook-Kilfoy B, Dellavalle CT, Purdue M, et al. Polybrominated diphenyl ethers and thyroid cancer risk in the Prostate, Colorectal, Lung, and Ovarian Cancer Screening Trial cohort[J]. Am J Epidemiol, 2015,181(11):883-888.
[9] Tian S, Pan L, Sun X. An investigation of endocrine disrupting effects and toxic mechanisms modulated by benzo pyrene in female scallop chlamys farreri[J]. Aquat Toxicol, 2013,144-145:162-171.
[10] Ramesh A, Archibong AE, Niaz MS. Ovarian susceptibility to benzo(a)pyrene: tissue burden of metabolites and DNA adducts in F-344 rats[J]. J Toxicol Environ Health A, 2010,73(23):1611-1625.
[11] Safe S, McDougal A. Mechanism of action and development of selective aryl hydrocarbon receptor modulators for treatment of hormone-dependent cancers[J]. Int J Oncol, 2002,20(6):1123-1128.
[12] 王若希,劉曉暉,邵靜,等.多溴聯苯醚致癌效應研究進展[J].中國預防醫學雜志,2012,13(12):947-950.
[13] Courter LA, Musafia-Jeknic T, Fischer K, et al. Urban dust particulate matter alters PAH-induced carcinogenesis by inhibition of CYP1A1 and CYP1B1[J]. Toxicol Sci, 2007,95(1):63-73.
[14] Talsness CE, Shakibaei M, Kuriyama SN, et al. Ultrastructural changes observed in rat ovaries following in utero and lactational exposure to low doses of a polybrominated flame retardant[J]. Toxicol Lett, 2005,157(3):189-202.
廣西自然科學基金資助項目(2013GXNSFBA019190);廣西高校科學技術研究項目(2013ZD044)。
龐偉毅(E-mail: p.weiyi@live.cn)
10.3969/j.issn.1002-266X.2017.18.008
R114
A
1002-266X(2017)18-0026-03
2017-02-23)

