生長激素對人外周血來源NK細胞殺傷活性的影響及機制探討
徐瑞玉,安新榮,陳曉琳,孟維霞,李珍珠,李澤福
(濱州醫學院附屬醫院,山東濱州 256600)
生長激素對人外周血來源NK細胞殺傷活性的影響及機制探討
徐瑞玉,安新榮,陳曉琳,孟維霞,李珍珠,李澤福
(濱州醫學院附屬醫院,山東濱州 256600)
目的 觀察生長激素(GH)對人外周血來源自然殺傷(NK)細胞殺傷活性的影響,并探討其機制。方法 選取10名健康志愿者,采用免疫磁珠法分離并培養其外周血NK細胞。將NK細胞分為A、B、C組,分別與終濃度0、5 、20 μg/mL的重組人GH共培養48 h。以人類髓性白血病K562細胞為靶細胞,NK細胞為效應細胞,按不同的效靶比(25∶1、50∶1、100∶1)混合,采用CCK-8 法檢測NK細胞對K562細胞的殺傷率;取各組培養48 h的NK細胞,分別采用流式細胞術和Real-time RT-PCR法檢測NK細胞表面活化受體NKG2D蛋白及基因。結果 三個不同效靶比下,B、C組NK細胞對K562細胞的殺傷率高于A組,且C組高于B組(P均<0.01)。A、B、C組NKG2D陽性表達的NK細胞百分數分別為78.8%±2.8%、87.5%±3.1%、91.8%±3.3%,B、C組NKG2D陽性表達的NK細胞百分數高于A組(P均<0.05)。A、B、C組NKG2D mRNA相對表達量分別為1±0.01、5±2.32、10±3.21,B、C組NKG2D mRNA相對表達量高于A組,且C組高于B組(P均<0.05)。結論 GH可通過上調NK細胞NKG2D的表達,增強其殺傷活性。
生長激素;自然殺傷細胞;殺傷作用;NK細胞表面活化受體;神經-內分泌-免疫
生長激素(GH)在人體生長發育過程中起重要作用[1],也可作為應激性激素參與免疫調節,在人體適應環境過程中發揮重要作用[2]。目前,GH對免疫系統影響的具體機制尚不清楚[3,4]。研究發現,GH缺乏會影響免疫器官的發育,如胸腺[5,6];同時,在缺少GH的兒童體內有多種免疫細胞功能下降[7]。然而,在長期大劑量GH作用下也會導致相應的免疫功能受損,如長期濫用GH的運動員更易感染疾病。NKG2D是NK細胞表面重要的活化受體之一,與其配體結合后能直接影響NK細胞的殺傷活性[8~10]。早在上個世紀80年代,就有學者發現GH能影響NK細胞免疫活性[11],但具體機制尚不清楚。隨著近年來對神經-內分泌-免疫研究的深入,有必要進一步深入研究GH對NK細胞的影響。2015年2月~2016年7月,我們觀察了rhGH對人外周血NK細胞殺傷活性的影響,并檢測NKG2D的表達變化,為神經-內分泌-免疫通路提供理論補充。
1 材料與方法
1.1 材料 重組人生長激素(rhGH,Sciencell,美國);PBS(武漢博士德生物工程有限公司);人淋巴細胞分離液 Ficoll-Paque(天津灝洋生物有限公司);胎牛血清及含雙抗RPMI1640培養基(Hyclone, 美國);CCK-8試劑盒 (同仁化工, 日本);重組人白細胞介素2(rhIL-2,Gibco, 美國);藻紅蛋白(PE)標記的小鼠抗人CD56單克隆抗體、異硫氰酸熒光素(FITC)標記小鼠抗人NKG2D(CD314)及NK細胞miniMACS免疫磁珠分選系統(Miltenyi Biotec,德國);Real-time RT-PCR試劑盒(大連寶生物工程有限公司);PCR引物(上海生工生物工程股份有限公司);人類髓性白血病K562細胞系由我院實驗室提供。
1.2 實驗方法
1.2.1 NK細胞的分離與純化 于濱州醫學院招聘10名健康志愿者,男7名、女3名,平均年齡21.5歲,無體育專業者;均簽署知情同意書,并獲校倫理委員會批準。篩查其靜息下血GH水平均正常后,抽取靜息空腹外周靜脈血20 mL,肝素抗凝備用。通過密度梯度離線法吸取中間云霧層單個核細胞(PBMC),PBS洗滌2次;按每107個細胞加入70 μL Buffer重懸后,再加入20 μL CD56磁珠抗體,在2~8 ℃環境下孵化15 min;加入1 mL Buffer 混勻后以300 r/min離心5 min,再加500 μL Buffer 重懸。選用MS分離柱,放于miniMACS分離磁場中,使用前用Buffer 500 μL 濕潤柱壁;放置收集管,將重懸的細胞上柱,再加用3×500 μL Buffer洗柱。最后將分離柱脫離磁場,放置新的收集管上,快速推注1 mL Buffer沖下NK細胞。收集NK細胞培養,取少量細胞用CD56-FITC標記驗證純度>95%。
1.2.2 NK細胞培養與分組處理 將NK細胞密度調整為2× 105/mL,以1 mL/孔接種于含10%滅活胎牛血清、IL-2 (100 U/mL) 的RPMI1640培養體系的24孔板中,置37 ℃、5% CO2培養箱中培養。將NK細胞分為A、B、C組,分別與終濃度0、5 、20 μg/mL的rhGH共培養。
1.2.3 NK細胞殺傷活性觀察 收集對數生長期的K562細胞及培養48 h 的NK細胞,以K562細胞為靶細胞,NK細胞為效應細胞,按不同的效靶比(25∶1、50∶1、100∶1)混合;同時單設靶細胞孔、效應細胞孔和培養基空白對照孔,均設3個平行復孔,置37 ℃、5%CO2培養箱中培養12 h;每孔加入CCK-8 10 μL,混勻后繼續培養4 h;用酶標儀測定每孔450 nm波長處的OD值,計算3個平行孔的平均值。細胞殺傷活性=[1-(效靶細胞作用孔OD值-效應細胞孔OD值)/靶細胞OD值]×100%。
1.2.4 NK細胞中NKG2D 蛋白檢測 采用流式細胞術。取培養48 h的NK細胞100 μL(1×105~1×106個細胞),加熒光抗體CD56-FITC、NKG2D-PE各10 μL,充分混勻后4 ℃避光靜置30 min;以5 mL PBS洗滌1次,1 200 r/min離心10 min,棄上清。加入300~500 mL PBS,上流式細胞儀檢測NKG2D陽性表達的NK細胞百分數,以此觀察NKG2D 蛋白表達情況。
1.2.5 NK細胞中NKG2D mRNA檢測 采用Real-time RT-PCR法。取培養48 h的NK細胞,破膜后提取其mRNA;然后反轉錄為 cDNA,以β-actin為內參基因實時定量分析NKG2D的含量。NKG2D上游引物為5′-AAGCTTAGGATGGGGTGGATTCGTGGTC-3′,下游引物為5′-GAATTCCCACAGTCCTTTGCATGCAGATGTA-3′;β-actin上游引物為 5′-CTGGGACGACATGGAGAAA-3′,下游引物為5′-AAGGAAGGCTGGAAGAGTGC-3′。反應條件:95 ℃預變性5 min;95 ℃變性1 min、58 ℃退火1 min、72 ℃延伸1 min,共35個循環;72 ℃再延伸10 min。以2-ΔΔCt計算NKG2D mRNA相對表達量。
2 結果
2.1 各組NK細胞殺傷活性比較 見表1。
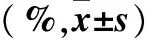
表1 各組NK細胞對K562細胞的殺傷活性比較
注:與A組同一效靶比比較,*P<0.01;與B組同一效靶比比較,#P<0.01。
2.2 各組NK細胞中NKG2D 蛋白表達比較 A、B、C組NKG2D陽性表達的NK細胞百分數分別為78.8%±2.8%、87.5%±3.1%、91.8%±3.3%,B、C組NKG2D陽性表達的NK細胞百分數高于A組,且C組高于B組(P均<0.05)。
2.3 各組NK細胞中NKG2D mRNA表達比較 A、B、C組NKG2D mRNA相對表達量分別為1±0.01、5±2.32、10±3.21,B、C組NKG2D mRNA相對表達量高于A組,且C組高于B組(P均<0.05)。
3 討論
GH是人體生長發育不可或缺的激素,主要作用為調控機體生長發育,同時也參與機體應激反應。人體內GH分泌量通常在一個正常范圍波動,但當機體處于應激狀態時,其分泌量將劇烈上升,其結果有利于升高血糖,有利于心腦等重要臟器的能量補充[1];同時應激狀態也會激活免疫系統[10],而這有利于抵抗一些惡劣環境或者嚴重的微生物感染[12]。
GH可與GH受體(GHR)相結合來發揮作用[5],目前發現GHR表達于淋巴細胞、NK細胞、成纖維細胞、巨噬細胞、軟骨細胞等。研究[13]發現,GHR主要表達于T淋巴細胞及NK細胞等外周血免疫細胞的表面。NK細胞發揮免疫活性時不需要抗原的遞呈,它可以通過細胞表面的各種活化受體直接來識別靶細胞,并且發揮免疫殺傷作用,其作用較為迅速。NKG2D是NK細胞表面主要活化受體之一,其配體較為多樣,也存在種屬差異[3]。例如,配體人組織相容性復合物類似物-1(MICA)主要表達在人體內,鼠類并不表達。NKG2D的配體在應激狀態時會表達上調,例如感染、腫瘤等[14]。
本實驗發現,加入GH能夠顯著上調NK細胞表面NKG2D膜蛋白及相應mRNA的表達,細胞毒性實驗發現NK細胞在含有GH環境下其殺傷能力顯著提高。目前,GH能在體內外激活NK細胞的殺傷活性已被廣泛報道。一項雙盲實驗在人體上進行,通過注射rhGH或安慰劑來研究GH對NK細胞的活性,發現注射rhGH后志愿者體內NK細胞數目及殺傷活性要明顯強于注射安慰劑組[7]。通過對缺乏GH患者的研究發現,相比正常人其體內的NK細胞在數目及殺傷活性均下降;然后在經過GH替代治療3個月后,NK細胞的數目及殺傷活性又恢復至正常水平[15]。但是,GH對NK細胞的影響似乎遠非如此簡單。例如,在高GH血癥的肢端肥大癥患者體內,并沒有發現NK細胞免疫活性高過正常人,甚至這一類患者往往伴有垂體瘤或大腸癌的發生[4]。本實驗以表面活化受體NKG2D為觀察指標,來探究GH對NK細胞的作用,該研究結果補充了神經-垂體-免疫軸信號途徑,同時也為臨床合理應用GH提供了重要理論基礎。
[1] Zhou RX, Weng FZ, Yan J, et al. The effect of enteral nutritional support and growth hormone on critical patients[J]. Zhongguo Wei Zhong Bing Ji Jiu Yi Xue, 2010, 22(1):40-43.
[2] Webster Marketon JI, Glaser R. Stress hormones and immune function[J]. Cell Immunol, 2008, 252(1-2):16-26.
[3] Baragano RA, Suarez AB, Lopez LC. Secretory pathways generating immunosuppressive nkg2d ligands: ew targets for therapeutic intervention[J]. Oncoimmunology, 2014,3:28497-28500.
[4] Chanson P, Salenave S, Kamenicky P. Pituitary tumours: acromegaly [J]. Handb Clin Neurol, 2014,124:197-219.
[5] Kotzmann H, Koller M, Czernin S, et al. Effect of elevated growth hormone concentrations on the phenotype and functions of human lymphocytes and natural killer cells[J]. Neuroendocrinology, 1994,60(6):618-625.
[6] Villanua MA, Szary A, Esquifino AI, et al. Thymostimulin effects on lymphoid organs in ames dwarf mice[J]. Acta Endocrinol, 1993,128(1):74-80.
[7] Crist DM, Kraner JC. Supplemental growth hormone increases the tumor cytotoxic activity of natural killer cells in healthy adults with normal growth hormone secretion[J]. Metabolism, 1990,39(12):1320-1324.
[8] Lopez-Soto A, Huergo-Zapico L, Acebes-Huerta A, et al. Nkg2d signaling in cancer immunosurveillance[J]. Int J Cancer, 2015,136(8):1741-1750.
[9] Huergo-Zapico L, Acebes-Huerta A, Lopez-Soto A, et al. Molecular bases for the regulation of nkg2d ligands in cancer[J]. Front Immunol, 2014,5:106-110.
[10] Marcus A, Gowen BG, Thompson TW, et al. Recognition of tumors by the innate immune system and natural killer cells[J]. Adv Immunol, 2014,122:91-128.
[11] Saxena QB, Saxena RK, Adler WH. Regulation of natural killer activity in vivo. Iii. Effect of hypophysectomy and growth hormone treatment on the natural killer activity of the mouse spleen cell population[J]. Int Arch Allergy Applied Immunol, 1982,67(2):169-174.
[12] Baeza I, Alvarado C, Alvarez P, et al. Improvement of leucocyte functions in ovariectomised aged rats after treatment with growth hormone, melatonin, oestrogens or phyto-oestrogens[J]. J Reprod Immunol, 2009,80(1-2):70-79.
[13] Badolato R, Bond HM, Valerio G, et al. Differential expression of surface membrane growth hormone receptor on human peripheral blood lymphocytes detected by dual fluorochrome flow cytometry[J]. J Clin Endocrinol Metab, 1994,79(4):984-990.
[14] Zwirner NW, Fuertes MB, Girart MV, et al. Cytokine-driven regulation of nk cell functions in tumor immunity: role of the mica-nkg2d system [J]. Cytokine Growth Factor Reviews, 2007,18(1-2):159-170.
[15] Span JP, Pieters GF, Smals AG, et al. Number and percentage of nk-cells are decreased in growth hormone-deficient adults[J]. Clin Immunol Immunopathol, 1996,78(1):90-92.
Effect of growth hormone on cytotoxicity of NK cells from PBMC
XURuiyu,ANXinrong,CHENXiaolin,MENGWeixia,LIZhenzhu,LIzefu
(TheAffiliatedHospitalofBinzhouMedicalUniversity,Binzhou256600,China)
Objective To investigate the effect of growth hormone on the cytotoxicity of natural killer (NK) cells from human peripheral blood mononuclear cells (PBMC) and the possible mechanism. Methods NK cells, purified by magnetic activated cell sorting (MACS) from 10 volunteers, were divided into three groups. Cells in the groups A, B and C were co-cultured with recombinant human growth hormone (rhGH) (A∶0 μg/mL, B:5 μg/mL, C:20 μg/mL). After 48 h, the cytotoxicity of NK cells against K562 cells, with different effector-target ratio (25∶1, 50: 1, 100∶1), was analyzed by CCK-8. Real-time RT-PCR and flow cytometry were used to detect the expression of natural killer cell group 2 member D (NKG2D), in the levels of gene and protein molecules. Results The cytotoxicity of NK cells against K562 cells in the group B and C was significantly higher than that in the group A at different effector-target ratio, and group C was higher than group B (allP<0.01). The percentages of NK cells with positive expression of NKG2D in the groups A, B and C were 78.8%±2.8%, 87.5%±3.1% and 91.8%±3.3%, respectively, and group B and C were higher than group A (allP<0.05). The relative expression of NKG2D mRNA of NK cells in the groups A, B and C was 1±0.01, 5±2.32 and 10±3.21 respectively. The expression of NKG2D mRNA in the group B and C was significantly higher than that of group A, and group C was higher than group B (allP<0.05). Conclusion Growth hormone may enhance the cytotoxicity of NK cells from PBMC by up-regulating the expression of NKG2D.
growth hormone; natural killer cells; killing effect; natural killer cell group 2 member D; nerve-endocrine-immune
國家自然科學基金資助項目(81171119);濱州醫學院科研計劃課題項目(BY2015KJ28)。
徐瑞玉(1988-),女,學士,主要研究方向為內分泌與免疫。E-mail: timeanddoctor@hotmail.com
李澤福(1969-),男,博士,主任醫師,主要研究方向為神經與免疫。E-mail: lizefu@bzmc.edu.cn
李珍珠(1987-),男,醫師,碩士,主要研究方向為神經與免疫。E-mail: lizhenzhu@bzmc.edu.cn
10.3969/j.issn.1002-266X.2017.18.006
R392
A
1002-266X(2017)18-0020-03
2016-10-26)

