亞硒酸鈉對谷氨酸所致神經細胞損傷的影響及機制
王娟,買莉,王李瑤,常越,景麗
(1寧夏醫科大學,銀川750004;2銀川市婦幼保健院;3陜西省中醫院)
亞硒酸鈉對谷氨酸所致神經細胞損傷的影響及機制
王娟1,買莉2,王李瑤3,常越1,景麗1
(1寧夏醫科大學,銀川750004;2銀川市婦幼保健院;3陜西省中醫院)
目的觀察亞硒酸鈉對谷氨酸(Glu)所致神經細胞損傷的影響,并探討其機制。方法將HT22神經細胞分成3組,對照組加入細胞培養液培養,Glu組加入6 mmol/L Glu和細胞培養液共同培養,亞硒酸鈉組加入100 nmol/L亞硒酸鈉、6 mmol/L Glu和細胞培養液共同培養。MTT法檢測各組6、10、24 h的細胞增殖抑制率;倒置顯微鏡觀察細胞大體形態,透射電鏡觀察細胞超微結構;采用氧自由基(ROS)特異性標記探針DHE對各組細胞進行標記,用熒光電子顯微鏡觀察DHE表達。結果Glu組培養6 h時的細胞增殖抑制率為8.71%±0.009%,10、24 h時細胞增殖抑制率較6 h時升高,24 h時最高;亞硒酸鈉組各時點細胞增殖抑制率均較Glu組降低(P均<0.05)。倒置顯微鏡下可見Glu組細胞數量較對照組減少,細胞皺縮、形態不規則,亞硒酸鈉組細胞數量較Glu組數量增多;透射電鏡下可見Glu組細胞凋亡數目較對照組增加,線粒體、內質網損傷加重,亞硒酸鈉組細胞凋亡數量較Glu組減少。熒光電子顯微鏡觀察顯示,Glu組較對照組DHE染色的平均光密度增加,亞硒酸鈉組DHE染色較Glu減輕(P均<0.01)。結論硒能夠減輕Glu對神經細胞的損傷作用,其機制可能與減少ROS產生有關。
硒;亞硒酸鈉;谷氨酸;神經細胞損傷;氧自由基
谷氨酸(Glu)是重要的興奮性氨基酸類神經遞質,廣泛分布于哺乳動物中樞神經系統內,在神經元的分化、遷移、生長以及生存等過程中發揮重要作用[1,2]。但過多的Glu集聚會導致Glu受體過度激活,進而引發神經細胞內鈣超載等一系列興奮性毒性,導致神經細胞凋亡、壞死[3,4]。硒是人體正常生命活動必不可少的微量元素之一,主要以特異的氨基酸-硒代半胱氨酸(SeCys)形式整合到硒蛋白中發揮生物學效應。氧自由基(ROS)在細胞內過量積累可以引發氧化應激反應,而氧化應激被認為是間歇性低氧所致各系統損傷的病理機制之一。研究證實,硒可以減少ROS的產生,保護細胞對抗Glu毒性、氧化應激和炎癥細胞因子造成的損傷。為了進一步明確硒對神經細胞保護作用的機制,我們對Glu損傷的神經細胞給予亞硒酸鈉進行干預,觀察細胞增殖、細胞形態及超微結構的變化,并觀察ROS標志物的產生,探討亞硒酸鈉對Glu所致神經細胞損傷的影響及機制。
1 材料與方法
1.1 材料 小鼠永生型海馬神經元HT-22細胞株(北京北納創聯生物技術有限公司);MTT試劑盒(Trevigen, Inc);ROS熒光探針-DHE(威格拉斯生物北京公司);DMEM/F12培養基(HyClone Cell Culture and Bioprocessing );96孔無菌培養板(Corning公司);DAPI(C-0033)(博奧森公司);胎牛血清(HyClone Cell Culture and Bioprocessing)。
1.2 細胞培養與分組處理 取HT-22細胞,加入胰蛋白酶消化,加入新鮮培養液制成細胞懸液,調整細胞密度為1×105/mL,按100 μL/孔接種于96孔板。將細胞分為3組,對照組加入無血清DMEM/F12培養基;Glu組加入6 mmol/L谷氨酸和無血清DMEM/F12培養基;亞硒酸鈉組加入6 mmol/L谷氨酸、100 nmol/L亞硒酸鈉和無血清DMEM/F12培養基共同孵育。
1.3 細胞增殖抑制率檢測 采用MTT法。3組細胞培養至6、10、24 h時,棄上清液,PBS漂洗,加入含5 g/L MTT的新鮮培養液繼續培養4 h,棄上清,加入Formazan溶解液,振蕩混勻,待紫色結晶物充分溶解后,用酶聯免疫檢測儀檢測490 nm處各孔吸光度(OD)值。計算各組細胞增殖抑制率,細胞增殖抑制率=1-(實驗組OD值/對照組OD值)×100%。每組設6個復孔,計算平均值。
1.4 細胞形態與超微結構觀察 取對數生長期細胞接種于新培養瓶中,置于37 ℃、5% CO2的培養箱中培養,生長24 h后,調整細胞懸液密度為1×105/mL,200 μL/孔接種于新培養皿中生長24 h,按1.2分組方法加藥干預,培養24 h后,加入胰酶消化,收集細胞,離心棄上清,加入戊二醛溶液4 ℃固定10 min,離心棄上清,重復離心、固定細胞操作。棄上清,加入二甲砷酸鈉緩沖液4 ℃放置30 min,加入1%鋨酸4 ℃固定2 h,二甲砷酸鈉緩沖液沖洗。階梯脫水,環氧丙烷滲透,包埋液浸泡,42 ℃溫箱過夜。用超薄切片機切成80 nm厚的超薄切片,經檸檬酸鉛和醋酸雙氧鈾染色后,用電子顯微鏡觀察切片中細胞超微結構的改變。
1.5 ROS標志物檢測 取對數生長期細胞,調整細胞懸液密度為1×105/mL,按200 μL/孔接種于12孔板內的無菌細胞爬片上,置于37 ℃、5% CO2培養箱內培養24 h。按1.2分組方法加藥干預,培養24 h后,加入PBS稀釋的50 μmol/L DHE 200 μL,37 ℃、5% CO2培養箱中孵育45 min。PBS漂洗,4%多聚甲醛固定。用抗淬滅封片劑封片,立刻在熒光顯微鏡下觀察、拍照。以胞質出現紅色顆粒為DHE表達陽性,檢測陽性表達的平均光密度值,使用Imge-pro plus6.0軟件分析采集圖片的結果。
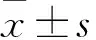
2 結果
2.1 三組細胞增殖抑制率比較 Glu組6、10、24 h時的細胞增殖抑制率分別為8.71%±0.009%、28.87%±0.043%、35.64%±0.036%,10、24 h時的細胞增殖抑制率均高于6 h,24 h時最高(P均<0.01)。亞硒酸鈉組6、10、24 h時的細胞增殖抑制率分別為4.41%±0.069%、13.14%±0.106%、20.07%±0.161%,各時點細胞增殖抑制率均明顯低于Glu組(P均<0.05)。
2.2 三組細胞形態與超微結構比較 倒置顯微鏡下可見,對照組細胞形態良好,呈多角形或長梭形;Glu組與對照組相比,細胞數量減少,大小不一,胞質減少并可見凋亡細胞;亞硒酸鈉組較對照組細胞數量減少,但較Glu組細胞數量增多,細胞狀態明顯好轉。電子顯微鏡下顯示,對照組細胞形態正常,具有完整的胞膜、胞核,豐富的細胞器,清晰的線粒體嵴,粗面內質網形態正常、顆粒分布均勻;Glu組較對照組凋亡細胞增多,胞核不完整甚至崩解碎裂,細胞器明顯減少;線粒體、內質網明顯水腫,部分崩解;亞硒酸鈉組較Glu組細胞微結構損傷明顯減輕。
2.3 三組ROS標志物比較 三組DHE光密度值分別為0.004±0.000 2、0.070±0.003 9、0.045±0.002 1,對照組DHE幾乎不顯色,Glu組探針著色較對照組增加(P<0.01),亞硒酸鈉組較Glu組DHE染色減輕(P<0.01)。
3 討論
Glu主要存在于中樞神經系統內,多位于大腦皮層和海馬等部位,參與約50%的神經系統突觸傳遞過程,參與幾乎包括學習、記憶、運動、認知和發育等腦內的所有活動。它在中樞神經系統內的作用被認為是把雙刃劍,Glu過度集聚時會引發神經細胞內鈣超載等一系列興奮性毒性反應,這一過程中會形成大量ROS,過量ROS引起線粒體膜去極化和相關蛋白酶活化,介導神經細胞的過度激活引起細胞死亡,這一過程被稱為Glu興奮性毒性作用[5,6]。本研究顯示,在細胞培養液中加入Glu后,與對照組相比,Glu組細胞數量減少,胞核不完整甚至崩解碎裂,細胞器明顯減少,ROS產生增加。證實Glu對神經細胞具有損傷作用,這種損傷作用可能與ROS的產生增加有關。
硒作為一種微量元素對人體細胞發揮正常功能必不可少。目前常用的補硒劑主要有無機硒和有機硒兩類,亞硒酸鈉屬于無機硒。硒可直接影響神經細胞的生長發育,進而可能對智能發育產生影響[7,8]。實驗研究[9]發現,硒可以影響大鼠大腦皮層、海馬神經細胞的體外生長發育,使神經細胞存活數增加,即使在無血清的條件下對神經細胞存活依然具有促進作用。ROS主要在線粒體中產生,在線粒體呼吸過程中,少量電子可以從線粒體電子傳遞鏈復合體Ⅰ和Ⅲ中漏出,漏出的電子與O2結合生成ROS。當細胞內的ROS處于正常水平時,并不會對細胞造成過度損傷,但在環境變化、藥物刺激、細菌感染等狀態下,細胞內的ROS水平會顯著升高。有研究發現,在神經退行性疾病中能夠檢測到ROS生成增加及氧化應激增強[10,11],這最終可導致細胞不同程度損傷甚至發生細胞凋亡[12]。多種凋亡刺激因子都可使ROS 水平增高,使用ROS拮抗劑干預后可以在一定程度上拮抗凋亡,大量證據還支持 ROS 與凋亡誘導早期線粒體變化有關系[13]。線粒體內膜參與氧化呼吸這一重要生物學過程中的電子傳遞,ROS是這一過程中產生的關鍵信號分子,它作為胞內重要的第二信使,能夠激活包括細胞增殖、凋亡等多種關鍵性的信號通路。本實驗同時觀察了線粒體和ROS的產生,結果發現亞硒酸鈉組較谷氨酸組線粒體數量明顯增多,ROS的產生明顯減少,說明亞硒酸鈉能夠緩解神經細胞的損傷。
我們的前期研究[14]表明,硒蛋白能夠緩解Glu對神經細胞的損傷,但對于外源性加入亞硒酸鈉是否能緩解Glu對神經細胞的損傷還不清楚。本研究結果顯示,在細胞培養液中加入亞硒酸鈉后,培養6、10、24 h時的細胞增殖抑制率均低于Glu組,細胞數量較Glu組增多,細胞大體形態及超微結構較Glu組好轉,ROS產生減少。說明硒可能通過減少ROS的產生來緩解Glu對神經細胞的損傷作用。
綜上所述,Glu可以引起神經細胞損傷,硒能夠緩解Glu對神經細胞的損傷作用,其機制可能與減少ROS產生有關。
[1] Liu XD, Gong SM, Yang RH, et al. Apoptosis of retina nervous cells induced by microwave and the protective effects of selenium[J]. J Fourth Mil Med Univ, 2000,21(6):720-704.
[2] Liu P, Smith PF, Darlington CL. Glutamate receptor subunits expression in memory-associated brain structures: Regional variations and effects of aging[J]. Synapse, 2010,62(11):834-841.
[3] 張廣云,胡曉,袁平,等.谷氨酸誘導新生小鼠皮層神經細胞損傷體外模型的建立[J].神經解剖學雜志,2012,28(4):363-367.
[4] 景昊,李峰.田麻益智顆粒對谷氨酸損傷的原代海馬神經元的保護作用[J].中華中醫藥學刊,2014(8):1968-1971.
[5] Zhang Y, Sun Q, He B, et al. Anti-inflammatory effect of hydrogen-rich saline in a rat model of regional myocardial ischemia and reperfusion[J]. Int J Cardiol, 2011,148(1):91.
[6] Lee MC, Ting KK, Adams S, et al. Characterisation of the expression of NMDA receptors in human primary astrocytes[J]. PLoS One, 2010,5(11):e14123.
[7] 蘇敏,田東萍,徐小虎,等.碘、硒對培養新生SD大鼠大腦皮層神經細胞生長形態學共聚焦激光顯微鏡觀察[J].國際中華微量元素雜志,2000,1(2):68-69.
[8] Liu XD, Gong SM, Yang RH, et al. Apoptosis of retina nervous cells induced by microwave and the pro-tective effects of selenium[J]. J Fourth Mil Med Univ, 2000,21(6):720-704.
[9] 王淑玉,任鐵玲,張悅,等.鉛硒聯合作用對原代培養海馬神經元影響[J].中國公共衛生,2007,23(1):73-74.
[10] 朱京,譚曉榮.活性氧與自噬的研究進展[J].生命科學,2011,23(10):987-992.
[11] Sorce S, Krause KH. NOX enzymes in the central nervous system: from signaling to disease[J]. Antioxid Redox Signal, 2009,11(10):2481-2504.
[12] Oyinloye BE, Adenowo AF, Kappo AP. Reactive oxygen species, apoptosis, antimicrobial peptides and human inflammatory diseases[J]. Pharmaceuticals (Basel), 2015,8(2):151-175.
[13] 景亞武,易靜,高飛,等.活性氧:從毒性分子到信號分子——活性氧與細胞的增殖、分化和凋亡及其信號轉導途徑[J].中國細胞生物學學報,2003,25(4):197-202.
[14] 王娟,王李瑤,顏貝,等.硒蛋白H減緩谷氨酸對神經細胞損傷的作用[J].臨床與實驗病理學雜志,2016,32(10):1130-1134.
Effectofsodiumseleniteonglutamicacid-inducedneuronalinjury
WANG Juan1, MAI Li, WANG Liyao, CHANG Yue, JING Li
(1 Ningxia Medical University, Yinchuan 750004, China)
ObjectiveTo investigate the effect of sodium selenite on glutamic acid (Glu)-induced neuronal injury and its mechanism.MethodsThe HT22 cells were divided into three groups. The control group was cultured in cell culture fluid. The Glu group was co-cultured with Glu (6 mmol/L) and cell culture fluid. The sodium selenite group was co-cultured with Glu (6 mmol/L), cell culture fluid, and 100 nmol/L sodium selenite. MTT method was used to detect the cell inhibition rates in each group at 6, 10, and 24 h after cultivation. Inverted microscope was used to observe the changes of cell morphology. Transmission electron microscope (TEM) was used to observe the changes of cell micro-structure. The cells were labeled with oxygen free radical ROS-specific labeling probe DHE. The expression of DHE was observed with fluorescent electron microscope.ResultsThe cell inhibition rate of the Glu group was 8.71%±0.009% at 6 h, the inhibition rate increased at 10 and 24 h, and at 24 h it reached the peak. But the cell inhibition rate dropped significantly after that common incubation with sodium selenite (P<0.05). The results of the inverted microscope showed the number of cells in the Glu group was lower than that of the control group, and with cell shrinkage and irregular shapes. The number of cells in the sodium selenite group was increased than that of the the Glu group. The results of TEM showed the number of apoptosis in the Glu group was higher than that of the control group, and with severer mitochondria and endoplasmic reticulum damage. The number of apoptosis in the sodium selenite group was lower than that of the Glu group. Fluorescent electronic microscope showed the average optical density of DHE dyeing in the Glu group was higher than that of the control group, and the average optical density of DHE dyeing in the sodium selenite group was lower than that of the Glu group.ConclusionSelenium (Sodium selenite) can alleviate the damage of nerve cells from Glu by reducing the ROS production.
selenium; sodium selenite; glutamic acid; nerve cell damage; oxygen radical
10.3969/j.issn.1002-266X.2017.42.004
R361.3
A
1002-266X(2017)42-0013-03
國家自然科學基金地區項目(81560501);寧夏高等學校科學研究項目(NGY2015068)。
王娟(1987-),女,碩士研究生,主要研究方向為心血管病理。E-mail: 1169570514@qq.com
景麗(1975-),女,教授,主要研究方向為心血管病理。E-mail: 1203220205@qq.com
2017-03-11)

