iASPP基因在卵巢癌中的表達及其臨床意義
高燕芳,蔣麗霞,張 銘
(南京醫科大學附屬常州市婦幼保健院檢驗科 213003)
?
論著·臨床研究
iASPP基因在卵巢癌中的表達及其臨床意義
高燕芳,蔣麗霞△,張 銘
(南京醫科大學附屬常州市婦幼保健院檢驗科 213003)
目的 檢測iASPP在卵巢癌中的表達,探索其在卵巢癌中的致病機制。方法 收集2013年5月至2014年12月于常州市婦幼保健院行卵巢腫瘤切除術的患者的癌組織及對應癌旁組織標本共32份,用實時熒光定量聚合酶鏈反應法檢測iASPPmRNA相對表達水平并分析它與卵巢癌臨床病理特征的關系。結果 卵巢癌組織中iASPPmRNA水平明顯高于癌旁組織(P=0.001),并且與卵巢癌病理分期相關 (P<0.05),iASPP表達水平與患者年齡、是否絕經、組織學類型、術前有無化療、有無淋巴結轉移、糖類蛋白125及糖類蛋白153表達情況無相關性,其差異無統計學意義(P>0.05)。結論iASPPmRNA在卵巢癌組織中高表達顯示其在腫瘤發生過程中發揮重要作用。
卵巢腫瘤;iASPP;p53
卵巢癌是嚴重威脅婦女生命的女性生殖系統腫瘤之一,由于它極高的惡性程度及逐年上升的發病率,其致死率已居于婦科惡性腫瘤首位。眾所周知,腫瘤的發生涉及多種基因,這些基因在不同階段相繼發揮作用,而細胞凋亡是這個過程中至關重要的一個環節,它對腫瘤的發生發展過程都具有十分重要的意義。現在許多腫瘤學研究都致力于細胞凋亡功能如何被調控及其發生異常的原因,目前已發現多種調控細胞凋亡的基因,找出這些基因在卵巢癌發生過程中的作用機制,將對卵巢癌的診斷與治療有極其重要的意義。
p53凋亡刺激蛋白(apoptosis-stimulating protein of p53,ASPP)家族因為具有特異調控p53的的功能而被命名,是最近發現的一個蛋白家族。ASPP1、ASPP2和iASPP(inhibitory member of the ASPP family)是這個家族的主要成員。該家族的特征性結構是SH3結構域,C-末端的錨蛋白重復序列以及富含脯氨酸的結構域[1]。雖然3個家族成員的結構相似,但它們的功能卻截然不同,其中ASPP1、ASPP2主要是與p53結合從而促進p53誘導的細胞凋亡;而iASPP則相反,它可以競爭性的與ASPP1、ASPP2結合p53蛋白來抑制p53的促細胞凋亡功能,因此具有癌基因的性質[1]。p53基因是一種較為重要的抑癌基因,研究顯示它在卵巢癌的發生發展過程中發揮重要作用。由此可推測,iASPP有可能通過調節p53基因的表達,從而在卵巢癌中發揮重要作用。本研究用實時熒光定量聚合酶鏈反應(PCR)法檢測卵巢癌組織中iASPP的表達情況,分析它在卵巢癌發生發展中的作用。
1 資料與方法
1.1 一般資料 本試驗標本取自2013年5月至2014年12月于常州市婦幼保健院行卵巢腫瘤切除術的患者,術后標本均通過病理檢查,最終證實為卵巢癌,共32例,組織學分類包括:22例漿液性腺癌,9例黏液性腺癌,1例透明細胞癌,患者平均年齡51歲(29~71歲)。癌組織及對應癌旁組織均于術中選取,肉眼下正常組織作為癌旁組織。術后新鮮組織用生理鹽水沖洗2~3遍,繼而被剪碎保存于組織凍存管中放在-80 ℃冰箱。
1.2 主要試劑 RNA分離及提取試劑購自美國 Invitrogen 公司,實時熒光定量PCR試劑盒購自寶生物工程有限公司,反轉錄-PCR試劑盒購自美國 Fermentas 公司,iASPP和β-actin引物購自上海生工公司。
1.3 方法
1.3.1 組織標本中總mRNA的提取 將50~100 mg組織用勻漿機打碎,加入Trizol裂解并提取mRNA。用紫外分光光度計檢測RNA濃度和純度,分析所提取mRNA質量,選取純度較高者繼續進行RT-PCR反應。
1.3.2 第1鏈cDNA的合成 參照反轉錄PCR試劑盒說明書進行第1鏈cDNA的合成。逆轉錄反應體系為20 μL,分別為DEPC 9 μL,5×逆轉錄緩沖液4 μL,隨機引物Oligo 1 μL,dNTP 2 μL,逆轉錄酶1 μL,RNA模板3 μL。最后轉到PCR擴增儀(Thermo)上25 ℃ 10 min,50 ℃ 15 min,85 ℃ 5 min。儲存第1鏈cDNA于4 ℃冰箱或立即行PCR。
1.3.3 引物設計和合成 根據Genebank的基因序列,設計引物并對其特異性進行比較。iASPP引物序列為:上游5′-GGC GGT GAA GGA GAT GAA C-3′ ;下游5′-TGA TGA GGA AAT CCA CGA TAG AG-3′。β-actin內參基因引物序列為:上游5′-GGC GGC ACC ACC ATG TAC CCT-3′ ;下游5′-AGG GGC CGG ACT CGT CAT ACT-3′ 實時熒光定量PCR在熒光定量PCR儀 Light Cycler1.5(Roche)上檢測,反應體系為20 μL,分別為:第1鏈cDNA 2 μL,2×SYBR Green Mix 10 μL,10 μmol/L上下游引物各0.5 μL,去離子水7.0 μL。反應條件為95 ℃ 30 s,95 ℃ 5 s,55 ℃ 30 s,72 ℃ 30 s,收集熒光,40個循環。溶解曲線反應條件:95 ℃ 10 s,60 ℃1 min,95 ℃10 s。產物經2%瓊脂糖電泳分離,判斷擴增產物特異性。
1.4 統計學處理 實驗數據用SPSS16.0統計軟件進行統計分析。卵巢癌組織與癌旁組織間iASPP mRNA表達水平的差異用秩和檢驗進行分析;Mann-Whitney U-test分析iASPP mRNA相對表達量與卵巢癌臨床特征是否相關,P<0.05為差異有統計學意義。
2 結 果
2.1 擴增特異性 iASPP和β-actin兩種擴增產物的溶解曲線呈單一峰,溶解溫度與產物的預期溶解溫度相符(圖1)。
圖1 iASPP與β-actin擴增產物溶解曲線
2.2 iASPP在卵巢癌及對應癌旁組織中的表達 與癌旁組織相比,iASPP mRNA在卵巢癌組織中的表達量明顯偏高,差異有統計學意義(P=0.001),見圖2。
2.3 iASPP mRNA表達與卵巢癌臨床病理特征的關系 統計分析顯示,iASPP mRNA卵巢癌不同臨床分期中的表達,Ⅰ期與Ⅱ、Ⅲ期相比,差異有統計學意義(P<0.05)。iASPP mRNA與卵巢癌患者的年齡、是否絕經、腫瘤組織學類型、術前有無化療、有無淋巴結轉移、CA125及CA153水平的差異無統計學意義(P>0.05)。
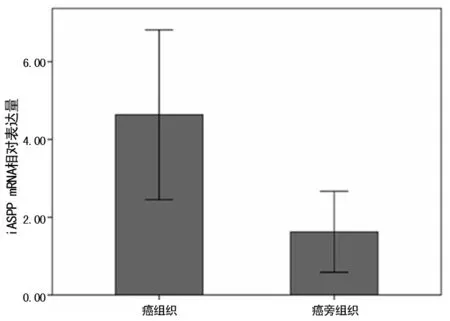
圖2 iASPP mRNA在卵巢癌組織中的相對表達水平
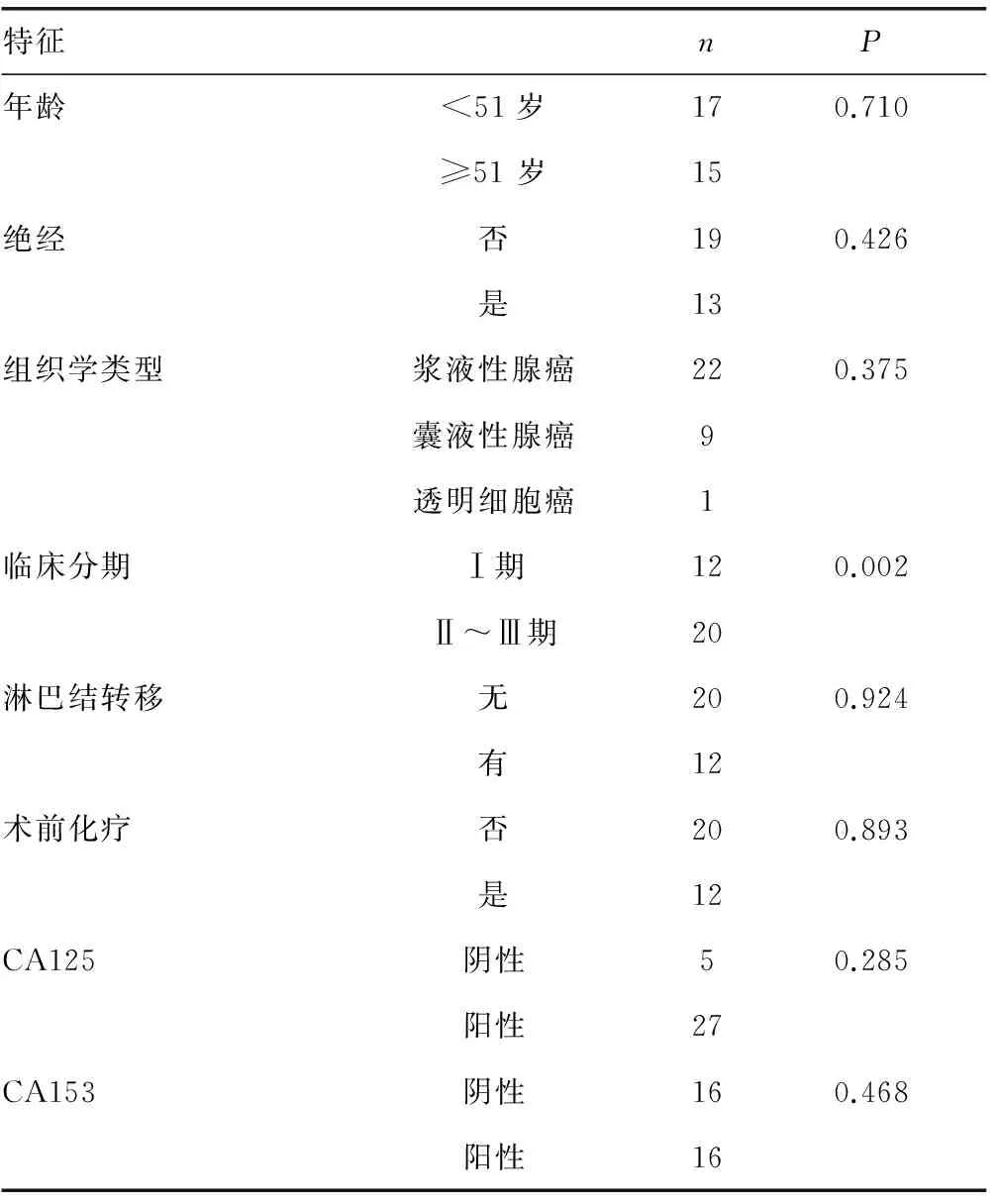
特征nP年齡<51歲170.710≥51歲15絕經否190.426是13組織學類型漿液性腺癌220.375囊液性腺癌9透明細胞癌1臨床分期Ⅰ期120.002Ⅱ~Ⅲ期20淋巴結轉移無200.924有12術前化療否200.893是12CA125陰性50.285陽性27CA153陰性160.468陽性16
3 討 論
細胞凋亡是細胞為維持內環境穩態而自主進行的有序死亡的過程,腫瘤形成和發展的一個重要原因就是細胞凋亡功能異常進而導致細胞過度增生。p53是一個重要抑癌基因,細胞受到DNA損傷、輻射等一系列物理或化學刺激后,p53基因就會被激活,繼而作用于其下游基因引起一系列反應:首先,DNA損傷后p53表達迅速上升,誘導p21轉錄水平提高,將細胞周期抑制在G1期,這樣細胞在進入S期之前通過DNA損傷修復系統修復損傷的DNA就有了足夠的時間;其次,若損傷太大導致無法修復時,p53會通過誘導Bax等凋亡基因的表達使其加速細胞凋亡過程,從而抑制廣泛性DNA損傷的細胞通過克隆性生長引發腫瘤。
iASPP由人類PPP1Rl3L基因編碼[1]。全長的iASPP由828個氨基酸構成,細胞質和細胞核中均有表達[2]。一系列研究均已證實iASPP對p53具有負性調節功能。近年來,隨著對iASPP研究的不斷深入,已發現iASPP在宮頸癌[3]、神經膠質瘤[4]、大腸癌[5]、口腔鱗狀細胞癌[6]、前列腺癌[7]等多種腫瘤組織中表達偏高。本研究用實時熒光定量PCR技術分析卵巢癌組織及相應的癌旁組織中iASPP mRNA的相對水平,結果顯示:卵巢癌組織中的iASPP表達量相比癌旁組織明顯升高;iASPP在卵巢癌組織中的表達量與卵巢癌臨床分期有關。Cao等[8]研究還發現子宮頸癌中iASPP表達水平升高還與腫瘤放化療抵抗相關。Liu等[9]等指出iASPP表達升高與頭頸腫瘤預后差相關。這些都表明iASPP在腫瘤的發生過程發揮了重要作用。
p53是一個重要的抑癌基因,在人類腫瘤中,有一部分腫瘤的p53基因發生突變,導致它促細胞凋亡功能異常而引發腫瘤;然而還有一部分腫瘤的p53基因結構是正常的,即野生型p53,那么這些腫瘤中的p53為什么沒有抑制癌癥發生,研究證明,這些腫瘤細胞中存在著抑制p53的物質使p53的功能喪失。據統計,在卵巢癌中p53的突變率可達到50%[10],然而仍有一部分腫瘤表達野生型p53,在這些腫瘤中,正常的p53抑癌功能被抑制從而導致腫瘤發生。iASPP能特異性抑制p53,若解除這種抑制作用,就有可能使腫瘤得到有效治療。研究指出MiR-124能直接作用于iASPP從而抑制腫瘤的生長和侵襲,包括腸癌、惡性膠質瘤和前列腺癌[11-13],但是否在卵巢癌中也起作用有待進一步研究。除此之外,A34可直接與iASPP結合并完全抑制iASPP對p53的作用[14]。隨著醫學水平的提高,基因診斷及基因治療已成為腫瘤診斷與治療過程中不可或缺的手段,本研究顯示iASPP在卵巢中致病過程中發揮重要作用,可能為卵巢癌的診斷與治療提供了一個新方向。
[1]Bergamaschi D,Samuels Y,O′Neil NJ,et al.iASPP oncoprotein is a key inhibitor of p53 conserved from worm to human[J].Nat Genet,2003,33(2):162-167.
[2]Slee EA,Gillotin S,Berqamaschi D,et al.The N-terminus of a novel isoform of human iASPP is required for its cytoplasmic localization[J].Oncogene,2004,23(56):9007-9016.
[3]Kong F,Shi X,Li H,et al.Increased expression of iASPP correlates with poor prognosis in FIGO IA2-IIA cervical adenocarcinoma following a curative resection[J].Am J Cancer Res,2015,5(3):1217-1224.
[4]Liu X,Kang J,Liu F,et al.Overexpression of iASPP-SV in glioma is associated with poor prognosis by promoting cell viability and antagonizing apoptosis[J].Tumour Biol,2016,37(5):6323-6330.
[5]Saeb? M,Skjelbred CF,Nex? BA,et al.Vogel U,Kure EH.Increased mRNA expression levels of ERCC1,OGG1 and RAI in colorectal adenomas and carcinomas[J].BMC Cancer,2006(6):208-215.
[6]Kim JW,Roh JL,Park Y,et al.Cytoplasmic iASPP expression as a novel prognostic indicator in oral cavity squamous cell carcinoma[J].Ann Surg Oncol,2015,22(2):662-669.
[7]Zhang B,Xiao HJ,Chen J,et al.Inhibitory member of the apoptosis-stimulating protein of p53 (ASPP) family promotes growth and tumorigenesis in human p53-deficient prostate cancer cells[J].Prostate Cancer Prostatic Dis,2011,14(3):219-224.
[8]Cao L,Huang Q,He J,et al.Elevated expression of iASPP correlates with poor prognosis and chemoresistance/radioresistance in FIGO Ⅰb1-Ⅱa squamous cell cervical cancer [J].Cell Tissue Res,2013,352(2):361-369.
[9]Liu Z,Zhang X,Huang D,et al.Elevated expression of iASPP in head and neck squamous cell carcinoma and its clinical significance [J].Med Oncol,2012,29(5):3381-3388.
[10]Alvarez AA,Axelrod JR,Whitaker RS,et al.Thrombospondin-1 expression in epithelial ovarian carcinoma:association with p53 status,tumor angiogenesis,and survival in platinum-treated patients [J].Gynecol Oncol,2001,82(2):273-278.
[11]Liu K,Zhao H,Yao H,et al.MicroRNA-124 regulates the proliferation of colorectal cancer cells by targeting iASPP[J].Biomed Res Int,2013:867537-867548.
[12]Zhao WH,Wu SQ,Zhang YD.Downregulation of miR-124 promotes the growth and invasiveness of glioblastoma cells involving upregulation of PPP1R13L [J].Int J Mol Med,2013,32(1):101-107.
[13]Chen J,Xiao H,Huang Z,et al.MicroRNA124 regulate cell growth of prostate cancer cells by targeting iASPP[J].Int J Clin Exp Pathol,2014,7(5):2283-2290.
[14] Qiu S,Cai Y,Gao X,et al.A small peptide derived from p53 linker region can resume the apoptotic activity of p53 by sequestering iASPP with p53[J].Cancer Lett,2014,356(2):910-917.
歡迎投稿 歡迎訂閱
Expression of iASPP gene in ovarian cancer and its clinical significance*
GaoYanfang,JiangLixia△,ZhangMing
(DepartmentofClinicalLaboratory,AffiliatedChangzhouMunicipalMaternalandChildHealthCareHospital,NanjingMedicalUniversity,Changzhou,Jiangsu213003,China)
Objective To detect the expressions of iASPP in ovarian cancer and to investigate its pathogenic mechanism in ovarian cancer.Methods Totally 32 pair samples of ovarian cancer tissues and corresponding paracancerous tissues were collected in our hospital from May 2013 to December 2014.The iASPP mRNA relative expression level was detected using real-time PCR (RT-PCR).Its relation with the clinicopathological characteristics of ovarian cancer was analyzed.Results The iASPP mRNA level in ovarian cancer tissues was significantly higher than that in the paracancerous tissues (P=0.001) and which was associated with the pathological stage(P<0.05).The iASPP expression had no correlation with the age,menopause,histological subtype,preoperative chemotherapy,lymph node metastasis and expression level of CA125 and CA153,the differences were not statistically significant.Conclusion The high expression of iASPP in ovarian cancer tissues reveals its important role in the tumor occurrence process.
ovarian neoplasms;iASPP;p53
10.3969/j.issn.1671-8348.2016.31.012
常州市衛生計生委指導性科技項目(WZ201515)。
高燕芳(1985-),碩士,住院醫師,從事腫瘤標志物方面研究。△
,E-mail:jlx60003@163.com。
R
A
1671-8348(2016)31-4357-03
2016-02-26
2016-04-14)

