苯磺酸氨氯地平抑制高糖誘導的H9C2細胞凋亡研究
徐小紅,阮駱陽,田小華,潘鳳娟,楊彩蘭
(廣東省農墾中心醫院:1.兒科;2.麻醉科,廣東湛江 524002)
?
論著·基礎研究
苯磺酸氨氯地平抑制高糖誘導的H9C2細胞凋亡研究
徐小紅1,阮駱陽2,田小華1,潘鳳娟1,楊彩蘭1
(廣東省農墾中心醫院:1.兒科;2.麻醉科,廣東湛江 524002)
目的 利用細胞實驗探討高糖培養對H9C2細胞凋亡的影響,并探討苯磺酸氨氯地平的保護作用。方法 體外培養大鼠心肌細胞H9C2,分為5 mmol/L糖培養組(G1)、25 mmol/L糖培養組(G2)、50 mmol/L糖培養組(G3)和25 mmol/L糖培養組加鈣離子通道抑制劑絡活喜保護組(G2+N)、50 mmol/L糖培養組加絡活喜保護組(G3+N)5組,每組分設48 h(a)、72 h(b)培養兩個亞組共10組。AnnexinV/PI結合流式細胞儀檢測細胞凋亡率,熒光染色觀察[Ca2+]i。結果 細胞凋亡率隨著高糖刺激時間和高糖濃度的增加而逐漸增高,加絡活喜組細胞的凋亡率顯著降低(P<0.05)。G2、G3組單細胞平均[Ca2+]i活性測定熒光值均較G1組升高(P<0.05);G2+N、G3+N組單細胞平均[Ca2+]i活性測定熒光值分別較G2、G3組降低(P<0.05)。各a、b亞組間單細胞平均[Ca2+]i活性測定熒光值差異無統計學意義(P>0.05)。結論 高糖培養H9C2細胞可增加[Ca2+]i從而導致細胞凋亡,苯磺酸氨氯地平可抑制Ca2+內流從而抑制細胞凋亡。
糖尿病,妊娠;心肌細胞肥大;苯磺酸氨氯地平
妊娠期糖尿病(gestational diabetes mellitus,GDM)是臨床上最常見的妊娠期間糖代謝異常類型,約占糖尿病孕婦的80%以上[1]。近年GDM呈上升趨勢,其對胎兒影響巨大,GDM伴空腹血糖增高者胎兒畸形發生率為6.1%,尤以心血管系統及神經系統畸形最為常見。心臟比神經管更容易受到母體糖尿病的影響,GDM胎兒心臟畸形發生率是一般孕婦的6~8倍[2]。目前針對GDM致胎兒心臟發育異常方面尚缺乏有效的治療策略,因此闡明GDM致胎兒心臟畸形發育之病理過程中可能存在的發病機制,可為臨床防治此種疾病提供新的靶點。
1 材料與方法
1.1 材料 H9C2細胞購自中國科學院上海生命科學研究院細胞資源中心;D-葡萄糖購自廣州化學試劑公司;絡活喜購自Sigma公司;Annexin V-FITC細胞凋亡檢測試劑盒購自碧云天公司;胎牛血清購自Hyclone公司;DMEM培養基購自Gibco公司。鈣離子熒光探針(Fluo-3 AM)購自碧云天公司。
1.2 方法
1.2.1 細胞培養 細胞解凍后,5%CO2培養箱、飽和濕度、37 ℃培養在含10%胎牛血清的DMEM培養液中。
1.2.2 實驗分組 G1組:含10%胎牛血清的DMEM常規培養基(糖濃度5 mmol/L);G2組:含10%胎牛血清的DMEM高糖培養基(糖濃度25 mmol/L);G3組:含10%胎牛血清的DMEM高糖培養基(糖濃度50 mmol/L);G2+N組:含10%胎牛血清的DMEM高糖培養基(糖濃度25 mmol/L)加苯磺酸氨氯地平即絡活喜(25 nmol/L);G3+N組:含10%胎牛血清的DMEM高糖培養基(糖濃度50 mmol/L)加絡活喜(25 nmol/L);每組均分為a、b兩亞組,a亞組培養48 h, b亞組培養72 h。
1.2.3 流式細胞儀檢測 按Annexin V-FITC 細胞凋亡檢測試劑盒(碧云天,C1062)操作說明操作。
1.2.4 各組細胞內[Ca2+]i活性測定 無血清DMEM培養基稀釋Fluo-3至2 μmol/L;棄去細胞舊培養基,PBS洗滌細胞1次,2 μmol/L的Fluo-3孵育1 h(37 ℃,5%CO2);棄去Fluo-3,PBS洗滌細胞2次,2 μmol/L的Fluo-3孵育30 min(37 ℃,5%CO2);棄去Fluo-3,PBS洗滌細胞2次,加適量培養基后用熒光顯微鏡觀察,并使用Image-Pro Plus 6.0軟件進行圖像分析。
1.3 統計學處理 采用Graph Pad Prism 5進行統計分析,多組均數間的比較采用方差分析,采用t檢驗比較樣本均數,以P<0.05為差異有統計學意義。
2 結 果
2.1 不同濃度葡萄糖培養對細胞凋亡的影響 各組分別培養后,G2a 組細胞早期凋亡率較G1a組升高但低于G3a組,差異有統計學意義(P<0.05)。G2b 組細胞早期凋亡率較G1b組升高,差異有統計學意義(P<0.05),但G2b與G3b組培養細胞早期凋亡率差異無統計學意義(P>0.05)。G2+N、G3+N組凋亡率明顯低于G2、G3組(P<0.05)。a、b亞組間比較G1b、G2b、G3b、(G3+N)b組早期凋亡率均對應高于G1a、G2a、G3a、(G3+N)a組(P<0.05),而(G2+N)a、b亞組間細胞早期凋亡率差異無統計學意義(P>0.05),見圖1。
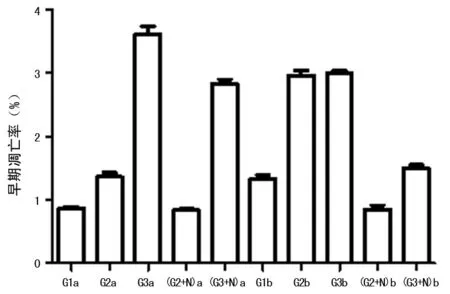
圖1 流式細胞儀檢測細胞凋亡率
2.2 各組細胞內[Ca2+]i活性測定結果 a、b亞組內單細胞平均[Ca2+]i活性測定熒光值在G1、G2、G3組均呈階梯上升,G3組達到最高點(P<0.05),而G2+N、G3+N組分別低于G2、G3組(P<0.05)。各對應a、b亞組間單細胞平均[Ca2+]i活性測定熒光值差異無統計學意義(P>0.05),見圖2。
3 討 論
細胞凋亡主要是參與去除異常發育的細胞、清除多余的細胞,最終有效地維持機體細胞數量與功能的動態平衡,進而促進器官、組織的正常發育。研究表明凋亡途徑主要包括內源性、外源性,最終引起caspase激活[3]。細胞凋亡除了與啟動凋亡程序引起凋亡外,還與細胞內的存活機制有關。高血糖刺激胎兒體內的氧化應激過程及誘導過多的細胞凋亡發生均對胚胎心肌細胞構成嚴重影響[4-5],妊娠期糖尿病的病理性內環境可誘發心肌細胞過度凋亡,促使心臟發育畸形。
H9C2細胞源于胚胎期大鼠心臟,保持很多心肌細胞的特征,可用于高糖的體外研究。本實驗發現各組不同糖濃度分別培養H9C2細胞48、72 h后, G2a組細胞早期凋亡率較G1a組升高但低于G3a組,差異有統計學意義。G2b 組細胞早期凋亡率較G1b組升高,差異有統計學意義,但G2b與G3b組培養細胞早期凋亡率差異無統計學意義。G2+N、G3+N組凋亡率明顯低于G2、G3組。a、b亞組間比較G1b、G2b、G3b、(G3+N)b組早期凋亡率均對應高于G1a、G2a、G3a、(G3+N)a組,而(G2+N)a、b亞組間細胞早期凋亡率差異無統計學意義。提示隨著糖濃度的增加,細胞凋亡率也明顯升高,高糖作用48 h內凋亡率隨糖濃度呈階梯式上升。隨著時間延長,培養糖濃度的提高,細胞損傷加重,加入鈣通道阻滯劑后細胞凋亡減少,提示絡活喜可保護心肌免于或減少受高糖損傷。Lee等[6]的研究結果也表明,臨床劑量胰島素和二甲雙胍均能降低血糖峰值。二甲雙胍可能會保護心肌細胞。暴露在胰島素和二甲雙胍24 h和48 h甚至72 h后細胞形態學均發生變化,兩組均出現細胞損傷。
在新生大鼠心肌細胞及H9C2細胞培養48 h中,高糖(25 mmol/L)導致心肌細胞肥大和凋亡[7]。在線粒體功能障礙方面有研究發現高糖(35 mmol/L的葡萄糖)培養 H9C2細胞24 h不僅顯著誘導包括細胞毒性,細胞凋亡,活性氧(ROS) 過剩和線粒體膜電位(MMP)的降低在內的損傷,還上調(p)-p38 MAPK和p-ERK1/2磷酸化水平,N-acetylcysteine (NAC) 通過抑制H9c2細胞線粒體氧化應激損傷來對抗由葡萄糖及葡萄糖氧化物所致氧化和凋亡活動[8]。多項研究均證實,高糖可通過多種途徑導致H9C2細胞凋亡,本研究的結果也支持該結論。
心臟是個極其復雜的器官,當其發揮功能時需要大量的各種離子,其中Ca2+被認為是最重要的一種。 [Ca2+]i濃度升高是心肌細胞因外界刺激或/和內在功能缺陷而發生肥大的中心環節[9]。在患糖尿病心肌病的大鼠心肌中高表達內質網Ca2+泵,改善心肌中Ca2+的處置,可以使糖尿病心肌病大鼠的心臟功能恢復正常[10]。Kumar等[11]通過研究高糖條件下細胞內鈣內移到線粒體,進一步了解了高血糖的條件下的心肌細胞凋亡。他們的研究顯示,高糖導致凋亡依賴或不依賴線粒體通路,均伴隨著細胞內鈣升高。所以本研究立足于此,驗證了Ca2+是否在高糖培養的心肌細胞中發生明顯變化,并擬進一步研究其通過何種途徑引起心肌細胞的變化。
本研究發現,a、b亞組內單細胞平均[Ca2+]i活性測定熒光值在G1、G2、G3組均呈階梯上升,G3組達到最高點,而G2+N、G3+N組分別低于G2、G3組。各對應a、b亞組間單細胞平均[Ca2+]i活性測定熒光值差異無統計學意義。提示高糖可引起H9C2細胞內Ca2+明顯增加,Ca2+可能參與了高糖致H9C2細胞的肥大、凋亡過程。鈣離子通過鈣離子通道進入心肌細胞,作為一種重要的第二信使,心肌細胞的收縮是由胞外的鈣離子內流而引起的,在心肌中,L型鈣離子通道是鈣離子進入細胞內的主要途徑。加入L型鈣離子通道抑制劑絡活喜后單細胞平均[Ca2+]i活性測定熒光值較相同條件不加絡活喜者降低,高糖導致的細胞內Ca2+增加可被L型鈣離子通道抑制劑所抑制,支持Ca2+通過L型鈣離子通道進入細胞內調節下游信號通路,參與H9C2細胞的凋亡、肥大的假設。本研究還比較了同濃度同藥物培養不同時長對應組間單細胞平均[Ca2+]i活性測定熒光值差異無統計學意義,提示[Ca2+]i可能為瞬時改變,故培養時長對其影響不大。
根據本研究的結果,有理由認為高糖培養H9C2細胞可增加[Ca2+]i從而導致細胞凋亡,苯磺酸氨氯地平可抑制Ca2+內流從而抑制細胞凋亡。
[1]樂杰.婦產科學[M].北京:人民衛生出版社,2008:150.
[2]Hrabovski I,Milasnovic L,Grujic Z,et al.Influence of glucose homeostasis on maturation and ontogenesis of fetus[J].Med Pregl,2012,64(11/12):552-556.
[3]Peter G,Mike H,Maryline MC.IAPs inhibit a cryptic CD95-induced cell death by limiting RIP1 kinase recruitment[J].Cell Biol,2009,187(7):1037-1054.
[4]鄒燕,丁依玲.孕鼠體內高血糖對胎鼠心肌細胞的影響[J].中南大學學報(醫學版),2009,34(2):139-147.
[5]劉欣,趙秀蘭,康毅.糖尿病大鼠心肌細胞凋亡及凋亡相關蛋白表達研究[J].中國心血管雜志,2005,10(1):4-7.
[6]Lee L,Tucci MA,Benghuzzi HA.Effects of metformin and insulin on h9c2 rat cardiomyocytes in cell culture with elevated glucose levels[J].Biomed Sci Instrum,2014(50):367-374.
[7]Xu J,Li H,Irwin MG et al.Propofol a meliorates hyperglycemia-induced cardiac hypertrophy and dysfunction via heme oxygenase-1/signal transducer and activator of transcription 3 signaling pathway in rats[J].Crit Care Med,2014,42(8):e583-594.
[8]Kumar S,Sitasawad SL.N-acetylcysteine prevents glucose/glucose oxidase-induced oxidative stress,mitochondrial damage and apoptosis in H9c2 cells[J].Life Sci,2009,84(11/12):328-336.
[9]萬智軍,李端陽,鄧樹勛.運動性心肌肥大的信號轉導通路[J].體育學刊,2004,11(4):52-55.
[10]Trost SU,Belke DD,Bluhm WF,et al.Overexpression of the sarcoplasmic reticulum Ca(2+)-ATPase improves myocardial contractility in diabetic cardiomyopathy[J].Diabetes,2002,51(4):1166-1171.
[11]Kumar S,Kain V,Sitasawad SL,et al.High glucose-induced Ca2+overload and oxidative stress contribute to apoptosis of cardiac cells through mitochondrial dependent and independent pathways[J].Biochim Biophys Acta,2012,1820(7):907-920.
Amlodipine besylate for suppressing H9C2 cells apoptosis induced by high glucose*
XuXiaohong1,RuanLuoyang2,TianXiaohua1,PanFengjuan1,YangCailan1
(1.Departmentofpaediatrics;2.DepartmentofAneshesiology,GuangdongProvincialAgricuturalReclamationCentralHospital,Zhanjiang,Guangdong524002,China)
Objective To study the influence of high glucose concentration culture on H9C2 apoptosis by using the cell experiment and to investigate the protective effect of amlodipine besylate.Methods The in vitro cutured rat cardiomyocytes H9C2 were divided into 5 groups:5 mmol/L sugar culture group (G1),25 mmol/L sugar culture group(G2),50 mmol/L sugar culture group(G3) and 25 mmol/L sugar culture group plus calcium ion channel inhibitor amlodipine besylate protection group(G2+N) and 50 mmol/L sugar culture group plus amlodipine besylate protection group(G3+N).Each group was re-divided into the 48 h culture subgroup (a) and 72 h culture subgroup(b),10 groups in total.The cellular apoptosis rate was detected by AnnexinV/PI combined with flow cytometer.Ca2+was observed by the fluorescence staining.Results The cellular apoptosis rate was gradually increased with the high sugar stimulation time increase and high sugar concentration increase,which in the adding amlodipine besylate group was significantly decreased(P<0.05).The mean fluorescence value of [Ca2+]i of single cell in the group G2 and G3 was increased compared with the group G1 (P<0.05).The mean fluorescence value of [Ca2+]i activity of single cell in the group G2+N and G3+N was decreased compared with the group G2 and G3(P<0.05).But the mean fluorescence value of [Ca2+]i activity of single cell had no statistically significant difference between various subgroup a and b (P>0.05).Conclusion Higher glucose culture of H9C2 cells can increase[Ca2+]i,thus causes the cellular apoptosis,amlodipine besylate can inhibit the Ca2+internal flow,thus inhibits the cellular apoptosis.
diabetes,gestational;cardiomyocyte hypertrophy;amlodipine
10.3969/j.issn.1671-8348.2016.31.002
廣東省湛江市政資金科技專項競爭性分配項目(2015A01037)。
徐小紅(1977-),碩士,副主任醫師,主要從事器官保護方面的研究。
R329.2
A
1671-8348(2016)31-4324-03
2016-02-22
2016-06-10)

