免疫磁珠分選法原代培養小鼠肺微血管內皮細胞
周玲萍,馮成,湯雪斌,徐紅蕾
(溫州醫科大學附屬第一醫院 呼吸與危重癥醫學科,浙江 溫州 325015)
?
免疫磁珠分選法原代培養小鼠肺微血管內皮細胞
周玲萍,馮成,湯雪斌,徐紅蕾
(溫州醫科大學附屬第一醫院 呼吸與危重癥醫學科,浙江 溫州 325015)
目的:探討一種高效、穩定的小鼠肺微血管內皮細胞(PMVECs)原代培養方法。方法:選取45 只1周齡Balb/c小鼠,隨機分成3組,分別用酶消化法、組織貼塊法、免疫磁珠分選法3種方法分離培養小鼠PMVECs,觀察細胞形態學以及VI I I因子相關抗原免疫熒光染色鑒定內皮細胞,計算各組原代培養成功率及從原代培養開始到首次傳代所需時間,測定細胞純度,MTT法繪制生長曲線。結果:3組原代培養的細胞在倒置顯微鏡下均能見到短梭形、多邊形的微血管內皮細胞,血管內皮細胞特異性標志物VI I I因子相關抗原表達陽性。免疫磁珠分選法組原代培養成功率及細胞活性顯著高于其他2組,差異有統計學意義(P<0.01),從原代培養至首次傳代所需的時間短于組織貼塊法組,差異有統計學意義(P<0.05),細胞純度顯著高于酶消化法組,差異有統計學意義(P<0.01)。結論:相比于酶消化法與組織貼塊法,免疫磁珠分選法原代培養小鼠PMVECs具有重復性好,分離速度快,細胞純度高及活性好的優點。
細胞培養;原代培養;免疫磁珠;肺微血管內皮細胞
建立高效的肺微血管內皮細胞(pulmonary microvascular endothelial cells,PMVECs)體外培養方法對急性肺損傷等疾病發病機制及藥物治療等方面的研究起著重要作用。目前文獻報道體外培養PMVECs的方法主要有酶消化法、組織塊培養法、免疫磁珠分選法,但由于PMVECs較脆弱難成活、生長緩慢、易污染、不易純化等原因,目前其培養仍是一個難題。本研究對上述3種PMVECs體外培養方法進行比較,明確不同培養方法的優缺點,探討出一種穩定的PMVECs培養方法。
1 材料和方法
1.1材料 健康1周齡Balb/c小鼠45只,雌雄不限,由溫州醫科大學實驗動物中心提供。EndothelialCell Medium(Sciencell公司),FBS(Gibco公司),0.25%胰蛋白酶(Gibco公司),I型膠原酶(Gibco公司),大鼠抗小鼠CD31單克隆抗體(Invitrogen公司),羊抗大鼠IgG磁珠(New England公司),兔抗人VI I I因子相關抗原多克隆抗體(Santa公司),IV型膠原酶(Gibco公司),中性蛋白酶(Roche公司),MTT(Sigma公司)。
1.2方法
1.2.1分組與肺組織的分離:取Balb/c小鼠45只,隨機分為酶消化法組、組織貼塊法組、免疫磁珠分選法組,每組各15只。用10%水合氯醛(0.35 mL/ 100 g)麻醉后置75%乙醇浸泡消毒3 min。將小鼠置無菌操作盤上,用無菌眼科剪、眼科鑷逐層打開胸腔暴露心肺,自右心室心尖處進針緩慢推注10 mL DMEM液(含肝素與雙抗),直至肺組織發白。剪取小鼠心肺組織置DMEM液中,移入超凈臺內備用。
1.2.2細胞原代培養:酶消化法[2]:超凈臺內剪取肺組織,加入0.25%胰蛋白酶5 mL消化5 min。將周緣肺組織剪碎成盡可能小的組織塊。將組織塊吸入離心管中,加入3 mL IV型膠原酶(2.25 mg/mL),培養箱消化10 min。再加入3 mL中性蛋白酶(10 mg/mL)消化15 min,期間每5 min振蕩1次。置離心機上1 000 r/min離心5 min,棄上清,用10 mL DMEM(含10% FBS)重懸成細胞懸液。200目細胞篩網過濾后制備單細胞懸液,離心后棄上清。加入3 mL ECM重懸后接種到1%明膠包被的6孔板中,置培養箱培養。2 h后換液除去未貼壁及壞死細胞繼續培養,此后每2 d換液1次。②組織貼塊法[3]:在超凈臺內剪取肺組織,加入0.25%胰蛋白酶5 mL消化5 min。周緣肺組織剪成1×1×1 mm3大小組織塊,均勻鋪在盛有500 μL FBS的35 mm培養皿中,置培養箱內孵育。45 min后將組織塊取出并均勻貼入1%明膠包被的6孔板中,斜置培養箱中固化1 h。加入500 μL ECM培養基,平置培養箱繼續培養。24 h后追加500 μL ECM培養基,60 h后將組織塊去除并換液,此后每2 d換液1次。③免疫磁珠分選法[4]:CD31抗體磁珠配制:超凈臺內取20 μL羊抗兔IgG磁珠,加入預冷的DMEM(含10% FBS)1 mL,混勻,置磁力分選架上靜置2 min,吸棄DMEM,重復3次,最后用90 μL DMEM(含10% FBS)重懸。取10 μL大鼠抗小鼠CD31單克隆抗體加入上述磁珠DMEM中合成100 μL,混勻,4 ℃冰箱孵育過夜,期間反復振蕩。實驗當天在超凈臺內用DMEM漂洗心肺組織2次,肺周緣組織剪碎成盡可能小的組織塊。加入10 mL I型膠原酶(1 mg/mL),置培養箱中消化60 min,每15 min振蕩1次。1 000 r/min離心5 min,棄上清,用預熱的10 mL DMEM(含10% FBS)重懸。用200目細胞濾網將細胞過濾到無菌離心管中,反復離心重懸2次,最后用DMEM(含10% FBS)重懸成細胞懸液。細胞計數,稀釋成細胞數1×107/mL的細胞懸液,分裝至1.5 mL EP管內,每個EP管中加入1 mL細胞懸液。取出提前配制的CD31抗體磁珠用DMEM(含10% FBS)清洗4次后加入細胞懸液中。混勻后置4 ℃冰箱孵育,每10 min輕微振蕩1次。2 h后將EP管靜置磁力分選架上,10 min后吸棄上清液。加入1 mL ECM培養基反復清洗后轉入1%明膠包被的6孔板內,置培養箱培養,1只小鼠肺組織分離獲得的細胞在同一孔內培養。48 h后換液除去磁珠,此后每2 d換液1次。
1.2.3細胞傳代:細胞長至80%~90%融合時即可傳代,吸出原有培養液,PBS液清洗后加入0.25%胰蛋白酶。消化2~3 min,顯微鏡下觀察細胞間連接疏松,細胞成片收縮時吸出消化液,加入DMEM(含10% FBS)終止消化。用吸管反復吹打,收集細胞懸液至離心管,1 000 r/min離心5 min。棄上清,ECM培養基重懸,培養箱中繼續培養。首次傳代細胞傳至25 cm培養瓶內培養,此后按1:2傳代。
1.2.4細胞形態學觀察:利用倒置顯微鏡觀察細胞生長情況及形態學變化,計算小鼠PMVECs原代培養成功率、從原代培養開始到首次傳代所需時間。
1.2.5PMVECs的鑒定:采用免疫熒光細胞化學染色法檢測VI I I因子相關抗原。培養的第2代細胞接種至放有蓋玻片的6孔板內,制備細胞爬片。100%甲醇-20 ℃固定20 min,0.2% Triton X-100穿膜15 min,3% H2O2孵育15 min,封閉血清封閉20 min。滴加兔抗人VI I I因子相關抗原(1:200)50 μL,4 ℃孵育過夜,滴加熒光標記的羊抗兔IgG(1:100)室溫避光孵育1 h,隨后緩沖甘油封片,熒光顯微鏡下觀察、攝片。陰性對照選PBS代替一抗。
1.2.6PMVECs純度的測定:采用1.2.5的方法將PMVECs上的VI I I因子相關抗原染成綠色,在熒光顯微鏡下隨機選取5個視野觀察免疫熒光染色陽性的PMVECs,計算出陽性細胞個數,并計算同一視野普通光條件下細胞總數,實驗重復3次,根據下列公式計算PMVECs的純度。
PMVECs純度=(陽性細胞數/細胞總數)×100%
1.2.7PMVECs生長曲線的測定:取第2代培養細胞,0.25%胰蛋白酶消化、離心后加入ECM培養基制成單細胞懸液,計數后(每孔1×107個)接種于96孔板內,每孔接種100 μL,設空白組。第2天起每天取5孔細胞,用200 μL DMEM換液,加入MTT溶液(5 mg/mL)20 μL,置培養箱孵育4 h后小心吸棄上清,每孔加入150 μL DMSO,振蕩10 min,用酶聯免疫分析儀于490 nm波長處檢測各孔光吸收值(OD值),連續測定10 d,未測定細胞每3 d換液1次,以時間為橫軸,平均OD值為縱軸繪制細胞生長曲線。
1.3統計學處理方法 采用SPSS19.0軟件進行統計學處理。計量資料用表示,樣本均數的比較采用方差分析,以LSD法進行兩兩比較,樣本率的比較采用行×列的x2檢驗,以行×列表分割后進行兩兩比較。P<0.05為差異有統計學意義。
2 結果
2.1細胞形態學觀察 3種培養方法的細胞生長情況及形態學變化如下:①酶消化法組:4次原代培養2 d后見大量未貼壁細胞,換液后僅遺留少許圓形貼壁不良細胞,未見內皮細胞生長,其他11次見細胞貼壁生長,顯微鏡下可見短梭形、多邊形等內皮細胞生長,存在較多圓形貼壁不良細胞,換液后不能除去,傳代后細胞體積增大,生長活性降低,很少能匯合長滿培養瓶底(見圖1A);②組織貼塊法組:2次出現細菌污染,2次未見內皮細胞游出,6次原代培養至21 d細胞仍未能長滿培養板底,不能進行傳代,5次在培養24 h后PMVECs開始游出,60 h后游出的內皮細胞及紅細胞圍繞組織塊周圍,多次換液后紅細胞可除去,培養細胞多呈短梭形、多邊形,融合的單胞層具有血管內皮細胞典型的鋪路石樣形態,純度高,雜細胞少(見圖1B);③免疫磁珠分選法組:2次培養2 d后僅見少量PMVECs貼壁生長,繼續培養后不能長滿培養板底部,1次經第2次傳代后生長緩慢,培養15 d仍未長滿培養瓶底,其他12次細胞傳代后生長良好,原代培養2 d后可見免疫磁珠附著在細胞表面,經換液后大多磁珠從細胞表面脫落(見圖1C),細胞融合成單層呈典型鋪路石樣排列,純度高,過度生長時呈紡錘狀,傳代后細胞增殖活躍,3~5 d可再次傳代。
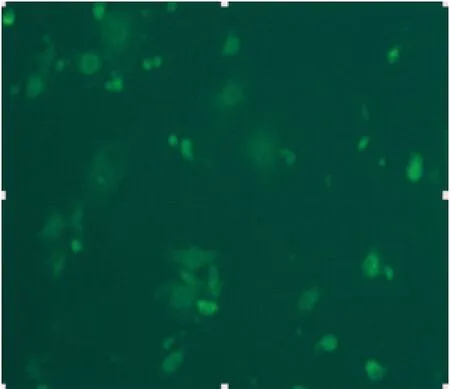
圖2 小鼠PMVECs VI I I因子相關抗原免疫熒光染色陽性(×200)
2.2免疫熒光法檢測VI I I因子相關抗原 熒光顯微鏡下,經免疫熒光染色的培養細胞胞漿呈綠色熒光,細胞呈短梭形、多邊形(見圖2),陰性對照無熒光染色,證實所培養細胞為內皮細胞。
2.33組原代培養PMVECs成功率的比較 將能進行2次以上細胞傳代視為原代培養成功1次。免疫磁珠分選法組成功率明顯高于其他2組,差異有統計學意義(P<0.01),組織貼塊法組成功率明顯高于酶消化法組,差異有統計學意義(P<0.01),見表1。
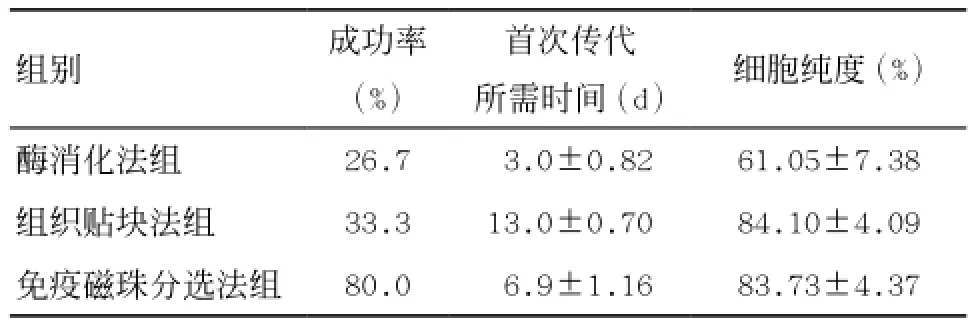
表1 3組原代培養小鼠PMVECs成功率、首次傳代所需時間及純度的比較
2.43組培養PMVECs從原代培養開始到首次傳代所需時間的比較 酶消化法組首次傳代時間明顯短于其他2組,差異有統計學意義(P<0.05),免疫磁珠分選法組首次傳代時間明顯短于組織貼塊法組,差異有統計學意義(P<0.05),見表1。
2.53組培養PMVECs第2代純度的比較 免疫磁珠分選法組純度顯著高于酶消化法組(P<0.01),組織貼塊法組純度顯著高于酶消化法組(P<0.01),免疫磁珠分選法組與組織貼塊法組差異無統計學意義(P>0.05),見表1。
2.63組培養PMVECs生長曲線的比較 免疫磁珠分選法組細胞活性明顯高于酶消化法組(P<0.01),免疫磁珠分選法組細胞活性高于組織貼塊法組(P<0.05),組織貼塊法組細胞活性明顯高于酶消化法組(P<0.01),見圖3。
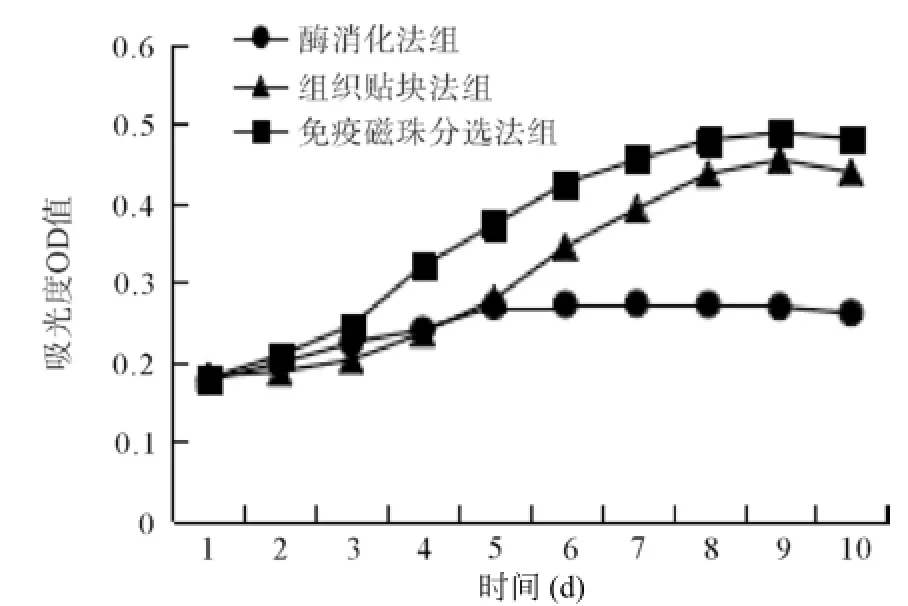
圖3 3組培養小鼠PMVECs生長曲線
3 討論
自1973年首次體外成功培養人臍靜脈內皮細胞以后[1],內皮細胞原代培養技術不斷改進,但是大多為大血管內皮細胞培養,而微血管內皮細胞在細胞形態、基因表型及功能上與其都有很大區別,并且微血管內皮細胞表現為組織器官特異性。故在對炎癥、感染、免疫、腫瘤的生長及移植排斥反應等微血管病變的研究中應選取微血管內皮細胞作為研究的細胞模型[2]。目前用于微血管內皮細胞原代體外培養的方法主要有酶消化法、組織貼塊法和免疫磁珠分選法。
酶消化法中,本研究采用Kim等[2]報道的培養方法并進行適當改進,運用中性蛋白酶聯合IV型膠原酶分離PMVECs。實驗中我們發現該法雖能快速從小鼠肺組織中獲得PMVECs,但是出現了眾多文獻中所報道的問題,如細胞純度不高,重復試驗成功率低,經傳代后細胞活性低,消化時間、酶濃度較難把握。組織貼塊法是目前應用較多的PMVECs培養方法,該法避免了消化酶的化學損傷及組織剪碎過程對細胞的機械損傷[5]。在培養過程中,采用了高潤娣等[3]報道的PMVECs培養方法并適當改進。在實驗中能獲得高純度的小鼠PMVECs,但是由于剪取的小鼠肺周緣組織量少,經過60 h貼壁組織周邊游走出的內皮細胞量少,且分布不均勻,很難形成單層生長,延長了原代培養周期,以致在首次傳代時很多細胞出現老化現象,降低了培養成功率及細胞活性。最后本研究沿用了Hewett等[4]的微血管內皮細胞培養方法并進行了改進,采用I型膠原酶消化肺組織獲得細胞懸液,再利用CD31抗體磁珠陽性分選獲得短梭形、多邊形的細胞,密度高時呈典型的鋪路石樣排列,VI I I因子相關抗原免疫熒光染色呈陽性,鑒定為微血管內皮細胞。細胞數量多,生長快,細胞純度高,可達80%以上,并且原代培養7 d可進行傳代,傳代后細胞生長活性好。該法既克服了酶消化法純度低,細胞活性差的缺點,又克服了組織貼塊法細胞數量少,原代培養周期長的缺點,是一種較高效的PMVECs原代培養方法。該方法的最大缺點是抗體磁珠費用高,細胞培養成本高,因此限制了其大規模使用,本研究采用羊抗兔IgG磁珠與大鼠抗小鼠CD31單克隆抗體自行制備CD31抗體磁珠,而非直接購買抗體磁珠,大大降低了成本。隨著細胞傳代次數增多,細胞體積逐漸增大,生長速度減慢,這可能是長期體外培養條件不適合細胞生長引起的終末分化等引起。實驗中發現5代內細胞生長快且形態穩定,適合臨床與基礎實驗研究。
[1] SAKAO S,TARASEVICIENE-STEWART L,WOOD K,et al. Apoptosis of pulmonary microvascular endothelial cells stimulates vascular smooth muscle cell growth[J]. Am J Physiol Lung Cell Mol Physiol,2006,291(3): L362-368.
[2]KIM N S,KIM S J. Isolation and cultivation of microvascular endothelial cells from rat lungs: effects of gelatin substratum and serum[J]. Yonsei Med J,1991,32(4): 303-314.
[3]高潤娣,曹婕,盧珊,等. 小鼠肺微血管內皮細胞的培養鑒定及其血管形成功能的研究[J]. 中國病理生理雜志,2012,28(1): 186-188,192.
[4]HEWETT P W,MURRAY J C. Human lung microvessel endothelial cells: isolation,culture,and characterization[J]. Microvasc Res,1993,46(1): 89-102.
[5]陳瑞華,趙自剛,牛春雨,等. 大鼠肺微血管內皮細胞的培養[J]. 中國微循環,2007,11(1): 16-19.
(本文編輯:趙翠翠,丁敏嬌)
Comparison of different methods for mouse pulmonary microvascular endothelial cells culture
ZHOU Lingping,FENG Cheng,TANG Xuebin,XU Honglei. Department of Pulmonary and Critical Care Medicine,the First Affiliated Hospital of Wenzhou Medical University,Wenzhou,325015
Objective: To explore an effcient and stable method for the mouse pulmonary microvascular endothelial cells (PMVECs) culture. Methods: Forty-fve 1 week old Balb/c mice were randomly divided into three groups. Mouse PMVECs were isolated and cultured respectively by enzyme digestion method,explants method and immunimagnetic beads method. Cells were identifed by morphological observation and VIII factor related antigen immunofuorescence staining. The success rate of primary culture and the time required from primary culture to the beginning of the frst passage was calculated,the cell purity was determinated,growth curves were drew by MTT method. Results: Short spindle and polygonal microvascular endothelial cells were observed in all of the three methods. Those cells were positive to the VIII factor related antigen. The success rate and cell activity in immunomagnetic beads method group increased signifcantly compared with the other two groups (P<0.01). As for the time required from primary cultured to the beginning of the frst passage,it decreased in immunomagnetic beads method group compared with the explant method group (P<0.05). And the purity increased significantly in immunomagnetic beads method group compared with the enzyme digestion method group (P<0.01). Conclusion: Immunomagnetic beads method is of higher repeatability,rapider separation,and obtains much higher purity and better activity mice PMVECs.
cell culture; primary culture; immunomagnetic beads; pulmonary microvascular endothelial cells
R331
B DOI: 10.3969/j.issn.2095-9400.2016.08.010
2015-06-08
浙江省自然科學基金資助項目(LY12H01001)。
周玲萍(1987-),女,浙江龍泉人,住院醫師。
徐紅蕾,教授,Email:601282329@qq.com。

