高血壓合并房顫患者外周血SIRT1表達及其與氧化應激的關系
歐陽春,張里克,盧遠航,李先林
(湖北省中山醫院,武漢430030)
高血壓合并房顫患者外周血SIRT1表達及其與氧化應激的關系
歐陽春,張里克,盧遠航,李先林
(湖北省中山醫院,武漢430030)
目的 探討高血壓合并房顫患者外周血沉默信息調節因子1(SIRT1)mRNA和蛋白表達水平及其與氧化應激的關系。方法 選擇高血壓合并房顫患者60例,根據房顫類型分為持續房顫組26例和陣發房顫組34例,另選高血壓竇性心律患者40例(對照組),分別采用實時熒光定量PCR法和Western blotting法檢測各組外周血單核細胞SIRT1 mRNA和蛋白表達;采用硫代巴比妥酸法檢測外周血丙二醛(MDA),免疫比濁法檢測外周血高敏C反應蛋白(hs-CRP);分析外周血SIRT1表達與MDA、hs-CRP的關系。結果 陣發房顫組SIRT1 mRNA及蛋白表達顯著高于持續房顫組、對照組(P均<0.05),而持續房顫組、對照組比較差異均無統計學意義(P均>0.05)。持續房顫組血清MDA、hs-CRP水平均顯著高于陣發房顫組和對照組(P均<0.05);陣發性房顫組血清MDA、hs-CRP水平較對照組雖有升高趨勢,但兩組比較差異均無統計學意義(P均>0.05)。持續房顫組和陣發房顫組SIRT1表達與MDA呈負相關(P均<0.05),與hs-CRP無明顯相關性(P均>0.05),對照組SIRT1表達與MDA、hs-CRP均無明顯相關性(P均>0.05)。結論 SIRT1是心肌細胞的保護因素,與氧化應激呈負相關關系。
高血壓;房顫;氧化應激;沉默信息調節因子1;丙二醛;高敏C反應蛋白
心房顫動(簡稱房顫)是臨床常見的心律失常之一,有研究發現,氧化應激反應所產生的活性氧簇在促進房顫的發生中具有重要作用[1,2]。沉默信息調節因子1(SIRT1)是一種依賴煙酰胺腺嘌呤二核苷酸的組蛋白去乙酰化酶,可通過調節心臟活性氧簇,參與對氧化應激的調控[3,4]。因此推測,外周血SIRT1表達變化可能影響房顫的發生、發展過程,但目前鮮見關于SIRT1與房顫及氧化應激關系的報道。本研究觀察高血壓合并房顫患者外周血SIRT1表達變化,并分析SIRT1與氧化應激的關系,旨在為房顫的預防及治療提供參考。
1 資料與方法
1.1 臨床資料 選擇2011年7月~2014年7月在我院住院治療的高血壓合并房顫患者60例。高血壓的診斷參照《中國高血壓防治指南》(2010年版)[5];房顫的診斷標準:心電圖顯示P波消失,代之以大小不等、形狀各異、間隔不等、不規則的細小f波,頻率一般為350~600次/min,f波間無等電位線存在,其發作呈持續(持續時間6~12個月)或陣發性(每次發作時間≤48 h,服用藥物后消失或自行消失)。排除標準:①合并冠心病、風濕性心臟病者;②合并嚴重感染或伴有自身免疫性疾病者;③肝腎功能異常或合并呼吸系統疾病者;④罹患糖尿病、繼發性高血壓或惡性腫瘤者。根據房顫類型分為持續房顫組26例、陣發房顫組34例。持續房顫組男11例、女15例,年齡(56.8±6.3)歲,合并高血脂23例;陣發房顫組男14例、女20例,年齡(57.6±7.5)歲,合并高血脂29例。同期另選在我院就診的高血壓竇性心律患者40例(對照組),男16例、女24例,年齡(55.9±6.1)歲,合并高血脂33例。三組性別、年齡及合并高血脂情況等具有可比性。
1.2 相關指標觀察
1.2.1 外周血SIRT1 mRNA ①總mRNA提取:抽取各組肘靜脈血5 mL,置于抗凝管中,2 500 r/min離心10 min,分離單核細胞;抽取單核細胞,置于離心管中,加入5倍生理鹽水搖勻,2 500 r/min離心15 min,棄去上清液;再加入1.5 mL TRIzol溶液,充分振蕩使細胞完全裂解;分別加入100 μL氯仿、500 μL異丙醇搖勻,靜置10 min,2 000 r/min離心10 min,棄去上清液,沉淀用吸水紙吸干,室溫干燥5 min。將提取的總RNA加入1 μL溴酚藍,置于瓊脂糖凝膠上樣孔內,常規電泳20 min,以紫外分光光度計檢測總RNA光密度(OD),OD260/OD280為1.8~2.0為合格。②cDNA合成:采用SYBR Green Assay逆轉錄反應體系。將提取的總mRNA按照以下條件逆轉錄為cDNA:總RNA 2 μL,2×buffer 10 μL,Oligo(DT) 0.5 μL,dNTP 10 mmol,逆轉錄酶22 U/μL,DMSO 44 μL,RNasin 0.25 μL,ddH2O 0.25 μL。上述體系放入PCR擴增儀中反轉錄。反應條件:60 ℃變性5 min,30 ℃變性1 min,60 ℃退火20 min,95 ℃延伸10 min,最后10 ℃延伸5 min。③SIRT1 mRNA表達檢測:采用實時熒光定量PCR法。引物序列由南京金斯瑞生物科技有限公司設計,SIRT1上游引物:5′-ATGTAGAGTCTGATGGTCTAGC-3′,下游引物:5′-CGTTGTGGTGTTAGTTTCTGCG-3′;內參GAPDH上游引物:5′-CACGATCATCATCTCTCAGCTT-3′,下游引物:5′-AAGTCGTTCGGATGGCTGTACA-3′;PCR反應體系20 μL:Taq 10 μL、cDNA 1 μL、上下游引物各0.5 μL、ddH2O 8 μL。反應條件:95 ℃預變性5 min,95 ℃變性30 s,65 ℃退火45 s,72 ℃延伸1 min,40個循環后72 ℃延伸5 min。根據擴增曲線與溶解曲線計算Ct值,目的基因相對表達量=2-ΔΔCt,ΔCt=目的基因Ct-內參基因Ct;ΔΔCt=試驗組ΔCt-對照組ΔCt。
1.2.2 外周血SIRT1蛋白 采用Western blotting法。將外周血用裂解液處理后,按照Bradford蛋白定量試劑盒測定蛋白含量;凝膠蛋白電泳,將電泳凝膠用NC膜轉膜后封閉,再置于封閉液稀釋的Ⅰ抗孵育,化學發光顯影后掃描,White/Ultraviolet Transilluminator凝膠成像分析系統進行分析半定量。以β-actin作為內參照,二者比值為相對表達量。
1.2.3 氧化應激指標 清晨空腹抽取各組肘靜脈血2 mL,靜置1 h,2 500 r/min分離15 min,取血清,保存備檢。采用硫代巴比妥酸法檢測血清丙二醛(MDA)、采用免疫比濁法檢測血清高敏C反應蛋白(hs-CRP)。
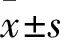
2 結果
2.1 各組外周血SIRT1 mRNA及蛋白表達比較 見表1。
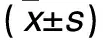
表1 各組外周血SIRT1 mRNA及蛋白相對表達比較
注:與持續房顫組比較,*P<0.05;與陣發房顫組比較,#P<0.05。
2.2 各組血清MDA、hs-CRP水平比較 見表2。
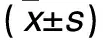
表2 各組血清MDA、hs-CRP水平比較
注:與持續房顫組比較,*P<0.05。
2.3 SIRT1 mRNA表達與MDA、hs-CRP的關系 相關性分析顯示,持續房顫組、陣發房顫組SIRT1 mRNA表達與MDA均呈負相關(r分別為-0.589、-0.324,P均<0.05),與hs-CRP均無明顯相關性(r分別為0.171、0.198,P均>0.05);對照組SIRT1 mRNA表達與MDA、hs-CRP均無明顯相關性(r分別為0.203、0.257,P均>0.05)。
3 討論
據統計,60歲以上人群房顫的發病率約為1%,其發病率隨著年齡增長逐漸升高[6]。研究證實,高血壓伴發房顫患者發生栓塞性并發癥的風險明顯增加。房顫發生時心房肌的氧化應激產物增加、氧化還原基因表達失衡以及線粒體DNA存在氧化損傷,表明氧化應激與房顫的發生有關;氧化應激反應會損傷線粒體和鈣泵功能,導致細胞內鈣超載,進而激活依賴鈣離子蛋白水解酶,促使心肌收縮功能減退,繼而導致心房結構重構[7]。因此,對高血壓患者給予抗氧化作用藥物,可防止心房結構重構,減少房顫的發生。
SIRT是存在于多種生物中的高度保守基因,在人類共有7個同源基因,目前研究較多的是SIRT1。SIRT1在多種疾病中參與氧化應激反應的調控[8]。樊磊等[9]研究發現,SIRT1與先天性心臟病、心肌炎、心力衰竭等心臟疾病密切相關;SIRT1主要參與調節心肌細胞的生長、分化過程,對心臟的發育具有促進和保護作用[10]。Ulas等[11]在動物研究中發現,激活SIRT1能夠促進內皮細胞NO合酶的活性,改善內皮功能,進而抑制動脈粥樣硬化。趙軍等[12]通過建立心室快速起搏所致心力衰竭犬模型發現,心肌SIRT1表達水平顯著升高,提示SIRT1能夠避免心肌細胞發生凋亡,證實SIRT1能夠抑制心臟組織重構所致的心力衰竭。氧化應激反應參與了房顫的發生,其機制可能是氧化應激導致心房組織發生結構和電生理重構。譚含璇等[13]對心房快速起搏房顫犬給予抗氧化劑后,房顫發生率明顯降低,房顫持續時間明顯縮短,證實活性氧清除劑能夠抑制心房發生電生理重構。胡明珠等[14]報道,SIRT1表達上調能夠激活FOXO信號途徑,導致機體氧化應激水平顯著降低,從而避免機體發生氧化應激損傷。鄔云斌等[15]也證實,SIRT1能夠通過抑制氧化應激水平,阻斷p53誘導的細胞凋亡;當機體發生氧化應激反應時,SIRT1能夠使p53去乙酰化,調節細胞的代謝;而能量限制會進一步誘導SIRT1表達增加,使細胞氧化應激損傷減輕。推測SIRT1可能參與了房顫的發生。
本研究結果顯示,陣發房顫組SIRT1表達水平顯著升高,提示在房顫早期SIRT1高表達能夠抑制房顫的發展,但隨著陣發性房顫發展成持續性房顫,SIRT1表達開始降低。本研究還發現,持續房顫組血清MDA、hs-CRP水平顯著高于對照組、陣發房顫組,而陣發房顫組與對照組比較,血清MDA、hs-CRP水平也有升高趨勢,提示炎癥對房顫的促發和維持可能有一定作用。相關分析顯示,無論持續還是陣發房顫,SIRT1 mRNA表達與MDA均呈負相關,而對照組SIRT1 mRNA表達與MDA、hs-CRP無明顯相關性,與孫雪林[16]等報道一致。當炎癥因子沉積于心房組織中,會導致局部組織發生纖維化,進而誘發房顫;炎癥與氧化應激互為因果,共同導致心房結構和功能發生重構[17,18]。房顫患者SIRT1表達與MDA呈負相關,說明SIRT1能夠抑制氧化應激,特別對于陣發房顫。SIRT1能夠在早期抑制房顫的發展。但隨著房顫程度的加重,這種保護作用開始減弱[19,20]。
綜上所述,高血壓合并房顫患者外周血SIRT1表達增加,SIRT1與氧化應激呈負相關,與hs-CRP無明顯相關性,故認為SIRT1是心肌細胞的保護因素,通過降低氧化應激反應可抑制房顫的進展。但本研究未充分考慮持續SIRT1表達對心肌細胞和房顫的不利影響,確切結論還有待于進一步研究證實。
[1] Mohebbi M, Ghassemian H. Predicting termination of paroxysmal atrial fibrillation using empirical mode decomposition of the atrial activity and statistical features of the heart rate variability[J]. Med Biol Eng Comput, 2014,52(5):415-427.
[2] Li J, Song J, Jiang MH, et al. Interleukin-6 promoter polymorphisms and susceptibility to atrial fibrillation in elderly han chinese patients with essential hypertension[J]. J Interferon Cytokine Res, 2012,32(11):542-547.
[3] Takizawa Y, Kosuge Y, Awaji H, et al. Up-regulation of endothelial nitric oxide synthase (eNOS), silent mating type information regulation 2 homologue 1 (SIRT1) and autophagy-related genes by repeated treatments with resveratrol in human umbilical vein endothelial cells[J]. Br J Nutr, 2013,110(12):2150-2155.
[4] 杜月光,柴可夫,錢俊文,等.SIRT1通過降低NF-κB p65乙酰化減輕高糖應激引起的大鼠腎小球系膜細胞損傷[J].中國病理生理雜志,2014,30(4):664-669.
[5] 中國高血壓防治指南修訂委員會.中國高血壓防治指南2010[J].中華心血管病雜志,2011,39(7):579-616.
[6] Mayyas F, Alzoubi KH, Van Wagoner DR. Impact of aldosterone antagonists on the substrate for atrial fibrillation: aldosterone promotes oxidative stress and atrial structural/electrical remodeling[J]. Int J Cardiol, 2013,168(6):5135-5142.
[7] Goette A, D′Alessandro A, Bukowska A, et al. Rationale for and design of the CREATIVE-AF trial: randomized, double-blind, placebo-controlled, crossover study of the effect of irbesartan on oxidative stress and adhesion molecules in patients with persistent atrial fibrillation[J]. Clin Drug Investig, 2008,28(9):565-572.
[8] 李為民,盛力,李悅,等.氧化應激對心房顫動犬心房病理組織學及超微結構改變的影響[J].中華醫學雜志,2008,88(14):985-989.
[9] 樊磊,白曉智,楊龍龍,等.活化沉默信息調節因子1對大鼠嚴重燙傷早期心肌損害的影響[J].中華燒傷雜志,2014,30(3):194-198.
[10] Toyama K, Yamabe H, Uemura T, et al. Analysis of oxidative stress expressed by urinary level of 8-hydroxy-2′-deoxyguanosine and biopyrrin in atrial fibrillation: effect of sinus rhythm restoration[J]. Int J Cardiol, 2013,168(1):80-85.
[11] Ulas T, Haclbekiroglu T, Sezen H, et al. Comment on: Analysis of oxidative stress expressed by urinary level of 8-hydroxy-2′-deoxyguanosine and biopyrrin in atrial fibrillation: effect of sinus rhythm restoration[J]. Int J Cardiol, 2013,167(4):1643.
[12] 趙軍,趙美琴,史長征,等.基于SIRT1軸探討不同強度有氧運動對NAFLD大鼠脂肪性肝炎的影響[J].體育科學,2014,34(11):50-59,96.
[13] 譚含璇,初紅霞,樊靜靜,等.心力衰竭犬跨室壁心肌復極時間和不應期離散度的致心律失常機制研究[J].中國病理生理雜志,2011,27(3):417-424.
[14] 胡明珠,周波,盛瓊,等.PI3 K/Akt/Sirt1信號通路介導硫化氫后處理對大鼠缺血心肌的保護作用[J].中國藥理學通報,2016,32(2):268-273.
[15] 鄔云斌,劉新偉,何東偉,等.白藜蘆醇對大鼠心肌缺血再灌注損傷的保護作用及其與sirt1-p53通路的關系[J].中國老年學雜志,2011,31(24):4822-4825.
[16] 孫雪林,卜培莉,劉軍妮,等.房顫患者右心耳組織SIRT1表達以及與氧化應激的相關性[J].細胞與分子免疫學雜志,2012,28(9):972-974.
[17] Ederhy S, Di Angelantonio E, Dufaitre G, et al. C-reactive protein and transesophageal echocardiographic markers of thromboembolism in patients with atrial fibrillation[J]. Int J Cardiol, 2012,159(1):40-46.
[18] 陳莉,程文立,柯元南,等.不同周齡高血壓載脂蛋白E基因敲除小鼠主動脈彈力纖維降解和膠原改變與氧化應激和炎癥變化的關系[J].中華心血管病雜志,2012,40(6):505-510.
[19] Lübkemeier I, Andrié R, Lickfett L, et al. The Connexin40A96S mutation from a patient with atrial fibrillation causes decreased atrial conduction velocities and sustained episodes of induced atrial fibrillation in mice[J]. J Mol Cell Cardiol, 2013(65):19-32.
[20] Kawashima T, Inuzuka Y, Okuda J, et al. Constitutive SIRT1 overexpression impairs mitochondria and reduces cardiac function in mice[J]. J Mol Cell Cardiol, 2011,51(6):1026-1036.
10.3969/j.issn.1002-266X.2016.24.028
R541.7
B
1002-266X(2016)24-0073-03
2016-03-15)

