次氯酸和氯氣的氧化性強弱比較
◇ 甘肅 毛宗華
(作者單位:甘肅省華亭縣第一中學)
?
次氯酸和氯氣的氧化性強弱比較
◇ 甘肅 毛宗華
在中學階段,往往根據氧化還原反應的強弱來判斷物質的氧化性或還原性的強弱.例如,在氯水中存在反應Cl2+H2OH++Cl-+HClO,根據強弱規律,Cl2氧化性大于HClO.但將濃鹽酸和次氯酸鈉溶液混合,發生的反應H++ClO-=Cl2+H2O(pH<7.5時HClO穩定,pH>7.5時ClO-穩定,所以該反應的離子反應方程式應寫成上述形式),根據強弱規律,HClO氧化性又大于Cl2.那么,Cl2和HClO的氧化性到底誰強呢?弄清上述2個反應自發進行的條件和強弱規律的適用條件方可解決這一問題.
1 歧化反應自發進行的條件
氧化還原反應是由2個或2個以上氧化還原電對的半反應組成的.若把由兩電對組成的氧化還原反應設計成原電池,則兩電對分別在兩電極上發生氧化反應和還原反應.電池的電動勢EMF就是電對的電極電勢差,即EMF=E正-E負,當EMF>0時,反應能自發進行,當EMF<0時,反應不能自發進行.
歧化反應是特殊的氧化還原反應.判斷歧化反應能否自發進行的方法有多種,比較簡便的方法是根據元素電勢圖判斷,即把同一元素的各種氧化態(或部分氧化態)按照高低順序排成橫行,在2種氧化態之間若構成一個電對,就用一條直線把它們連接起來,并在上方標出這個電對所對應的標準電極電勢.
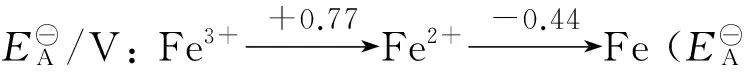
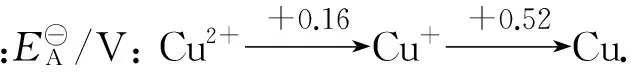
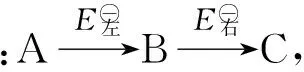
2 強弱規律的適用條件
強弱規律適用于自發的氧化還原反應,不適用非自發的氧化還原反應.如對自發的歧化反應2Cu+=Cu2++Cu,根據強弱律,Cu+氧化性大于Cu2+,Cu+還原性大于Cu,它和根據Cu2+/Cu+電對與Cu+/Cu電對的電極電勢高低判斷出的氧化還原能力一致,是正確的.對非自發的歧化反應3Fe2+=2Fe3++Fe,根據強弱規律,Fe2+氧化性大于Fe3+,Fe2+還原性大于Fe,它和根據Fe3+/Fe2+電對與Fe2+/Fe電對的電極電勢高低判斷出的氧化還原能力是相反的.
3 Cl2和HClO氧化性強弱比較
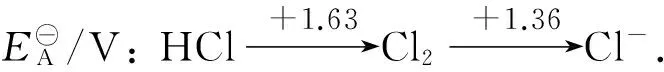
當pH<4.6時, HClO/Cl2電對的電極電勢大于Cl2/Cl-電對的電極電勢.此時,E右>E左, Cl2不能自發發生歧化反應生成HClO和HCl,而逆反應H++Cl-+HClO=Cl2+H2O能自發發生,根據強弱律可判斷出氧化性HClO大于Cl2.當pH>4.6時, HClO/Cl2電對的電極電勢將小于Cl2/Cl-電對的電極電勢.此時,E左>E右, Cl2能自發發生歧化反應生成HClO和HCl,反應Cl2+H2O=H++Cl-+HClO能自發進行,根據強弱律可判斷出Cl2氧化性大于HClO.所以,當pH<4.6時,HClO氧化性大于Cl2;當pH>4.6時,Cl2氧化性大于HClO.
(作者單位:甘肅省華亭縣第一中學)

