高通量檢測大樣本桑黃發酵液總黃酮含量方法的建立
毛東霞 ,阮芹芹,趙 敏,郭丹丹,王 苗,田曉雪,劉 陶*
1陜西師范大學生命科學學院,西安 710100;2 長慶油田分公司油氣工藝研究院,西安 710021
黃酮類化合物(Flavonoids)是以C6-C3-C6 結構為基本母核的色原烷或色原酮的衍生物[1]。黃酮類化合物具有抗氧化、抗炎鎮痛、調節免疫、抗衰老、降血脂、抗腫瘤等藥理作用[2],在葛根、黃芩、桑白皮、銀杏葉等中藥及大型藥用真菌桑黃的藥理作用中扮演著重要角色。
各類樣品中黃酮類物質含量的檢測方法主要包括分光光度計比色法、氣相色譜法(Gas Chromatography,GC)、高效液相色譜(High Performance Liquid Chromatography,HPLC)、毛細管電泳等[3]。其中分光光度計比色法是被中國藥典所采用的最常見的總黃酮測定方法,而其中又以NaNO2-Al(NO3)3-NaOH比色法最為常用[4]。NaNO2-Al(NO3)3-NaOH 比色法測定原理主要是基于黃酮類化合物的紫外吸收光譜中的環肉桂酰系統引起的吸收帶I(300~550 nm)和環苯酰系統引起的吸收帶Ⅱ(220~280 nm)。鋁離子可以與黃酮類化合物形成穩定的配合物,從而使帶Ⅱ發生紅移[5];在NaNO2的強堿性溶液中,其在510 nm 處具有最大吸收值,從而為NaNO2-Al(NO3)3-NaOH 比色法測定黃酮類化合物提供了依據[6]。王勇等[7]使用硝酸鋁顯色法、直接測定法、三氯化鋁顯色法對4 種甘草中黃酮含量測定的比較結果表明,亞硝酸鈉-硝酸鋁顯色法測定結果準確性高,重現性好。國外文獻資料中,黃酮含量的測定也主要集中于使用此法[8-10]。
然而在實際測定中,使用該法測定樣品需要量大,反應試劑消耗多,操作步驟繁瑣,因此對微量和大量樣品的測定難以快速、準確地進行。在建立高通量微孔板法測試桑黃多糖含量方法的基礎上[11],本次實驗以桑黃液體發酵液中的黃酮含量為測試對象,使用96 微孔板,以正交設計法對在高通量條件下對測定黃酮含量的主要影響因素亞硝酸鈉添加量、硝酸鋁添加量、氫氧化鈉添加量及反應時間進行了優化,并對所建立體系的準確性和穩定性進行了考察和驗證,同時通過和標準黃酮含量檢測方法比較,為此類大樣本中總黃酮含量的檢測提供了一個更簡便和經濟的方法。
1 材料與方法
1.1 材料
1.1.1 菌種
桑黃菌(Phellinussp.P0988),保藏于中國典型培養物保藏中心,編號為CCTCC NO:M 2012080。
1.1.2 主要試劑與儀器
Epoch 超微量微孔板分光光度計(美國BioTek);SB5200DT 型數控超聲波清洗器(寧波新芝生物科技有限公司);FA2004N 分析天平(上海精科儀器有限公司);DGG-9053A 型電熱恒溫鼓風干燥箱(上海森信實驗儀器有限公司);MH-2 微量振蕩器(海門市其林貝爾儀器制造有限公司)。
蘆丁(三水蕓香葉苷)標準品購自國藥集團上海化學試劑有限公司,生產批號F20 090115;無水乙醇、亞硝酸鈉、硝酸鋁、氫氧化鈉等均為國產分析純。
1.2 實驗方法
1.2.1 檢測波長確定
據文獻報道[12-15],選定蘆丁作為測定的標準品,量取桑黃發酵液的黃酮提取物及蘆丁溶液,按照傳統亞硝酸鈉-硝酸鋁顯色方法[4]反應之后,于200~600 nm 進行全波長掃描,確定測定該類樣品檢測的最佳檢測吸收波長。
1.2.2 顯色條件優化
以桑黃發酵液提取物為測試對象,選擇亞硝酸鈉添加量(A)、硝酸鋁添加量(B)、氫氧化鈉添加量(C)以及反應時間(D)為主要考察因素,進行L9(34)正交實驗。每個因素選擇3 個水平,因素水平如表1 所示(n=3)。
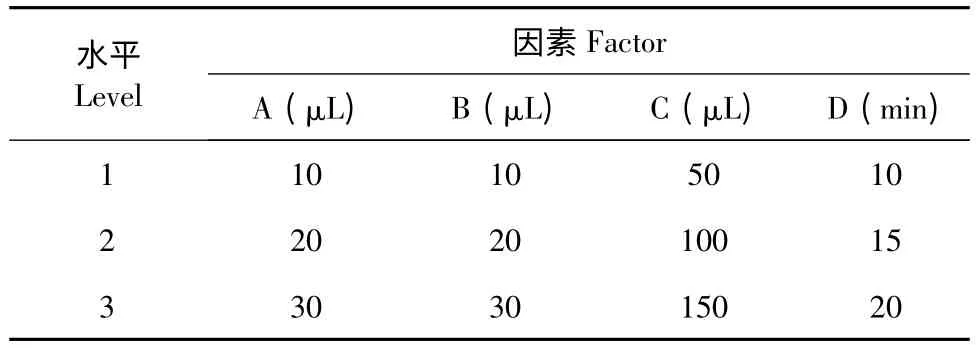
表1 正交試驗因素水平表Table 1 Factors and levels of orthogonal experiments
1.2.3 標準曲線的制作及線性范圍的確定
精密吸取標準品溶液,按照1.2.2 中優化后的顯色條件反應之后,使用超微量微孔板分光光度計于最佳檢測吸收波長處測定其吸收值,以標準品濃度(X)為橫坐標,吸收值(Y)為縱坐標,繪制標準曲線,得到線性回歸方程,確定其線性范圍。
1.2.4 穩定性實驗
精密量取一定濃度的桑黃發酵液提取物,按照1.2.2 中確定的測定條件檢測。每隔1 h 測定同一樣品的吸收值,比較多次的測定結果。
1.2.5 精密度實驗
精密吸取一定濃度的桑黃發酵液提取物,按照1.2.2 中確定的測定條件連續獨立測定6 次,對實驗精密度及相對標準偏差(Relative standard deviations,RSD)進行評估。
1.2.6 加樣回收率實驗
分別向3 種不同濃度的桑黃發酵液提取物中定量加入標準品溶液,按照1.2.2 中確定的測定條件測定總黃酮含量并計算加樣回收率。
1.2.7 和傳統測定方法檢測的比較分析
為了驗證所建立的高通量微孔板測定法的準確性,以5 個黃酮桑黃發酵液的黃酮樣品為測試對象,分別使用本實驗所確定的微孔板高通量測定方法、保健食品中總黃酮的測定方法[16]和中國藥典(2010)中總黃酮含量的測定方法[4]進行比較分析測定。每個樣品重復三次,計算其測定相對標準偏差。
1.2.8 大樣本檢測驗證
為了進一步驗證所建立的微孔板高通量測定方法的可行性和準確性,以24 個桑黃發酵液的黃酮樣品為測試對象,使用本實驗建立的微孔板法檢測此大樣本中的總黃酮含量。
2 結果與分析
2.1 最佳檢測波長確定
對桑黃發酵液提取物和蘆丁標準品的波譜掃描比較結果表明二者在可見光區510 nm 左右處均有最大光吸收峰,與有關黃酮最大光吸收值的文獻報道一致[17-21]。本實驗確定選擇蘆丁為檢測標準品,選擇510 nm 為檢測反應的最佳檢測波長。
2.2 正交設計實驗及方差分析
準確吸取桑黃發酵液提取物于微孔板中,按表2 中的各因素的添加量進行試驗,使用超微量微孔板分光光度計在510 nm 處測定其吸光值。實驗結果見表2、表3。極差分析(Rj)顯示(表2),硝酸鋁添加量是影響顯色反應后樣品吸收值最重要的影響因素,亞硝酸鈉加入量和反應時間的影響相對較小,且這些因素對顯色反應的吸收值影響作用顯著(表3,α=0.05)。結果還顯示,影響因素包括亞硝酸鈉、硝酸鋁和氫氧化鈉的最佳用量分別為30 μL、30 μL 和50 μL,反應時間為10 min。
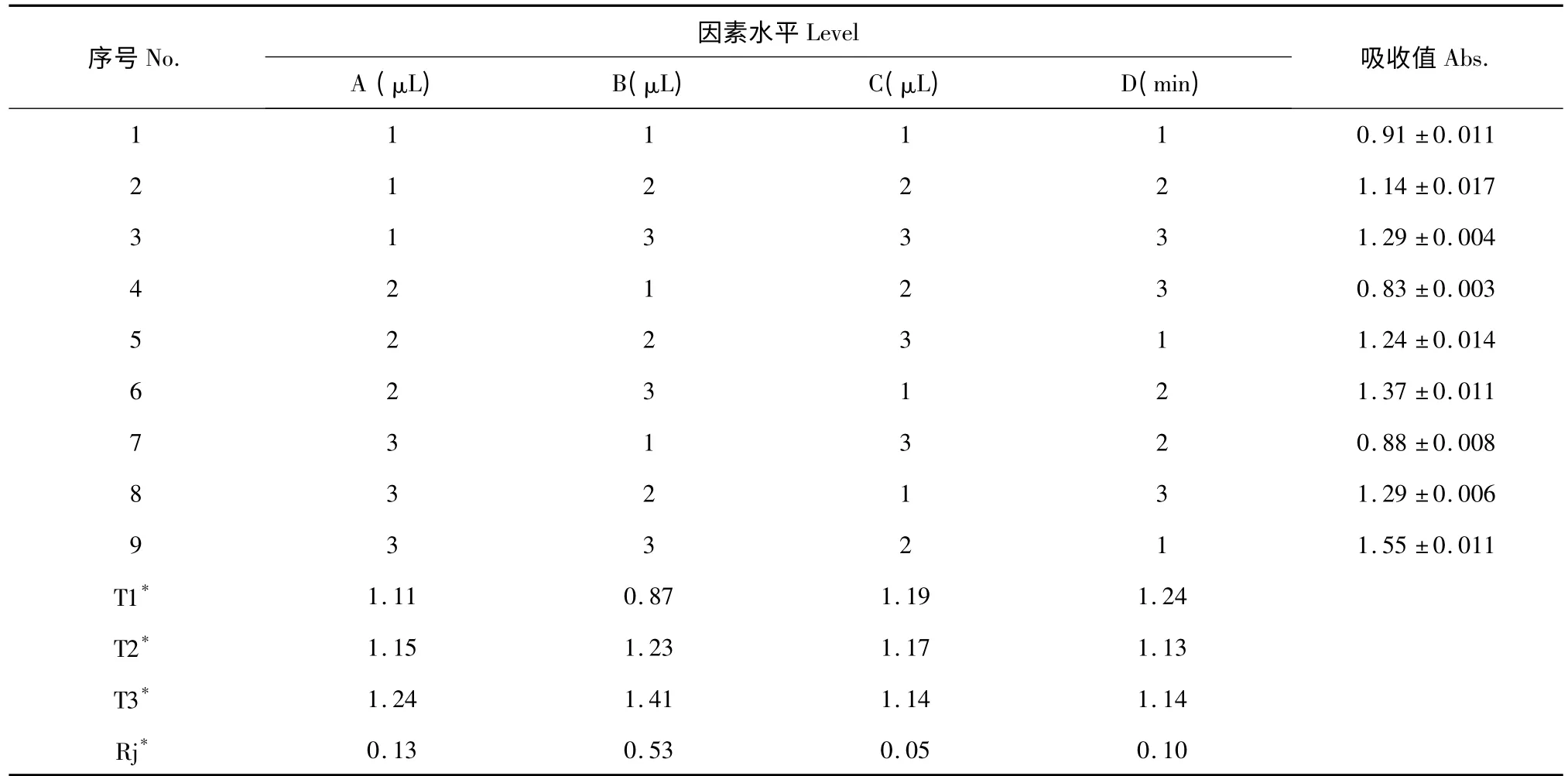
表2 正交實驗設計及結果Table 2 The orthogonal experimental design and results
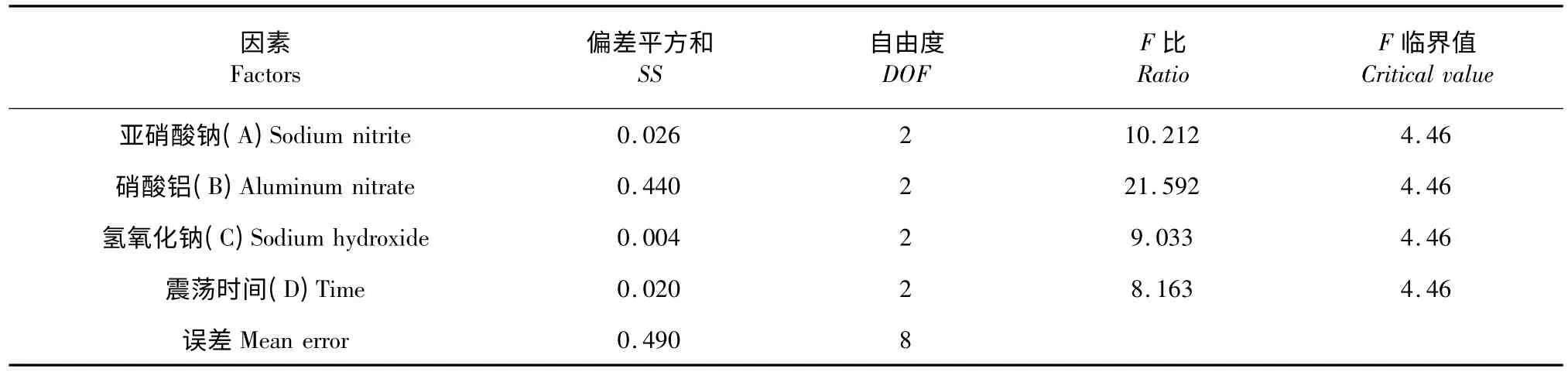
表3 方差分析表Table 3 ANOVA table
2.3 標準曲線制作及線性范圍確定
如表4 所示,在不同測定范圍內,使用該方法測定的r2均接近于1,標準偏差均滿足要求。其中,當線性范圍為0~50 μg/mL 時,r2值最大達到0.9994,因此,實驗選定0~50 μg/mL 為測定的線性范圍。

表4 線性范圍考察表Table 4 Table of linear range examination
2.4 穩定性實驗
實驗結果顯示,在4 h 內供試液吸收值由0.1016 變 為0.1005,相對標準偏差RSD為0.607%。表明使用此法檢測黃酮含量穩定性良好,在4 h 內顯色較穩定。
2.5 精密度與加樣回收率實驗
以桑黃發酵液提取物為樣品平行測定6 次,吸收值測定結果分別為0.0528、0.0489、0.0505、0.0511、0.0497 和0.0503,RSD為2.63%。表明該方法精確度高。加樣回收率在98%~104%之間,平均為100.7%,變異系數在0.67%~1.50%之間。結果顯示,該方法準確、可靠。
2.6 檢測方法比較分析
比較結果顯示(表5):和傳統方法相比,本實驗建立的高通量檢測方法靈敏度更高,測定誤差小,測定結果更準確、可靠。
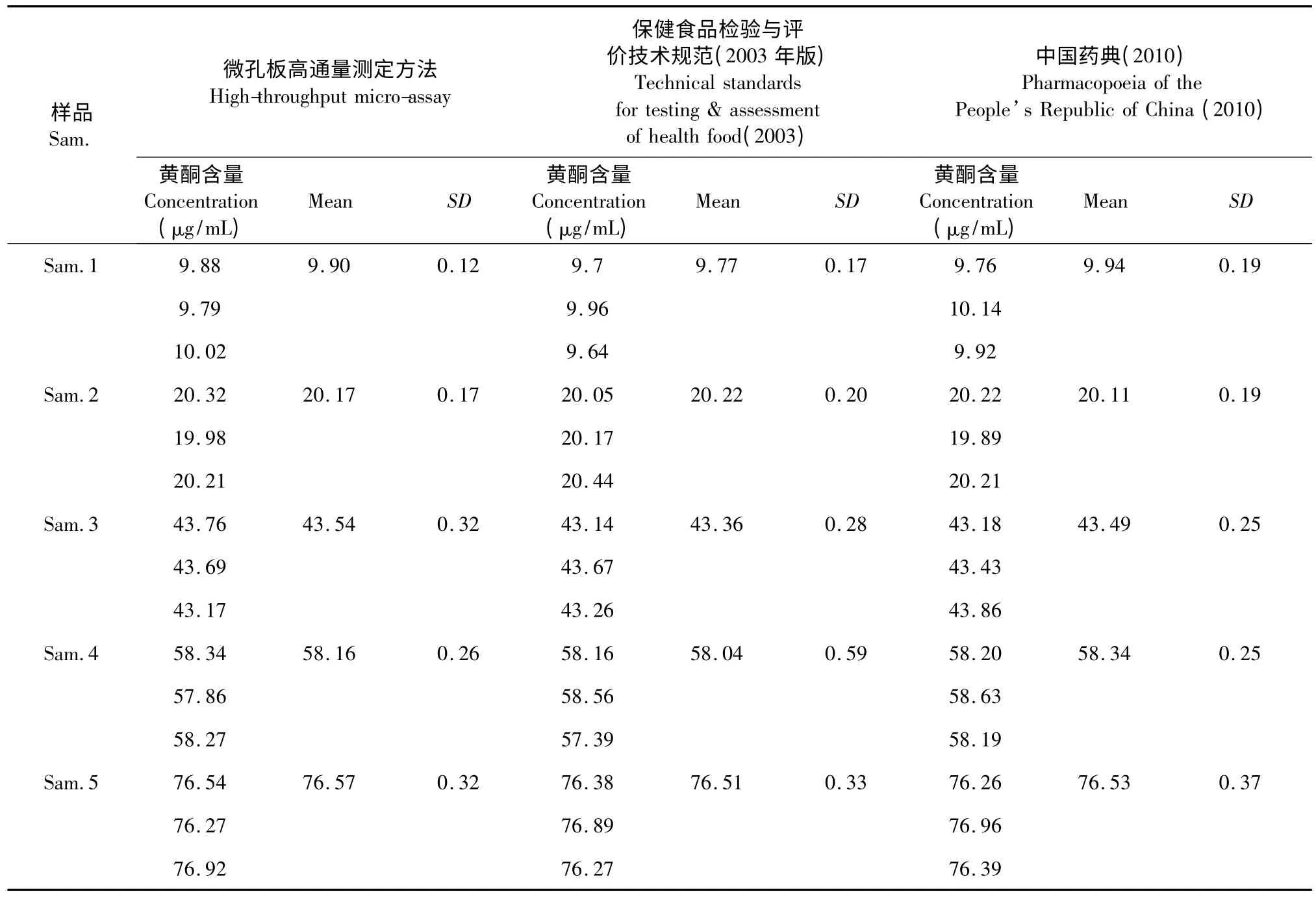
表5 測定方法比較分析Table 5 Results comparison between different methods
2.7 大樣本檢測驗證
使用該法一次性測定24 個桑黃發酵液中總黃酮含量(表6)。結果顯示,對于一次性測定大樣本樣品,相對標準偏差分析均符合相關要求,證實該法可用于大樣本檢測。
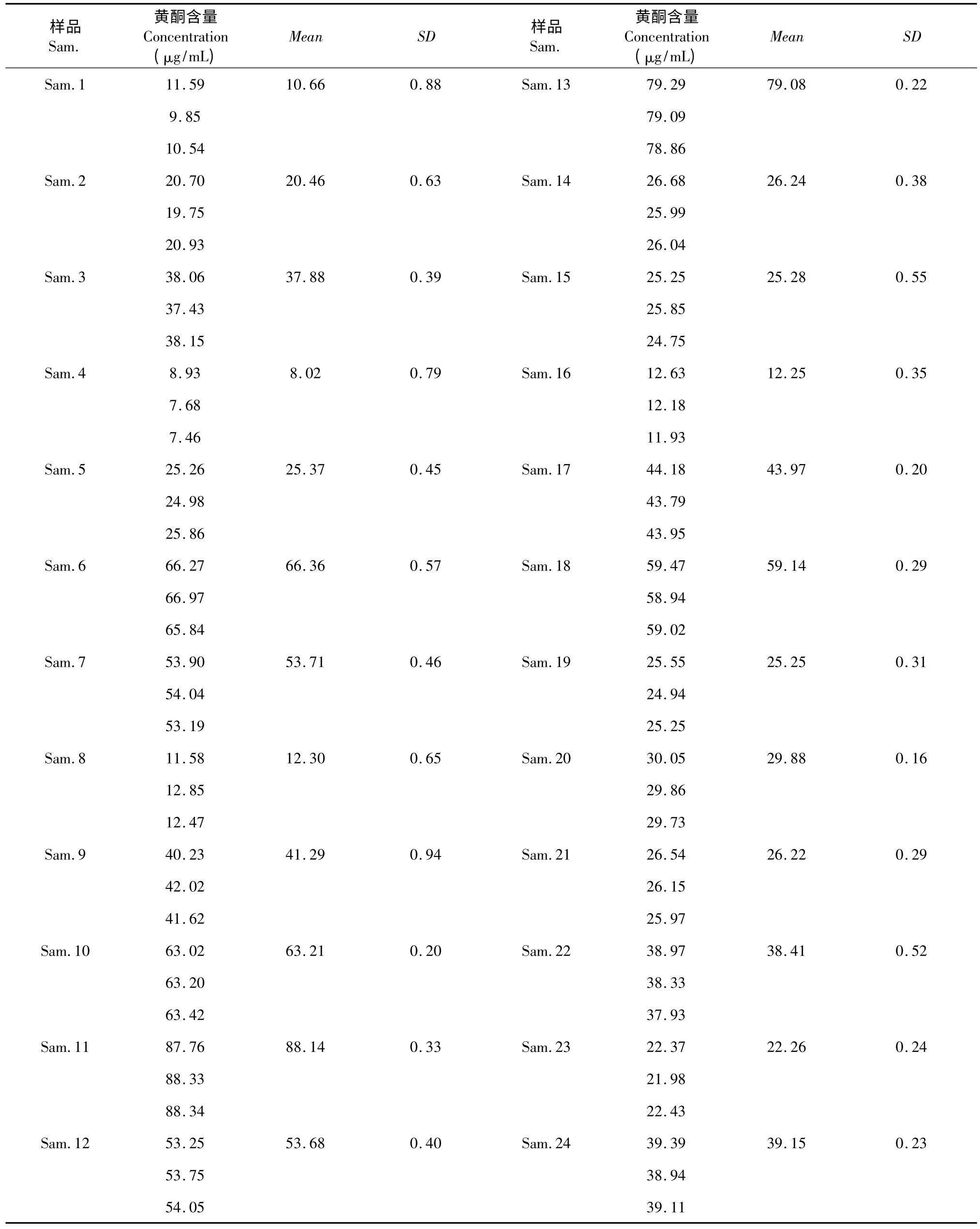
表6 高通量測定結果Table 6 High-throughput determination results
3 討論與結論
魏永生等[22]曾經對絡合分光光度法測定黃酮含量的實驗條件做過優化;于村等[23]也對保健食品中檢測總黃酮方法做過優化,但這些研究主要集中于對不同樣品的前處理方法的優化。雖然在具體操作過程中稍有不同,但改進后的測定方法都依然存在樣品消耗大,耗時,化學藥品損失大,且不適用于微量或痕量黃酮樣品以及大樣本的檢測等缺點。本實驗充分考慮了影響NaNO2-Al(NO3)3-NaOH 比色法的相關因素,并最終選擇了四個關鍵因素作為考察對象,通過L9(34)正交實驗優化了顯色條件,建立了基于使用96 微孔板,利用超微量微孔板分光光度計的總黃酮含量的高通量測定方法。該方法對大樣本黃酮含量測定的準確性、重現性、線性關系、樣品回收率均能達到科研和生產分析的要求。
實驗以桑黃發酵液的黃酮提取物為研究對象,通過L9(34)正交實驗設計優化,建立了檢測大樣本的黃酮樣品中總黃酮含量的高通量測定方法。優化后總黃酮含量測定的最佳顯色條件為5%亞硝酸鈉30 μL,10%硝酸鋁30 μL,10%氫氧化鈉50 μL,室溫反應10 min,最佳檢測波長為510 nm。
1 Ma TT (馬陶陶),Zhang QL (張群林),Li J (李俊),et al.AlCl3colorimetry for determination of total flavonoids.Lishizhen Med Mater Med Res(時珍國醫國藥),2008,19:54-56.
2 Ma R (馬銳),Wu SB (吳勝本).Research progress about pharmacological effect and mechanism of flavonoids in traditional Chinese medicine.Chin J Pharmacovigil(中國藥物警戒),2013,10:286-290.
3 Zhang Y (張巖),Cao GJ (曹國杰),Zhang Y (張燕),et al.Research on the extraction and identification of flavonoids.Food Res Dev(食品研究與開發),2008,29:154-158.
4 Chinese Pharmacopoeia Commission (國家藥典委員會).Pharmacopoeia of the People’s Republic of China (中華人民共和國藥典).Beijing:China Medical Science Press,2010.
5 Ha B (哈本).Flavonoids (黃酮類化合物).Beijing:Science Press,1983.53-70.
6 Han WJ (韓衛娟),Liang YQ (梁玉琴),Zhang JJ (張嘉嘉),et al.Review on the quantitative analysis methods of polyphenols and flavonoids in the leaf of persimmon.Chin Agric Sci Bull(中國農學通報),2014,30(31):52-56.
7 Wang Y (王勇),Zhao HY (趙海燕),Feng L (封琳),etal.Comparison and evaluation of methods for licorice flavonoids content determination.J Anhui Agric Sci(安徽農業科學),2009,37:13593-13595.
8 Moniruzzaman M,Yung AC,Rao PV,et al.Identification of phenolic acids and flavonoids in monofloral honey from bangladesh by high performance liquid chromatography:determination of antioxidant capacity.Bio Med Res Int,2014,2014.
9 Suhartono E,Viani E,Rahmadhan MA,et al.Total flavonoid and antioxidant activity of some selected medicinal plants in South Kalimantan of Indonesian.APCBEE Procedia,2012,4:235-239.
10 Silva SD,Feliciano RP,Boas LV,et al.Application of FTIRATR to Moscatel dessert wines for prediction of total phenolic and flavonoid contents and antioxidant capacity.Food Chem,2014,150:489-493.
11 Ma XK,Ruan QQ,Zhang H,et al.Developing a highthroughput microassay for large samples of fungal polysaccharides.Anal Methods,2013,17:4310-4316.
12 Chinese Veterinary Pharmacopoeia Commission (中國獸藥典委員會).Veterinary Pharmacopoeia of the People’s Republic of China (中華人民共和國獸藥典).Beijing:China Agriculture Press,2011.
13 Wu LL (吳亮亮),Shi XP (石雪萍),Zhang WM (張衛明).Study on the determination method of total flavonoids content inZanthoxylumby spectrophotometry.Sci Technol Food Ind(食品工業科技),2010,31:372-374.
14 Li N (李娜),Jiang HF (姜洪芳),Jin JH (金敬宏),et al.Total flavones content analysis ofChaenomeles speciosaby different harvest times.Food Res Dev(食品研究與開發),2011,32(2):112-114.
15 Li HL (李海龍),Liu MS (劉明生),Zhang JQ (張俊清),et al.Determination of total flavonoids inDaphniphylium calycinum.Hainan Med J(海南醫學),2012,23:106-108.
16 Ministry of Health of the People's Republic of China (中華人民共和國衛生部).Technical standards for testing & assessment of health food(2003)(保健食品檢驗與評價技術規范2003年 版).Beijing:Chinese Ministry of Health,2003.
17 Zhang XH (張夏輝).Studies on extraction of flavonoids inSpatholobus suberectusdunn and antioxidation activity of the different extract from it.Liuzhou:Guangxi University of Science and Technology (廣西科技大學),MSc.2013.
18 Liu HM (劉洪梅),Chen YT (陳玉婷),He LM (何立美),et al.Determination of total flavonoids inFengliaodecoction by UV-visible spectrophotometry.Chin Animal Husbandry Veterin Med(中國畜牧獸醫),2014,41:140-144.
19 Wu C (吳燦),Xia YB (夏延斌),Tang X (唐鑫).Spectrophotometric determination of flavonoid from lotus wine.Acade Period Farm Prod Proc(農產品加工),2013,4:48-50.
20 Guo YD (郭育東),Shan B (單斌),Liang RY (梁瑞儀).Study on the determination method of total flavonoids content inBitter Gourd.Jiangsu Agric Sci(江蘇農業科學),2009,3:317-319.
21 Liu YF (劉艷芳),Yang Y (楊焱),Jia W (賈薇),et al.Study on the determination method of total flavonoids content in medical fungiPhellinus.Acta Edulis Fungi(食 用 菌 學報),2006,13(2):45-48.
22 Wei YS (魏永生),Wang YN (王永寧),Shi YP (石玉平),et al.A study on experimental conditions in determining total flavonoids by spectrophotometry.J Qinghai Univ,Nat Sci(青海大學學報,自科版),2003,21(3):61-63.
23 Yu C (于村),Yu S (俞莎).Study on determination method of general flavone in Health Foods.Chin J Health Labor Technol(中國衛生檢驗雜志),2002,12:401-402.

