羅格列酮對肺腺癌裸鼠移植瘤化療增敏作用的實驗研究
劉新福 尹 嬋 張 輝 孫建群 莊英幟
近半個世紀以來,肺癌的發病率和病死率均迅速上升,已躍居各種惡性腫瘤的首位。其中80%以上為非小細胞肺癌,就診時65%以上的病例為Ⅲ、Ⅳ期,使得肺癌患者在診斷時能夠進行手術的不足1/4,因此化療在肺癌的綜合治療中起著重要的作用。鉑類藥物是肺癌聯合化療方案中最常用的藥物,其中順鉑在聯合化療方案中占據著重要地位。然而順鉑的耐藥性和毒副作用是化療的主要障礙,是臨床上急需解決的問題之一。化療增敏劑的應用是克服腫瘤耐藥的重要策略。我們前期研究證實羅格列酮具有一定的化療增敏作用[1]。本實驗將探討羅格列酮對人肺腺癌裸鼠移植瘤化療增敏作用,為化療增敏劑的臨床應用提供一定的實驗依據。
1 材料與方法
1.1 實驗細胞、動物及材料
人肺癌A549細胞株購自武漢大學中國典型培養物保藏中心(中國武漢市)。Balb/c-nu雌性裸小鼠28只,購于中國藥品生物制品檢定所(合格證號碼:京質字0052997),由南華大學腫瘤研究所提供SPF級飼養環境。小牛血清為杭州四季青產品,RPMI-1640為GIBCOBRL公司產品,兔抗人PPARγ、bcl-2、caspase-3多克隆抗體購于武漢博士德生物工程有限公司,光譜SP試劑盒、DAB顯色劑均購于北京中杉金橋公司。
1.2 方法
1.2.1 A549細胞培養及傳代 A549細胞用含10%新生小牛血清的RPMI-1640培養基培養,置37℃、95%濕度,且含體積分數為5%的CO2的培養箱中,每天換液1次,每2~3天傳代1次,取對數生長期細胞用于實驗。
1.2.2 建立動物模型 BalB/C-nu品系裸鼠,鼠齡為6周,體重約16~18 g,實驗和飼養均在SPF條件下的超凈工作臺中進行,培養A549肺癌細胞至對數生長期,顯微鏡下觀察,將單細胞懸液調整為細胞濃度為1×107/ml,每只裸鼠接種0.2 ml單細胞懸液于一側背部皮下,以皮下結節體積達100 mm3為成瘤標準。觀察接種后裸鼠的成瘤情況,篩選成瘤裸鼠。
1.2.3 分組給藥 將成瘤的裸鼠隨機分成7組,每組4只,Ⅰ組給予生理鹽水0.2 ml; Ⅱ組給予順鉑1 mg/kg;Ⅲ組給予順鉑4 mg/kg;Ⅳ組給予羅格列酮10 mg/kg;Ⅴ組給予羅格列酮30 mg/kg;VI組給予羅格列酮10 mg/kg+順鉑1 mg/kg;Ⅶ組給予羅格列酮30 mg/kg+順鉑1 mg/kg,接種10天后給藥,采用隔天腹腔注射方法給藥,共8次。
1.2.4 觀察指標 用藥期間,每4天用游標卡尺測量皮下移植瘤的長短徑,按通用標準公式[V(mm3)=L×W2×0.52]計算皮下移植瘤體積,于最后一次給藥后48 h脫頸臼處死各組裸鼠,剝離皮下移植瘤并稱瘤重,計算皮下移植瘤瘤重抑制率,瘤重抑制率=[1-(實驗組平均瘤重/對照組平均瘤重)]×100%,按金氏公式計算q值,以評價聯合用藥效應。q=Ea+b/(Ea+Eb-Ea×Eb),Ea+b為兩藥合用的抑制率,Ea和Eb為各藥單用的抑制率,若q<0.85說明兩藥合用有拮抗作用,若0.85
1.2.5 移植瘤組織形態學觀察 將部分移植瘤組織固定于10 %的中性福爾馬林液中 24 h 后,經脫水、常規石蠟包埋,切片。經蘇木精-伊紅(HE)染色,在光學顯微鏡下觀察組織的形態學變化。
1.2.6 免疫組化檢測相關蛋白表達 腫瘤標本用4%中性甲醛溶液固定、石蠟包埋、組織切片(5 μm),免疫組化染色檢測PPARγ、bcl-2、caspase-3的表達。采用免疫組化SP法檢測,操作步驟嚴格按照試劑盒說明書進行(皆為1∶50稀釋為工作液),用PBS緩沖液代替一抗作為陰性對照。應用Image Pro Plus 5.0專業圖像分析軟件對免疫組化結果進行定量分析,測出陽性細胞的積分光密度(integrated optical density IOD),積分光密度是陽性細胞的平均光密度與其面積的乘積,可以反映蛋白表達量(IOD值越高,其蛋白含量越高)。
1.3 統計學方法

2 結果
2.1 人肺癌A549裸鼠皮下移植瘤模型的建立
接種后第4天,可見接種部位小結節,接種后第5天,見接種部位小結節稍增大,約5 mm×5 mm大小,隨后結節逐漸增大,至第10天,約10 mm×10 mm大小。28只裸鼠全部成瘤,成瘤率達100%。
2.2 裸鼠移植瘤組織形態學觀察
移植瘤組織常規切片HE染色,光鏡下可見癌組織成片狀或彌散分布,浸潤間質,癌細胞呈圓形或橢圓形,核漿比例失調,異型性明顯,可見病理性核分裂,細胞大小不等,其間偶見腺管、腺腔樣結構,各組移植瘤組織中可見壞死細胞。
2.3 ROZ與DDP合用對人肺癌A549裸鼠移植瘤瘤體積的影響
用藥期間,每隔4天測量一次瘤體積,初始瘤體積組間比較無差異性,均衡性較好,具有可比性。經處理后各用藥組從給藥第8天后瘤體積明顯小于對照組(P<0.01),隨著給藥時間延長,差異性更明顯(P<0.001),其中30 mg/kg羅格列酮和1 mg/kg順鉑聯合組與對照組比較,差異最明顯(P<0.001)(表1)。
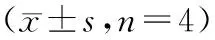
表1 ROZ與DDP合用對人肺癌裸鼠皮下移植瘤瘤體積的影響
注:*、**均為與對照組比較P<0.01,***為與對照組比較P<0.001。
2.4 ROZ與DDP合用對人肺癌A549裸鼠移植瘤瘤重的影響
實驗結束后,各用藥組瘤重明顯輕于對照組(P<0.01),DDP低劑量+ROZ 低劑量和DDP低劑量組+ROZ高劑量組抑瘤作用進一步增強,抑瘤率分別為52.11%和83.80%,q值分別為0.91和1.29,見表2。
2.5 免疫組化檢測各組移植瘤皮下腫瘤內PPARγ、bcl-2、caspase-3蛋白的表達情況
免疫組化結果顯示,PPARγ以移植瘤胞質表達為主,呈棕黃色和褐色。定量分析,羅格列酮單獨組與對照組比較,PPARγ、caspase-3表達增強,bcl-2表達下降,差異有顯著性(P<0.05),聯合用藥組與對照組比較統計學差異更顯著(P<0.01),見表3。
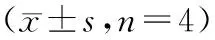
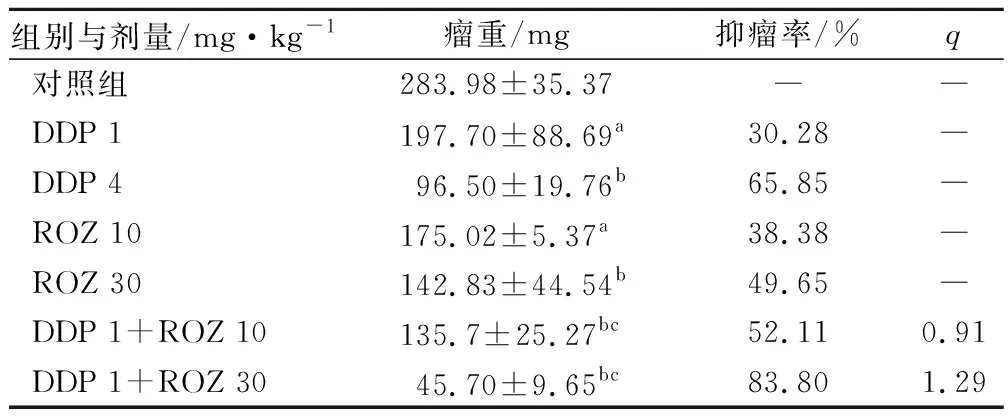
組別與劑量/mg·kg-1瘤重/mg抑瘤率/%q對照組283.98±35.37――DDP 1197.70±88.69a30.28―DDP 496.50±19.76b65.85―ROZ 10175.02±5.37a38.38―ROZ 30142.83±44.54b49.65―DDP 1+ROZ 10135.7±25.27bc52.110.91DDP 1+ROZ 3045.70±9.65bc83.801.29
注:a為與對照組比較P<0.01; b為與對照組比較P<0.001;c為與低劑量順鉑組比較,P<0.05。

表3 免疫組化檢測各組皮下腫瘤內PPARγ、bcl-2、caspase-3的表達情況
注:a為與對照組比較,P<0.05;b 為與對照組比較,P<0.001。
3 討論
過氧化物酶體增殖因子活化受體(peroxisome proliferator-activated receptors, PPARs)是屬于核激素受體超家族的新成員,1990 年首次由英國科學家Issemann和Green從小鼠肝克隆成功,目前鑒別出3個亞型(α、β、γ),它們在結構、功能及組織分布上均有差異,其中生物學功能最復雜和研究最多的是 PPARγ。PPARγ在許多惡性腫瘤(如脂肪肉瘤、肺癌、結腸癌、前列腺癌)中呈高度表達。近年來研究表明,經配體激活后PPARγ參與脂肪細胞分化、調控細胞周期、抑制炎癥反應、誘導腫瘤細胞分化和凋亡等作用[2-3]。羅格列酮是PPARγ人工合成配體。近年來研究發現PPARγ配體羅格列酮具有抑制腫瘤細胞生長、誘導凋亡的作用[4-6],而且羅格列酮可逆轉腫瘤細胞對化療的耐藥性[7]。本實驗研究結果顯示:羅格列酮和順鉑用藥組均對移植瘤腫瘤細胞的生長有明顯的抑制作用,順鉑1 mg/kg組加用不同劑量的羅格列酮后瘤重和瘤體積均低于順鉑1 mg/kg單用組,加用羅格列酮劑量越高,瘤重和瘤體積越低,瘤重抑制率越大,呈現一定的劑量相關性。兩藥聯合用藥效果評價,30 mg/kg羅格列酮與1 mg/kg順鉑聯合組q值大于1.15,說明羅格列酮與順鉑有協同抗腫瘤效應,即羅格列酮具有化療增敏效應。而10 mg/kg羅格列酮與1 mg/kg順鉑聯合組q值等于0.91,說明兩藥合用有相加作用,這表明兩者聯合應用的效果跟羅格列酮的劑量有關。這為臨床上選擇藥物劑量,發揮較好療效提供了實驗基礎。
本實驗所選用的動物為常用的、穩定的實驗腫瘤動物Balb/c-nu雌性裸鼠,它是1種無胸腺的先天性 T 細胞免疫缺陷動物,將A549細胞分別接種到裸鼠后,裸鼠成瘤率高,達到100%(28/28),這與國內文獻報道的相一致[8]。移植瘤的大體形狀多為圓形或多邊形,與周圍組織分界清楚;鏡下觀察移植瘤組織切片發現 A549移植瘤細胞的形態沒有發生改變,說明本實驗建立的動物模型是成功的,可用于本實驗研究,因為直接采用人體腫瘤接種于動物模型,使實驗結果更為可靠,大大提高其與臨床的符合率。
Bcl-2是1種較為肯定的抗細胞凋亡基因,可抑制腫瘤細胞凋亡。近來有很多報道表明,caspase蛋白酶家族在凋亡過程中起著關鍵作用。其中caspase-3的激活是多種刺激引起凋亡的匯集點。在腫瘤細胞中caspase-3激活或表達升高可引起腫瘤的生長抑制以及抑制腫瘤的侵襲、轉移和演進過程。Kang等報道[9],PPARs配體環格列酮、曲格列酮和15-脫氧-前列腺素J2(15d-PGJ2)通過誘導凋亡而呈劑量依賴方式抑制黑素細胞的生長,Western blot 分析環格列酮處理的黑素細胞組caspase-3表達呈時間依賴方式上調,而抗凋亡bcl-2表達卻呈時間依賴方式下調。Liu等[10]以15d-PGJ2和TGZs處理人白血病U937 和 Mono Mac 6 2種細胞,也得到了相同的結果。本實驗通過免疫組化證實PPARγ在人肺腺癌裸鼠移植瘤中呈現高表達,低、高劑量羅格列酮組和聯合用藥組較對照組比較,PPARγ、caspase-3的表達明顯上調,而bcl-2的表達呈現下調。低、高劑量羅格列酮與低劑量順鉑組合用后,該調節作用較單獨使用組明顯增強,并呈現一定的劑量依賴關系,提示羅格列酮與順鉑聯合應用具有協同增效作用,其機制可能是羅格列酮激活了PPARγ受體,抑制bcl-2表達,激活caspase-3途徑誘導腫瘤細胞凋亡,提示PPARγ人工合成配體羅格列酮有望成為1種非小細胞肺癌治療的化療增敏劑。
[1] 劉新福,莊英幟,曹建國,等.羅格列酮增強順鉑對肺腺癌裸鼠移植瘤生長的抑制作用〔J〕.中國藥理學通報,2007,23(12):1667-1671.
[2] Hojka A,Rapak A.Peroxisome proliferator-activated receptors (PPAR).Antiproliferative properties〔J〕.Postepy Hig Med Dosw(online),2011,65:404-413.
[3] Bloch O,Sughrue ME,Mills SA,et al.Signaling pathways in cranial chondrosarcoma: potential molecular targets for directed chemotherapy〔J〕.J Clin Neurosci,2011,18(7):881-885.
[4] Gottfried E,Rogenhofer S,Waibel H,et al.Pioglitazone m- odulates tumor cell metabolism and proliferation in multicellular tumor spheroids〔J〕.Cancer Chemother Pharmacol,2011,67(1):117- 126.
[5] Toaldo C,Pizzimenti S,Cerbone A,et al.PPARgamma ligands inhibit telomerase activity and hTERT expression through modulation of the Myc/Mad/Max network in colon cancer cells〔J〕.J Cell Mol Med,2010,14(6A):1347-1357.
[6] Cimen I,Astarci E,Banerjee S.15-lipoxygenase-1 exerts its tumor suppressive role by inhibiting nuclear factor-kappa B via activation of PPAR gamma〔J〕.J Cell Biochem,2011, 112(9):2490-2501.
[7] 胡劍鋒,張 琍.羅格列酮逆轉絲裂霉素對人胃癌SGC7901/VCR細胞株耐藥的作用〔J〕.實用癌癥雜志,2013,28(1):1-4.
[8] 黃 宏,張珍祥,徐永健,等.制滴菌素A治療人肺腺癌細胞A549裸鼠移植瘤的實驗研究〔J〕.華中科技大學學報(醫學版),2003,32(4):403-405.
[9] Kang HY,Lee JY,Lee JS,et al.Peroxisome proliferator-activated receptors-gamma activator,ciglitazone,inhibits human melanocyte growth through induction of apoptosis〔J〕.Arch Dermatol Res,2006,297(10):472-476.
[10] Liu JJ,Liu PQ,Lin DJ,et al.Downregulation of cyclooxygenase-2 expression and activation of caspase-3 are involved in peroxisome proliferator-activated receptor-gamma agonists induced apoptosis in human monocyte leukemia cells in vitro〔J〕.Ann Hematol,2007,86(3):173-183.

