熱化療治療老年口腔頜面部惡性腫瘤的效果分析
劉 宇 羅治彬 鄧 悅
老年人患有口腔頜面部惡性腫瘤,常常由于身體健康因素的限制而放棄手術治療,而單純地進行化療,其效果也不很理想[1-2]。目前熱化療效果已經被大量臨床試驗證實,其可以有效殺滅腫瘤細胞,同時增強患者的免疫功能,減少腫瘤復發和轉移,進而提高患者生存質量[3]。T 淋巴細胞亞群作為人體免疫系統中的一個極其重要的細胞群,數量直接影響到腫瘤發生、發展以及治療的效果。因此本研究分析熱化療對老年口腔頜面部惡性腫瘤患者的近期療效以及對T 淋巴細胞亞群所產生的影響。
1 資料與方法
1.1 一般資料
60例老年口腔頜面部惡性腫瘤患者,隨機分成熱化療組(n=31)和常規化療組(n=29)。熱化療組男性20例,女性11例,年齡62~77歲,平均年齡(68.5±5.0)歲。常規化療組男性16例,女性13例,年齡63~76歲,平均年齡(69.7±4.8)歲。60例患者均有明確的病理診斷,入選標準:患者化療前肝功能、腎功能、血像及心電圖均基本正常,均無化療禁忌證,均簽署知情同意書。TNM 分期為Ⅱ~Ⅳ期,所有患者未進行過任何的治療。2組患者的一般資料無顯著差異,具有可比性,P>0.05。
1.2 方法
常規化療方案:惡性淋巴瘤采用標準COP或CHOP方案;腺癌及鱗癌用順鉑+5-氟尿嘧啶方案,5-氟尿嘧啶320 mg·m-2· d-1,DDP 5 mg·m-2· d-1;其他類型惡性腫瘤則按通用標準進行,28天為1個周期,進行5~6個周期。熱化療方案:在全身化療的同時給予局部的超聲熱化療,溫度40~42 ℃,每次時間40 min,隔日1次,總計5次,28天為1個周期,進行5~6個周期。
1.3 評價指標
按照世界衛生組織確定的實體瘤雙徑測量方法作為療效的評價標準。在第一次治療前和1個療程內的最后1 次治療之后取患者靜脈血6 ml,測定其血液T-LS。
1.4 統計學方法
數據采用SPSS 18.0軟件進行統計學分析。計量資料之間的比較使用t檢驗,計數資料比較使用卡方檢驗,若P<0.05則差異具有統計學意義。
2 結果
2.1 2組患者淋巴細胞亞群的變化
熱化療組在治療前后CD4+和CD4+/CD8+的比值差異具有統計學意義(P<0.05),而CD8+數值差異則無統計學意義。常規化療組患者治療前后CD4+和CD8+值以及CD4+/CD8+比較,差異均無統計學意義(P>0.05)。見表1。
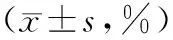
表1 2組患者治療前后CD4+和CD8+值以及CD4+/CD8+比較
注:a為與治療前相比具有統計學差異,與常規化療組相比具有統計學差異,P<0.05。
2.2 2組療效比較
經過3 個周期治療,對治療療效進行評價。熱化療組和常規化療組的有效率分別為51.61%和20.69%,熱化療組的有效率明顯高于常規化療組(P<0.05)。見表2。

表2 熱化療組和常規化療組的療效比較(例,%)
2.3 2組患者的不良反應比較
常規化療組與熱化療組的神經毒性反應例數分別為3例和4例,消化系統反應例數分別為8例和9例,肝腎功能異常例數均為3例,骨髓抑制分別為7例和8例,熱化療組未發現與化療相關之外的不良反應,同時在治療之后均得到了糾正。2組不良反應比較,差異均無統計學意義,P>0.05。
3 討論
老年口腔頜面部惡性腫瘤患者,常常由于身體狀況放棄手術的機會。經研究表明,頭頸部的惡性腫瘤整體化療的效果不是很好,晚期效果則更差[4]。超聲波為目前發展極快、極其有希望的一項加熱技術,目前各國都在研究相關技術以及設備,以試圖占領該領域醫療設備的優先市場,且有的已經有了應用到臨床的相關經驗報道,但是尚無用于表淺的和較小腫瘤的超聲加熱設備。超聲波具有穿透力強、指向性好、無電磁輻射等優點[5]。熱化療是通過使用局部加溫的方法來提高局部的溫度,增加癌細胞的流動性,破壞其膜結構和功能,增加通透性,使得更多的藥物進入細胞,延長細胞內藥物的蓄積時間,增加相應藥效[6-8];晚期癌痛不同程度對晚期惡性腫瘤患者飲食、睡眠以及精神狀態產生影響,嚴重降低了晚期腫瘤患者的生存質量,甚至藥物鎮痛仍不能緩解[9-11]。本研究分析熱化療對老年口腔頜面部惡性腫瘤患者的近期療效以及對T 淋巴細胞亞群所產生的影響。結果顯示,熱化療組在治療前后CD4+和CD4+/CD8+的比值差異具有統計學意義(P<0.05),而CD8+數值差異則無統計學意義。常規化療組患者治療前后CD4+和CD8+值以及CD4+/CD8+比較差異均無統計學意義(P>0.05)。超聲熱化療組的有效率為51.61%(16/31),常規化療組有效率為20.69%(6/29),2組比較差異具有統計學意義(P<0.05)。本研究發現,當局部溫度增加至42 ℃左右,藥物的反應繼續加快,癌細胞靶結構對藥物的敏感性有所提高;同時熱化療能降低腫瘤中的乏氧細胞比例,抑制了藥物損傷的腫瘤自我修復的過程,防止或減少了腫瘤細胞耐藥性的產生。與此同時,熱療對腫瘤細胞,尤其是乏氧細胞有直接的殺傷效果,而對正常的組織細胞則不會產生損傷。同時,熱化療對于晚期腫瘤姑息治療的作用也同樣不可忽視,尤其對癌痛具有一定緩解作用。
綜上所述,熱化療可以顯著提高化療有效率,且安全、可行,未見有相關嚴重的不良反應,適合在臨床推廣應用。
[1] Xiao Z,Ji C,Shi J,et al.DNA self-assembly of targeted near-infrared-responsive gold nanoparticles for cancer thermo-chemotherapy〔J〕.Angew Chem Int Ed Engl,2012,51(47):11853-11857.
[2] Wang S,Mahesh SP,Liu J,et al.Focused ultrasound facilitated thermo-chemotherapy for targeted retinoblastoma treatment:a modeling study〔J〕.Exp Eye Res,2012,100:17-25.
[3] Pradhan P,Giri J,Rieken F,et al.Targeted temperature se-
nsitive magnetic liposomes for thermo-chemotherapy〔J〕.J Control Release,2010,142(1):108-121.
[4] Nativ O,Witjes JA,Hendricksen K,et al.Combined thermo-chemotherapy for recurrent bladder cancer after bacillus Calmette-Guerin〔J〕.J Urol,2009,182(4):1313-1317.
[5] Bor R,Fábián A,Farkas K,et al.The role of endoscopic ultrasonography in the diagnosis of rectal cancers〔J〕.Orv Hetil,2013,154(34):1337-1344.
[6] 李雯欽,潘月慧,和來芳,等.健康教育對口腔頜面部惡性腫瘤患者生活質量的影響〔J〕.護理實踐與研究,2010,7(2):117-118.
[7] 賀 雪.口腔頜面部惡性腫瘤手術患者健康教育難點與對策〔J〕.當代醫學,2010,16(28):117.
[8] 鄭 海,湯 煒.口腔頜面部惡性腫瘤化療途徑的研究進展〔J〕.重慶醫學,2011,40(12):1233-1235.
[9] 蔣榮莉,孟慶威,蔡 莉.低強度超聲化療增敏作用的研究進展〔J〕.臨床腫瘤學雜志,2012,17(12):1146-1148.
[10] 何玉琴,王 華.惡性腫瘤患者熱化療的護理〔J〕.按摩與康復醫學,2012,3(33):325.
[11] 王 麗,薛 剛,程言強,等.腫瘤術后全身熱化療病人深度鎮靜麻醉管理〔J〕.醫學理論與實踐,2012,25(23):2879-2880.

