腦創傷后依達拉奉聯合單唾液酸四己糖神經節苷脂對大鼠神經行為學影響的近期觀察
尹立國,王金林,張中原,徐興華,龍海成
(1.遵化市人民醫院神經外科,河北唐山064200;2.唐山市工人醫院神經外科,河北唐山063000)
腦創傷后依達拉奉聯合單唾液酸四己糖神經節苷脂對大鼠神經行為學影響的近期觀察
尹立國1,王金林2,張中原1,徐興華1,龍海成1
(1.遵化市人民醫院神經外科,河北唐山064200;2.唐山市工人醫院神經外科,河北唐山063000)
創傷性腦損傷(Traumatic brain injury,TBI)有較高發生率,是導致創傷病人傷殘及死亡的主要原因,嚴重危害人類健康,給社會和家庭帶來沉重負擔。創傷后如何更好保存患者神經功能是臨床工作者和基礎研究工作者面臨的重大課題。線粒體和細胞膜在腦創傷后神經細胞恢復過程中揮重要作用,本研究運用改進的Marmarou方法建立大鼠彌漫性腦損傷模型,以依達拉奉(Edaravone)和單唾液酸四己糖神經節苷脂(GM-1)進行治療干預,證明其神經保護的重要作用。
1 材料與方法
1.1 腦創傷模型的制備與分組
雄性成年SD大鼠110只(體重300-350g,購自北京維通力華公司,清潔級,自然光照,環境安靜,溫度適中,大鼠自由進食水,飼養1周后進行實驗),隨機分為實驗對照組、顱腦創傷組、依達拉奉治療組(Edaravone組)、單唾液酸四己糖神經節苷脂治療組(GM-1組)、依達拉奉聯合單唾液酸四己糖神經節苷脂治療組(聯合治療組)。每組設傷后1h、6h、24h、48h、72h5個時相點。對照組每個時相點2只大鼠,創傷組和依達拉奉干預組、單唾液酸四己糖神經節苷脂治療組、依達拉奉聯合單唾液酸四己糖神經節苷脂治療組每時相點5只大鼠。動物置乙醚麻醉缸中,以乙醚吸入方式深度麻醉動物,麻醉后的大鼠俯臥于落體致傷海綿墊上,70%酒精消毒顱頂部皮膚,沿正中線矢狀切開頭皮,剝離骨膜,顯露人字縫與冠狀縫,將一不銹鋼墊固定在大鼠冠狀縫與人字縫之間將大鼠頭部固定于打擊模型架下的頭部固定裝置中,重450g,直徑18mm的銅柱沿垂直玻璃管于1.2m高度自由落下,撞擊大鼠顱骨頂部的鋼墊,造成大鼠中度彌漫性顱腦損傷。撞擊后即刻移開大鼠,以免銅柱反彈造成頭部二次打擊傷。給予顱腦損傷后大鼠,頭皮切口常規消毒、縫合。對照組僅給予相同的麻醉處理及沿中線矢狀切開頭皮、剝離骨膜、在冠狀縫與人字縫之間粘鋼墊,置致傷海綿墊上,但不行自由落體致傷,而后常規消毒、縫合切口。各組未到規定時相死亡的大鼠予以剔除(創傷組6h時相點、48h時相點、依達拉奉24h時相點、單唾液酸四己糖神經節苷脂治療組6h時相點、依達拉奉聯合單唾液酸四己糖神經節苷脂治療組48h時相點各一只)。
1.2 給藥方法
Edaravone治療組給予Edaravone 10mg/kg,單唾液酸四己糖神經節苷脂治療組給予單唾液酸四己糖神經節苷脂10mg/kg。對照組、顱腦損傷(TBI)組給予等量生理鹽水。注射方法為傷后10 min,尾靜脈注射,每24h注射1次。
1.3 細胞色素c檢測
標本甲醛固定,石蠟切片,按武漢博士德提供細胞色素c檢測試劑盒說明書方法進行檢測。
1.4 原位細胞凋亡檢測(TUNEL法)
按Roche公司提供TUNEL檢測試劑盒進行操作。
1.5 神經行為學檢測
取進行免疫組化組大鼠72h時相點,大鼠進行麻醉處死前進行檢測。根據Rancan等[1]設計的3種感覺運動功能測試方法來評價動物DBI后神經生理功能的缺陷程度,每項重復3次,滿分24分。
1.6 陽性細胞免疫反應強弱結果分析
采用Motic Med 6.0計算機真彩色圖象分析系統以平均光密度進行半定量分析。
1.7統計學處理
實驗數據用SPSS11.5進行統計學處理。計量資料以均數±標準差(ˉx±s)表示,多組間同一時間點及同一組中不同時間點比較采用單因素方差分析,P<0.05為差異有統計學意義。
2 結果
2.1 創傷組Ctyc免疫反應在傷后6h即升高,傷后24h達高峰,以后迅速下降,Edaravone治療組、單唾液酸四己糖神經節苷脂治療組、依達拉奉聯合單唾液酸四己糖神經節苷脂治療組與創傷組比較明顯降低,在24h、48h、72h差異顯著(P<0.01,表1)。
2.2 傷后1小時即可見少量凋亡細胞,以后凋亡細胞數逐漸增多,并于48h達高峰,Edaravone、單唾液酸四己糖神經節苷脂、依達拉奉聯合單唾液酸四己糖神經節苷脂明顯降低腦創傷后大鼠大腦皮質神經細胞凋亡數,與創傷組比較在24h、48h、72h有顯著性差異(P<0.01,表2)。
2.3 Edaravone、單唾液酸四己糖神經節苷脂及依達拉奉聯合單唾液酸四己糖神經節苷脂干預后,DBI后72h大鼠的神經生理功能的缺陷程度明顯改善(P<0.01,表3)。)

表1 大腦創傷后大腦皮質cyt-c表達動態變化(ˉx±s)
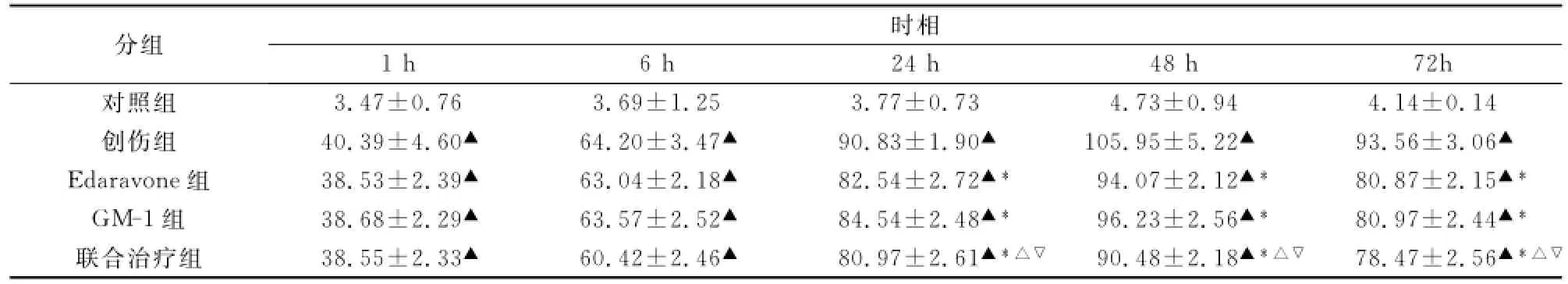
表2 大鼠腦創傷后大腦皮質神經凋亡數的動態變化(ˉx±s)

表3 腦創傷后3天各組神經行為學評分比較(ˉx±s,n=22
3 討論
機體在生理狀態下,自由基產生與清除間保持著動態平衡[2-4]。腦創傷后,線粒體在導致組織損傷的分子事件中作用至關重要[5]。由于顱內壓增高,血管痙攣及呼吸紊亂等,產生能量代謝障礙,由線粒體呼吸鏈和胞漿酶系(如黃嘌呤氧化酶)產生大量自由基,導致氧化應激。近年來Crompton[6]論述了ROS的形成增多導致線粒體膜通透性轉換孔(PTP)開放。PTP開放后可導致細胞壞死和凋亡[6-9]。Lewen A[10]等也認為TBI后氧自由基產生增加可以導致線粒體功能紊亂,增加的氧自由基與鈣離子相互作用導致線粒體膜滲透性轉換孔開放,細胞色素c(Cytc)從損壞的線粒體釋放,通過caspase依賴方式,誘導細胞凋亡。
神經節苷脂是一種酸性鞘糖脂,廣泛存在于脊椎動物細胞膜、神經組織等結構中,其主要活性成分是GM-1。在缺血、缺氧的病理過程中,腦內GM-1含量下降[11]。因此腦損傷后補充外源性神經節苷脂對維持細胞膜結構和功能的完整性極其重要。Edaravone(3-methyl-1-phenyl-2-pyrazolin-5-one)是近年來開發上市的新型腦保護劑和自由基清除劑。一項關于心肌缺血再灌注的實驗證明Edaravone能作用于線粒體膜通透性轉換孔(MPTP),能減少心肌細胞凋亡以及減輕線粒體的腫脹程度[12]。本研究應用Marmarou腦創傷模型,在我們的實驗結果中,Edaravone和GM-1均能降低由線粒體釋放的Cytc的表達并減少腦創傷后的神經細胞凋亡數量,達到其腦保護的作用,聯合組效果更為顯著。其可能的作用機制為:依達拉奉減少自由基生成,起到了保護神經細胞膜完整性作用,有利于GM-1嵌入神經細胞膜,GM-1嵌入神經細胞膜后恢復Na+-K-ATP酶、Ca2+-Mg2+ATP酶活性,防止鈣超載,改善線粒體功能及受損細胞的能量代謝,對多種炎性因子及細胞因子的表達起其調控作用,對依達拉奉起正反饋作用[13]。本研究經Edaravone和GM-1干預后,DBI后72h大鼠的神經生理功能的缺陷程度明顯改善,聯合應用Edaravone和GM-1治療效果更為明顯。說明Edaravone和GM-1腦創傷后繼發性損傷調節中發揮著協同保護神經細胞的重要作用。腦創傷后聯合應用Edaravone和GM-1進行神經保護值得臨床推廣應用。
[1]Rancan M,Otto VI,Hans VH,et al.Upregulation of ICAM-1and MIP-1but not of MIP-2and sensorimotor deficit in response to traumatic axonal injury in rats[J].J Neurosic Res,2001,63(5):438.
[2]Chan Ph.Role of oxidants in ishemic brain damage[J].Stroke, 1996,27:1124.
[3]Cadenas E,Davie KJ.Mitochondrial free radical generatioin,oxidative stress,and aging[J].Free radic Biol Med,2000,29:222.
[4]Motoori S,Majima HJ,Ebara M,et al.Overexpression of mitochondrial manganese superoxide dismutase protects against radidatior induced cell death in human hepatocellular carcinoma cell line HEL[J].Cancer Res,2001,61:151.
[5]Morin D,Hauet T,Spedding M,et al.Mitochondria as target for antiischemic drugs[J].Adv Drug Delivery Res,2001,49:151.
[6]Crompton M.The mitochondrial permeability transition pore and its role in cell death[J].Bio chem J,1999,341:233.
[7]Halestrap AP.The mitochondrial perbmeability transition:its molecular mechanism and role in reperfusion injury[J].Biochem Soc Symp 1999,66:181.
[8]Halestrap AP,Kerr PM,Javadov S,et al.Eluciting the molecular mechanism of the heart[J].Biophys Acta,1998,1366:79.
[9]Zoratti M,Szabo I.The mitochondrial permeability transition[J].Biochim Biophys Acta,1995,1241:139.
[10]Lenwen A,Fujimura M,Sugawara T,et al.Oxidative stress-depend release of mitochondrial cytochorome c after traumatic brain injury[J].Cereb Blood Flow Metab,2001,21:914.
[11]Remirez M R,Muraro F,Zylbersztejn DS,et al.Neonatal hypoxia ischemia reduses ganglisoside,phospholipids and cholesterol contents in the rat hippocampus[J].Neurosci Res,2003,46(3):339.
[12]Katare Gopalrao Rajesh,Shiro Sasaguri,Ryoko Suzuki,et al.Antioxidant MCI-186inhibits mitochondrial permeability transition pore and upregulates Bcl-2expression[J].Am J Physiol Heart Circ Physiol,2003,285:H2171.
[13]SuzukiT,Kazui T,Yamamoto S,et al.Effect of prophylactically administered edaravone during antegrade cerebral perfusion in a caninemodel of old cerebral infarction[J].Thorac Cardiovasc Surg,2007,133(3):710.
尹立國(1973-),男,主治醫師,碩士研究生,主要從事顱腦創傷與腦血管病研究。
2013-11-19)
1007-4287(2014)10-1594-03

