探針熔解曲線技術檢測結核桿菌耐藥的研究
孫炳奇* 張 娟孫 嬌張 婷
(1 沈陽市胸科醫院結核病實驗室,遼寧 沈陽 110044;2 廈門大學生命科學學院,福建 廈門 361102)
探針熔解曲線技術檢測結核桿菌耐藥的研究
孫炳奇1* 張 娟1孫 嬌1張 婷2
(1 沈陽市胸科醫院結核病實驗室,遼寧 沈陽 110044;2 廈門大學生命科學學院,福建 廈門 361102)
目的評價探針熔解曲線技術檢測結核桿菌耐藥效果。方法利用探針熔解曲線技術對46例涂陽肺結核患者的痰標本進行異煙肼和利福平耐藥檢測,以傳統羅氏藥敏試驗為金標準,對探針熔解曲線技術的檢測效果進行評價。結果在46例菌株中,用探針熔解曲線進行異煙肼耐藥基因檢測,與羅氏藥敏的符合率為91.3%,進行利福平耐藥基因檢測,符合率為84.8%。結論探針熔解曲線檢測異煙肼和利福平的耐藥性與羅氏藥敏方法具有很好的一致性,具有簡便快速,靈敏度高,特異性好的優點,對臨床及時準確進行抗結核治療具有重要意義。
探針熔解曲線;異煙肼;利福平;耐藥
本研究采用探針熔解曲線技術分別檢測異煙肼(isoniazid,INH)和利福平(rifampicin,RFP)的耐藥情況,并與傳統羅氏培養進行對比,探討其在藥敏檢測中的臨床應用價值。
1 材料與方法
1.1 樣本與試劑
選取羅氏培養生長陽性菌株46例,包括11例INH和RPF均敏感菌株,21例耐多藥菌株,5例單耐INH和9例單耐RFP菌株。Bio-Rad CFX96實時PCR擴增儀(美國伯樂),結核分枝桿菌異煙肼耐藥突變檢測試劑盒(熒光PCR熔解曲線法)和結核分枝桿菌利福平耐藥突變檢測試劑盒(熒光PCR熔解曲線法)均為廈門致善生物科技有限公司產品[1]。
1.2 羅氏藥敏試驗
通過觀察改良羅氏培養基上結核分枝桿菌菌落的生長速度、色澤等生物學性狀,選取適當的菌落,按照《結核病診斷實驗室檢驗規程》[2],挑取培養基上菌落,用無菌0.5% TWEEN80生理鹽水溶解、稀釋。與標準麥氏比濁管比濁,即制成1 mg/mL菌懸液,10倍稀釋至10-2mg/mL,用滅菌吸管準確吸取0.1 mL菌液分別接種至對照及含藥培養基斜面,每管接種量為10-3mg。異煙肼和利福平藥物濃度分低高兩種濃度,分別是0.2、1 μg/mL;50、250 μg/mL。
1.3 樣本制備及核酸提取
取羅氏培養基上生長的結核分枝桿菌,用22SWG標準接種環收集細菌1環,并懸在250 μL結核桿菌DNA提取液中。封口膜封口,99 ℃加熱20 min,14000 rpm離心10 min,轉移上清到新的1.5 mL離心管,上清即為DNA模板。
1.4 探針熔解曲線技術檢測樣本
取DNA模板進行PCR反應,利福平組反應參數為UNG 處理50 ℃ 2 min,1個循環;預變性95 ℃ 10 min,1個循環;95 ℃ 15 s,70 ℃ 20 s(每個循環下降1 ℃),76 ℃ 25 s,13個循環;95 ℃ 15 s,57 ℃ 20 s,76 ℃ 25 s,42個循環。熔解分析程序:95 ℃ 2 min,40 ℃ 2 min,45~85 ℃(設置在此階段每1 ℃采集FAM和TET通道熒光信號),1個循環。
異煙肼組反應參數為UNG 處理50 ℃ 2 min,1個循環;預變性95 ℃ 5 min,1個循環;95 ℃ 10 s,71 ℃ 25 s(每個循環下降1 ℃),75 ℃30 s,10個循環;95 ℃ 10 s,61 ℃ 25 s,75 ℃ 25 s,45個循環。熔解分析程序:95 ℃ 2 min,40 ℃ 2 min,40~80 ℃(設置在此階段每1 ℃采集FAM和TET通道熒光信號),1個循環。
1.5 與羅氏藥敏結果不符的標本均進行測序驗證,測序引物分別為INH-ahpC-seq-F:5'-CTTGCCGGAAAGACATGCC-3',INH-ahpC-seq-R:5'-CGTCA CTGGTGATAGTGGTGA-3';INH-inhA-seq-F:5'-AGCGCGACATACCTGCTG-3',INH-inhA-seq-R:5'-CCGATCCCCCGGTTTCC-3';INH-inhA94-seq-F:5'-CGTTTC ACATCGCACGGG-3',INH-inhA94-seq-R:5'-GGCTCGGGTCGAAGTCC-3';INH-katG-seq-F:5'-CGAGACGTTTCGGCGC-3',INH-katG-seq-R:5'-CCGTCCTT GGCGGTGT-3';RFP-seq-F:5'-CGGGAGCGGATGACCAC-3',RFP-seq-R:5'-GCG GTACGGCGTTTCGAT-3'。測序由上海美吉生物醫藥科技有限公司完成。
1.6 統計學分析
實驗數據采用SPSS13.0軟件進行統計分析,以絕對濃度法檢測結果為判斷標準,計算高分辨率探針熔解曲線法的敏感度和特異度,兩種方法檢測結果的差異性卡方檢驗判別,兩種方法檢測結果的一致性用Kappa檢驗判別。
2 結 果
2.1 探針熔解曲線技術藥物敏感性的檢測結果
對INH檢測的46例菌株中,探針熔解曲線技術藥物敏感試驗結果與羅氏藥物敏感試驗結果無統計學顯著性差異(P>0.05)。耐藥42例與羅氏藥敏結果相符,總符合率為91.3%,Kappa值為0.825,敏感度和特異度分別是88.5%和95.0%;46例對RFP檢測結果中,探針熔解曲線技術藥物敏感試驗結果與羅氏藥物敏感試驗結果亦無統計學顯著性差異(P>0.05)。39例與羅氏結果相符,總符合率為84.8%,Kappa值為0.680,敏感度和特異度分別是80.0%和93.8%,見表1和表2。
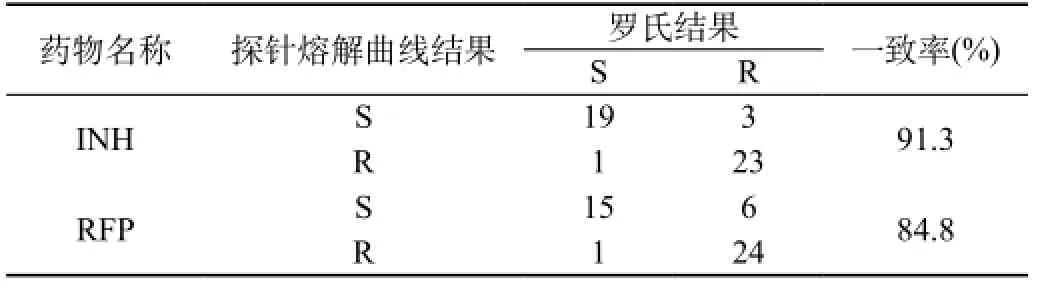
表1 探針熔解曲線對異煙肼和利福平藥物敏感性檢測結果
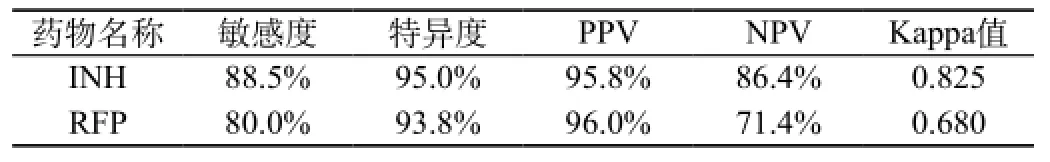
表2 探針熔解曲線技術檢測耐藥的敏感度、特異度、陽性預測值、陰性預測值和Kappa值
2.2 探針熔解曲線法與測序結果
對INH檢測的46例菌株中,4例與結核分枝桿菌耐藥檢測的“金標準”羅氏藥敏結果不相符。基因檢測的“金標準”為測序法,將該4例樣本的PCR產物進行測序。2例樣本的羅氏藥敏結果為耐藥,探針熔解曲線結果為敏感,測序結果為野生型。1例樣本的羅氏藥敏結果為敏感,探針熔解曲線結果為耐藥,測序結果為katG 315AGC>GGC。1例樣本的羅氏藥敏結果為耐藥(高濃度耐藥),探針熔解曲線為敏感,測序結果為野生型與ahpC啟動子區-10C>T混合,即不均一耐藥樣本導致探針熔解曲線結果判讀失誤。ahpC啟動子區-10 C>T的不均一耐藥相對不易判讀,需要依據經驗結合峰型進行判讀。
對RFP檢測的46例菌株中,7例與結核分枝桿菌耐藥檢測的“金標準”羅氏藥敏結果不相符。基因檢測的“金標準”為測序法,將該7例樣本的PCR產物進行測序。6例樣本的羅氏藥敏結果為耐藥,探針熔解曲線結果為敏感,測序結果為野生型。1例樣本的羅氏藥敏結果為敏感,探針熔解曲線結果為耐藥,測序結果為rpoB 531 TCGTTG。
測序結果與探針熔解曲線的結果相比,除1份不均一耐藥樣本探針熔解曲線未成功判讀外,結果均一致。
3 討 論
近年來,結核分枝桿菌耐藥性呈逐年上升趨勢,異煙肼和利福平作為抗結核一線藥物,其耐藥性檢測對于臨床結核病藥物治療具有重要意義。本研究將其用于異煙肼和利福平耐藥檢測,結果顯示與羅氏培養結果的符合率分別為91.3%和84.8%,敏感度為88.5%和80.0%,特異度為95.0%和93.8%,陽性預測值為95.8%和96.0%,Kappa值為0.825
和0.680(Kappa值>0.81一般表示二者之間具有非常好的一致性,0.61~0.81之間則認為有較好的一致性,<0.4則代表兩試驗方法間一致性較差)。與羅氏藥敏實驗結果不一致樣本經測序后證明,除1份不均一耐藥樣本探針熔解曲線未成功判讀外,其余樣本的探針熔解曲線結果與測序結果均完全一致。與傳統藥敏試驗相比,探針熔解曲線檢測技術在應用于結核分枝桿菌耐藥的快速檢測時有較高的陽性檢出能力,有著良好的特異度和靈敏度,同時更加簡便、快速。
[1] 中國防癆協會基礎專業委員會《結核病診斷實驗室檢驗規程》[M].北京:中國教育文化出版社,2006:56-57.
[2] 張立群,王云霞,周敏,等.4種不同結核分枝桿菌檢測方法對結核病的診斷價值比較[J].中華醫院感染學雜志,2010,20(11):1633-1635.
R521
B
1671-8194(2014)13-0076-02
沈陽市科技計劃項目(F12-255-1-00)
*通訊作者:E-mail:sunbq2004@163.com

