二甲雙胍在子宮內膜癌細胞中增強紫杉醇的藥物敏感性
謝 婭 孫紅敏 張 穎 史明星
(鄭州大學第一附屬醫院婦科,河南 鄭州 450052)
二甲雙胍在子宮內膜癌細胞中增強紫杉醇的藥物敏感性
謝 婭 孫紅敏 張 穎 史明星
(鄭州大學第一附屬醫院婦科,河南 鄭州 450052)
二甲雙胍;子宮內膜癌;紫杉醇;藥物敏感性
子宮內膜癌是婦科常見惡性腫瘤,占女性腫瘤患者的6%,近些年來子宮內膜癌的發病率呈增加趨勢[1]。大量證據表明肥胖、糖尿病和胰島素抵抗是子宮內膜癌的危險因素。隨著人民生活水平的提高,肥胖和糖尿病的發生率逐年上升[2]。雖然很多子宮內膜癌患者可以治愈,但仍有相當一部分患者會復發,最終導致四分之一的早期患者和二分之一的晚期患者會死于子宮內膜癌[3]。因此,研究者們一直在尋求治療子宮內膜癌的新方法。
子宮內膜癌與肥胖、糖尿病密切相關。由于表觀遺傳或者上游信號分子的激活,mTOR在許多腫瘤中過度激活,從而導致細胞增殖、生長、分化和生存調節異常[4,5]。抑癌基因PTEN通過抑制細胞內磷酸酯酶的活性導致(PI3K)-AKT/mTOR信號通路的抑制,發揮其抗腫瘤作用。不幸的是,PTEN缺失發生在30%~83%的子宮內膜癌中,促進mTOR信號通路的過度激活,從而導致細胞增殖、生長、分化和存活的調節異常[6,7]。由于表觀遺傳或者上游信號分子的激活,mTOR在許多腫瘤(包括子宮內膜癌)中過度激活,從而導致細胞增殖、生長、分化和生存調節異常,促進腫瘤的發生[8-10]。
二甲雙胍是用于治療2型糖尿病的常用的雙胍類降糖藥,特別在肥胖和超重人群中有顯著的治療效果[11]。基于人群的調查研究表明在合并有糖尿病的實質惡性腫瘤患者中二甲雙胍對腫瘤的發生發展有保護作用,并且發現二甲雙胍可以改善這些腫瘤的預后并降低[12,13]。Nicole S等發現合并糖尿病的子宮內膜癌的患者服用二甲雙胍可降低子宮內膜癌的死亡風險[14]。實驗室研究也表明二甲雙胍有抑制幾種腫瘤細胞生長的作用(包括乳腺癌、結腸癌和子宮內膜癌)[15,16]。我們前期研究發現胰島素樣生長因子-I(IGF-I)和胰島素樣生長因子-Ⅱ(IGF-Ⅱ)促進細胞增殖,然而二甲雙胍抑制子宮內膜癌細胞生長[17]。二甲雙胍通常是通過STK11(也稱LKB1)激活AMPK[18],激活過程涉及多個參與細胞增殖調節的信號通路,其中包括mTOR通路。65%的子宮內膜癌中LKB1表達缺失,從而導致mTOR信號通路的過度激活[19]。
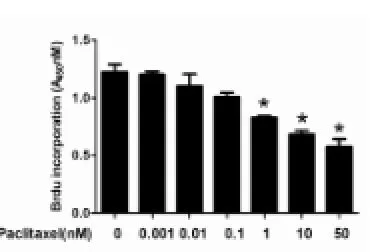
圖2

圖3
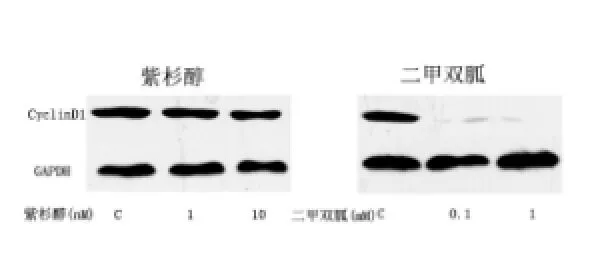
圖4
子宮內膜癌的治療原則以手術聯合化療、放療。紫杉醇、鉑類、阿霉素類化療藥是目前常用的化療藥物。化療藥物不敏感、化療耐受的發生是子宮內膜癌患者死亡的主要原因。因此急需找尋一種新的藥物來改善子宮內膜癌的化療敏感性。有研究表明,二甲雙胍可以提高子宮內膜癌對順鉑的敏感性。我們的前期研究也表明在體外實驗中二甲雙胍有抑制子宮內膜癌細胞生長的作用。本次研究的目的是探討二甲雙胍是否可以改善子宮內膜癌細胞對紫杉醇的敏感性,并進一步探討與mTOR信號通路活性的關系。
1 材料與方法
1.1 細胞系和試劑
人子宮內膜癌細胞系Ishikawa(IK,高分化)由魏麗慧教授(北京大學人民醫院)惠贈。細胞系維持在DMEM/F12添加10%胎牛血清在37 ℃ 5% CO2中。細胞系常規3~5 d傳代。二甲雙胍、紫杉醇購自Sigma公司。
1.2 細胞增殖分析
用BrdU-ELISA試劑盒(Roche)檢測細胞增殖的變化。IK8 ×103/孔的濃度接種于96孔板。24 h后,加以不同濃度的二甲雙胍(0.01、0.1、1 mmol/L)聯合或者紫杉醇(0.001、0.01、0.1 nmol/L)中孵育72 h。對照組加入相應濃度的PBS 或 DMSO。為了進一步分析AMPK的作用,用二甲雙胍聯合或者不聯合Compound C,0.5、 1 μm孵育細胞72 h。DNA分析是基于BrdU摻入DNA,然后用免疫分析的方法檢測。大概過程:孵育以后,細胞重新用10 μL/well BrdU labeling solution37 ℃孵育2 h,倒掉labeling solution,加入200 μL/well FixDenat 20 ℃孵育30 min,倒掉FixDenat液,加入100 μL/well anti-BrdU-POD工作液20 ℃孵育90 min,然后去除工作液,用洗液洗3次。最后,去除洗液,加入100 μL/well底物液20 ℃孵育20 min,然后加入25 μL的1 mol/L H2SO4,1 min后用450 nm波長檢測吸光值(參考波長:690 nm),每次3個復孔,重復3次實驗。同時用MTT方法驗證BrdU技術的有效性(數據中沒有顯示)。
1.3 Western immunoblotting
IK 細胞以2×105/孔的濃度接種于六孔板中,24 h后加以不同濃度的二甲雙胍(1、10 mmol/L)或者紫杉醇(0.1、1 nmol/L)中孵育48 h,用RIPA(1% NP 40,0.5 sodium deoxycholate and 0.1% SDS)提取細胞蛋白,加樣于10% SDS-PAGE中,然后轉到硝酸纖維素膜上。用5%的脫脂牛奶和0.1% Tween室溫孵育1h,然后用一抗(Cyclin D1,photo-AMPK,total-AMPK,GAPDH)4 ℃孵育(1∶1000;CST)過夜。用PBST洗膜5 min,3次后,HRP連接的二抗(1∶2000;CST)孵育2 h。最后再用PBST洗膜5 min,3次。用ECL試劑盒檢測硝酸纖維素膜上的條帶。用GAPDH(1∶1000,CST)來校正上樣量。蛋白條帶包括GAPDH,均用Quantity One(Bio-Rad,Hercules,CA)成像程序檢測光密度值。
1.4 協同效應分析
二甲雙胍聯合紫杉醇對細胞增殖作用的分析用Calcusyn軟件(Biosoft)中的CI值表示。該軟件是基于Chou和Talalay的中間效應分析原則,CI值是兩個或更多藥物之間相互作用程度的一個量度標準[20]。CI>1.1拮抗作用,0.9~1.1累加作用,0.7~0.9微弱協同作用,0.3~0.7協同作用,<0.3強協同作用。
1.5 統計分析
所有的數據都用均數±標準差,數據分析用SPSS17.0單因素方差分析,P<0.05視為有統計學意義。
2 結 果
2.1 二甲雙胍有抑制子宮內膜癌Ishikawa細胞增殖的作用,且這種作用能夠被AMPK阻斷劑Compound C削弱
0.1 L和1 mmol/L二甲雙胍能夠顯著抑制子宮內膜癌細胞生長(P<0.05),但這種作用能夠被5×10-7mol/L和1×10-6mol/L的Compound C所削弱(P>0.05)。見圖1。
Compound C是AMPK的競爭抑制子。我們發現二甲雙胍的抗增殖作用能夠被Compound C削弱(與對照組相比P>0.05)。這表明二甲雙胍的抗增殖作用需要AMPK通路的激活。
2.2 紫杉醇抑制子宮內膜癌Ishikawa細胞增殖
0.001、0.01和0.1 mmol/L的紫杉醇沒有顯著抑制子宮內膜癌Ishikawa細胞增殖的作用(P>0.05),但隨著濃度的增加,紫杉醇濃度達到或超過1 mmol/L時開始有抑制子宮內膜癌Ishikawa細胞增殖的作用(P<0.05)。
2.3 二甲雙胍能夠增強紫杉醇的抗子宮內膜癌增殖作用
我們發現二甲雙胍0.1 mmol/L與不同濃度的紫杉醇(0.001、0.01、0.1、1、10和50 mmol/L)共孵育后顯現出抗增殖作用比單藥明顯增強(P<0.01)。藥效最顯著的濃度是0.1 mmol/L二甲雙胍聯合1 nmol/L紫杉醇(圖3,P<0.05)。
2.4 二甲雙胍與紫杉醇有協同抗增殖作用
協同作用分析結果表明二甲雙胍和紫杉醇的最大協同效應發生在0.1 mmol/L二甲雙胍聯合1 nmol/L紫杉醇(IK:CI=0.356,見表1)。二甲雙胍聯合紫杉醇對細胞增殖作用的分析用Calcusyn軟件(Biosoft)中的CI值表示。CI<1提示兩種藥物有協同作用。0.7~0.9微弱協同作用,0.3~0.7協同作用,<0.3強協同作用。
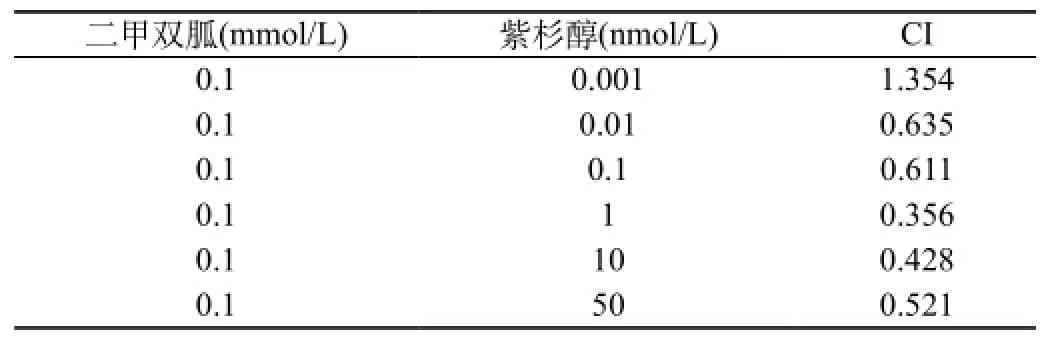
表1 二甲雙胍與紫杉醇有協同抗增殖作用
2.5 二甲雙胍能夠抑制細胞周期蛋白Cyclin D 1的表達
IK細胞以2×105/孔的濃度接種于六孔板中,24 h后加以不同濃度的二甲雙胍(1 mmol/L,10 mmol/L)或者紫杉醇(0.1 nmol/L,1 nmol/L)中孵育48 h,提取細胞蛋白,檢測細胞周期蛋白Cyclin D 1表達的變化。結果發現紫杉醇對細胞周期蛋白Cyclin D1的表達沒有影響,而二甲雙胍能夠抑制細胞周期蛋白Cyclin D1的表達。實驗重復3次,得到同樣的結果。見圖4。
3 討 論
本研究第一次在子宮內膜癌細胞中證實了二甲雙胍能夠增強紫杉醇抑制子宮內膜癌細胞的生長。我們證實了在子宮內膜癌細胞中二甲雙胍通過激活AMPK抑制細胞的增殖。們還發現二甲雙胍能夠協同性的增強紫杉醇的抗子宮內膜癌細胞增殖作用。并且發現二甲雙胍能夠抑制Cyclin D1的表達,這可能是二甲雙胍抑制子宮內膜癌細胞增殖的一個機制。
子宮內膜癌與肥胖、糖尿病密切相關。由于表觀遺傳或者上游信號分子的激活,mTOR在許多腫瘤中過度激活,從而導致細胞增殖、生長、分化和生存調節異常[21]。PI3K/AKT/mTOR通路能夠磷酸酯酶(PTEN)抑制,從而抑制腫瘤的發生發展。PTEN缺失,加上IGF-Ⅱ和IGF-IR過表達,導致子宮內膜癌中mTOR通路過度激活,最終促進細胞增殖并抑制凋亡。二甲雙胍的直接下游靶分子是AMPK,AMPK的激活調節多個信號通路,其中包括mTOR通路。AMPK通過TSC2的磷酸化抑制mTOR通路調節細胞生長,最終通過下游的效應分子4E-BP1和p70S6K調節細胞的轉錄和翻譯[22]。我們的結果證實了二甲雙胍能夠增強紫杉醇的抑制增殖作用,并且二甲雙胍的抑制增殖作用是由于其激活了AMPK,從而削弱了mTOR的過度激活(由于IGF-Ⅱ和IGF-IR的過表達造成的)。由于AMPK抑制AKT/mTOR信號通路,因此在AKT信號過度激活的腫瘤組織中AMPK可能是一個治療的靶點。既然PTEN缺失在子宮內膜癌細胞中發生率很高進而導致AKT信號過度激活,那么二甲雙胍誘導的AMPK激活可能是一個獨特的強有力的抗腫瘤方法。
紫杉醇是常用的治療子宮內膜癌的化療藥物,但由于化療劑量所致的化療副作用如消化道反應、骨髓抑制等在臨床經常發生,嚴重影響患者的生活質量和患者的依從性。并且化療耐受的發生時子宮內膜癌的主要致死原因。我們證明了與單用紫杉醇相比,二甲雙胍聯合紫杉醇能夠明顯增強抗子宮內膜癌增殖作用,并且二甲雙胍與紫杉醇有協同抗子宮內膜癌增殖作用(表1)。同時我們的結果表明在子宮內膜癌細胞中二甲雙胍通過抑制mTOR抑制子宮內膜癌的增殖,并且二甲雙胍聯合紫杉醇協同地抑制子宮內膜癌細胞增殖。因此甲雙胍聯合紫杉醇可能是一個有效地治療子宮內膜癌的方法,我們希望我們的數據能夠為將來聯合應用二甲雙胍聯合紫杉醇治療子宮內膜癌提供科學基礎。進一步的聯合治療療效的體內試驗和亞臨床實驗使我們將來研究的目標。既然肥胖和糖尿病與子宮內膜癌的高病死率密切相關,并且二甲雙胍聯合紫杉醇有協同抑制子宮內膜癌增殖的作用,那么二甲雙胍聯合紫杉醇可能會成為治療子宮內膜癌的一個有效方法。
[1] Benedet JL,Bender H,Ngan HY,et al.FIGO staging classifications and clinical practice guidelines in the management of gynecologic cancers[J]. Int J Gynaecol Obstet,2000,70(2):209-262.
[2] Purdie DM,Green AC,Purdie DM,et al.Epidemiology of endometrial cancer.Best practice & research[J]. Clin Obstet Gynaecol,2001, 15(3):341-354.
[3] Pitson G,Colgan T,Levin W,et al.Stage Ⅱ endometrial carcinoma: prognostic factors and risk classification in 170 patients[J]. Int J Radiat Oncol Biol Phys,2002,53(4):862-867.
[4] Vander HMG,Cantley LC,Thompson CB.Understanding the Warburg effect: the metabolic requirements of cell proliferation[J]. Science,2009,324(5930):1029-1033.
[5] Vander HE,Lee SI,Bandhakavi S,et al.Insulin signalling to mTOR mediated by the Akt/PKB substrate PRAS40[J].Nat Cell Biol,2007, 9(3):316-323.
[6] Scheen AJ.Clinical pharmacokinetics of metformin[J]. Clin Pharmacokinet,1996,30(5):359-371.
[7] Lange CA,Richer JK,Shen T,et al.Horwitz.Convergence of progesterone and epidermal growth factor signaling in breast cancer. Potentiation of mitogen-activated protein kinase pathways[J].J Biol Chem,1998,273(47):31308-31316.
[8] Isoda JL,Zirlik YA.Metformin inhibits proinflammatory responses and nuclear factor-kappaB in human vascular wall cells[J]. Arterioscler Thromb Vasc Biol,2006,26(3):611-617.
[9] Gotlieb WH,Saumet J,Beauchamp MC,et al.In vitro metformin anti-neoplastic activity in epithelial ovarian cancer[J]. Gynecol Oncol,2008,110(2):246-250.
[10] Calle EE,Rodriguez C,Walker-Thurmond K,et al. Thun,Overwei ght,obesity,and mortality from cancer in a prospectively studied cohort of U.S.adults[J]. N Engl J Med,2003,348(17):1625-1638.
[11] Navarro M,Baserga R.Limited redundancy of survival signals from the type 1 insulin-like growth factor receptor[J]. Endocrinology,2001,142(3):1073-1081.
[12] Schmelzle T,Hall MN.TOR, a central controller of cell growth[J]. Cell,2000,103(2):253-262.
[13] Sabatini DM. mTOR and cancer: insights into a complex relationship[J]. Nat Rev Cancer,2006,6(9):729-734.
[14] Cui X,Zhang P,Deng W,et al.Insulin-like growth factor-I inhibits progesterone receptor expression in breast cancer cells via the phosphatidylinositol 3-kinase/Akt/mammalian target of rapamycin pathway: progesterone receptor as a potential indicator of growth factor activity in breast cancer[J]. Mol Endocrinol,2003,17(4):575-588.
[15] Hadad SM,Fleming S,Thompson AM. Targeting AMPK: a new therapeutic opportunity in breast cancer[J]. Crit Rev Oncol Hematol,2008,67(1):1-7.
[16] Mutter GL,Lin MC,Fitzgerald JT,et al.Altered PTEN expression as a diagnostic marker for the earliest endometrial precancers[J]. J Natl Cancer Inst,2000,92(11):924-930.
[17] Lu KH,Wu W,Dave B,et al, Loss of tuberous sclerosis complex-2 function and activation of mammalian target of rapamycin signaling in endometrial carcinoma[J]. Clin Cancer Res,2008,14(9):2543-2550.
[18] Jefferies HB,Fumagalli S,Dennis PB,et al.Thomas, Rapamycin suppresses 5'TOP mRNA translation through inhibition of p70s6k [J]. EMBO J,1997,16(12):3693-3704.
[19] Augustin LS,Dal Maso L,Franceschi S, et al.Association between components of the insulin-like growth factor system and endometrial cancer risk[J]. Oncology,2004,67(1):54-59.
[20] Chou TC,Talalay P.Quantitative analysis of dose-effect relationships: the combined effects of multiple drugs or enzyme inhibitors[J]. Adv Enzyme Regul,1984,22:27-55.
[21] Liu H,Scholz C,Zang C,et al.Metformin and the mTOR inhibitor everolimus (RAD001) sensitize breast cancer cells to the cytotoxic effect of chemotherapeutic drugs in vitro[J].Anticancer Res,2012, 32(5):1627-1637.
[22] Monteagudo S,Pérez-Martínez FC,Pérez-Carrión MD,et al.Inhibition of p42 MAPK using a nonviral vector-delivered siRNA potentiates the anti-tumor effect of metformin in prostate cancer cells[J].Nanomedicine(Lond),2012,7(4):493-506.
R737.33
B
1671-8194(2014)13-0073-03
國家自然科學基金(81202070)資助

