WT1 異構體比例轉變對人白血病細胞株HL-60增殖和凋亡的影響*
徐 菁, 覃艷紅, 張翠明, 喬愛秀, 李靈敏, 王宏偉
(山西醫科大學1病理教研室,2第二醫院血液病研究所,3第二醫院超聲診斷科,山西 太原030001)
WT1(Wilms tumor 1)蛋白作為一種重要的轉錄 調控因子參與許多腫瘤特別是白血病的發生。WT1 mRNA 經過選擇性剪接可以編碼4 種同源異構體。在第5 外顯子處,編碼17 個氨基酸插入調控區與鋅指區之間,可把WT1 蛋白分為17AA+及17AA-2 種異構體。在第9 外顯子末端即第3 和第4 鋅指結構之間插入KTS(Lys-Thr-Ser)3 個氨基酸,從而又可將WT1 表達蛋白分為KTS+和KTS-2 種異構體。通過不同的組合,可細分為4 種主要的剪接體,這4 種不同的含鋅指結構的DNA 結合蛋白分別為17AA+/KTS+、17AA+/KTS-、17AA-/KTS+和 17AA-/KTS-。4 種異構體比例的嚴格平衡在細胞增殖、分化和凋亡的調節等方面起著重要作用[1-2]。
我們的前期工作證實人急性髓系白血病細胞系HL-60 中4 種WT1 異構體同時存在,在全反式維甲酸誘導分化前以17AA+/KTS+異構體為主,而分化后以17AA-/KTS-為主[3]。為了進一步明確WT1及其異構體在白血病中的作用,我們將WT1(17AA-/KTS-)異構體轉染白血病細胞系HL-60 細胞,從而將HL-60 細胞中WT1 異構體表達的比例由17AA+/KTS+優勢型轉變為17AA-/KTS-優勢型,探討WT1 異構體比例的轉變對HL-60 細胞增殖和凋亡的影響。
材 料 和 方 法
1 材料與試劑
PCDH1-MCS1-EF1-copGFP(簡稱PCDH1),全長約7.5 kb,為帶有SV40 和PCMV 啟動子、具有氨芐青霉素抗性基因的慢病毒質粒載體,其與大腸桿菌DH5α、白血病細胞系HL-60 細胞均為本實驗室保存。三氧化二砷(As2O3)注射液購自哈爾濱伊達藥業有限公司。RPMI-1640 培養液購自Gibco/BRL。限制性內切酶Xba Ⅰ、EcoRⅠ及熒光定量試劑盒等均購自TaKaRa。脂質體LipofectamineTM2000 購自Invitrogen,引物及探針為上海基康公司合成。針對WT1 蛋白C 末端的抗C-19 兔抗人多克隆抗體和羊抗兔Ⅱ抗為Santa Cruz 產品,MTT 購自Sigma,Annexin V/PI 凋亡檢測試劑盒購自Coulter。
2 重組質粒PCDH1-WT1(17AA- /KTS-)的構建
根據WT1(17AA-/KTS-)異構體的全長cDNA序列,使用Primer 5.0 軟件設計引物,分別在其上、下游引物5’端引入限制性內切酶EcoRⅠ和Xba I 識別位點,上游引物為5’-CCGGAATTCTCAAAGCGCCAGCTGGAG-3’,下游引物為5’-GCTCTAGAATGCAGGACCCGGCTTC-3’(下劃線為引入的酶切位點);從HL-60 細胞中提取總RNA 并逆轉錄,以cDNA 為模板擴增全長WT1(17AA-/KTS-)基因序列,用限制性內切酶EcoRⅠ和XbaⅠ對純化后的擴增產物和表達質粒PCDH1 進行雙酶切,回收并純化,T4 DNA 連接酶連接后轉化至感受態細胞DH5α,氨芐青霉素篩選挑取單克隆菌落,擴增后提取質粒,進行酶切和測序鑒定。
3 質粒轉染
采用LipofectamineTM2000 進行細胞轉染,生長良好的HL-60 細胞于轉染前24 h 接種到6 孔板中,待細胞總面積達到60% ~80%,取3 μg 重組質粒PCDH1-WT1(17AA-/KTS-)和空載體PCDH1 分別進行基因轉染(具體操作按說明書進行),用600 mg/L G418 篩選具有抗性的細胞克隆,挑取克隆擴大培養。
4 實時熒光定量RT-PCR 檢測
引物及探針自行設計,由上海基康公司合成,引物及探針序列為:總WT1 探針,5’-FAM-CGGAGCCCAATACA-MGB-3’,上游引物5’-GATAACCACACAACGCCCATC-3’,下 游 引 物 5’-CACGTCGCACATCCTGAATG-3’;17AA+探針:5’-FAM-CAGCACAGGGATCGAGA-MGB-3’,上 游 引 物 5’-TGGACAGAAGGGCAGAGCA-3’,下 游 引 物 5’-GGATGGGCGTTGTGTGGT-3’;KTS+探針,5’-FAM-TTCCGGTCCGACCA-MGB-3’,上游引物5’-CAAAAGACACCAAAGGAGACATACA-3 ’,下 游 引 物 5 ’-CTGAAGGGCTTTTCACTTGTTTTAC-3’;β-actin 探 針,5’-FAM-ATCATTGCTCCTCCTGAG-MGB-3’,上游引物5’-GCTCAAAAGACACCAAAGGAGAC-3’,下游引物 5 ’-AGCTGAAGGGCTTTTCACTTGTTT-3 ’。 將WT1/β-actin、17AA+/β-actin 和KTS+/β-actin 分別作為WT1 基因及17AA+、KTS+異構體的相對表達量。反應條件參見文獻[3]。
5 Western blotting 檢測蛋白表達
收集細胞各1 ×107,溶解于裂解緩沖液(PBS中含10 g/L NP40、5 g/L 脫氧膽酸鈉、1 g/L SDS、1 mg/L 抑肽酶和100 mg/L PMSF),提取細胞總蛋白,Bradford 法定量蛋白,各取總蛋白45 μg 經12%SDS-PAGE 電泳,電轉移至PVDF 膜,分別用WT1 抗體和β-actin 抗體(Abcam)雜交,洗膜后再與生物素化的Ⅱ抗結合,DAB 顯色。采用Quantity One 軟件進行圖像灰度分析,計算WT1 異構體蛋白與β-actin的灰度比值以表示WT1 異構體的相對表達量。
6 MTT 實驗
取對數生長期的正常HL-60 細胞、轉染空質粒HL-60 細胞(以下簡寫為HL-60/CMV)和轉染重組質粒細胞(以下簡寫為HL-60/WT1-/-),以1 ×104cells/well 種植于96 孔細胞培養板中,設對照組及加As2O3組(終濃度2 μmol/L),分別于培養0、24、48、72 和96 h 每孔加入5 g/L MTT 液20 μL,在37℃、5% CO2、飽和濕度下繼續培養4 h 后加入DMSO 150 μL,振蕩混勻。測定各孔在570 nm 的吸光度(A570),計算細胞生長抑制率,抑制率(%)=(1 -A轉染組/A對照組)×100%。
7 細胞形態學觀察
分對照組和加As2O3組(終濃度2 μmol/L),分別于培養24、48 和72 h 后收集細胞,涂片后瑞特-姬姆薩染色,光鏡下觀察細胞形態。
8 流式細胞術檢測細胞凋亡
HL-60、HL-60/CMV 及HL-60/WT-/-單克隆細胞分為不加藥組和加As2O3組,分別于培養24、48和72 h 后收集細胞,調整其濃度為1 ×109/L。根據Annexin V-FITC/PI 檢測試劑盒說明,取100 μL 細胞懸液于試管中,依次加入Annexin V-FITC 5 μL 和PI 10 μL,混勻后于室溫避光孵育30 min,在檢測管中加入PBS 400 μL,上流式細胞儀檢測。
9 統計學處理
應用SPSS 16.0 統計學軟件處理數據。數據用均數±標準差(mean ±SD)表示,多組間比較采用單因素方差分析(ANOVA),組間兩兩比較采用最小顯著性差異法(LSD 法)。以P <0.05 為差異有統計學意義。
結 果
1 重組質粒PCDH1-WT1(17AA- /KTS-)的鑒定
重組質粒經EcoRⅠ和XbaⅠ雙酶切后,進行1%瓊脂糖凝膠電泳,可見樣品的環狀質粒樣條帶被酶切成2 條清晰的條帶,大小分別為7 500 bp 和1 500 bp 左右,與目的片段WT1(17AA-/KTS-)(1 493 bp)和PCDH1 質粒(7 544 bp)的理論值大致相符,初步認定為所需陽性克隆構建成功,見圖1。測序結果亦證實克隆出正確基因片段。
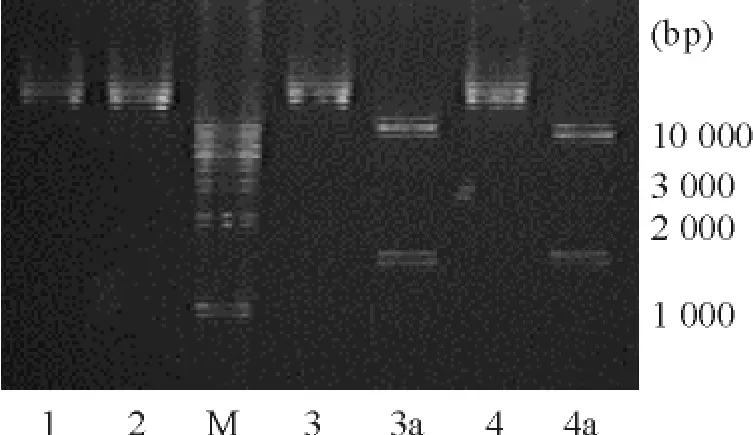
Figure 1. Identification of PCDH1-MCS1-EF1-copGFP recombinant vectors for WT1 isoforms. M:marker;1 and 2:PCR product of pCDH1;3 and 4:PCR product of pCDH1-WT1(17AA - /KTS - );3a and 4a:pCDH1-WT1(17AA - /KTS -)after enzyme digestion.圖1 WT1 異構體插入慢病毒表達載體PCDH1-MCS1-EF1-copGFP 的PCR 和酶切鑒定
2 轉染基因mRNA 的檢測
HL-60/WT1-/-單克隆細胞中17AA-和KTS-異構體表達均增高,17AA+異構體比例由轉染前的0.60 ±0.04 降到轉染后的0.38 ±0.06;KTS+異構體比例由0.53 ±0.08 降至轉染后96 h 的0.40 ±0.06,可見WT1 異構體表達的比例已由17AA+/KTS+優勢型轉變為17AA-/KTS-優勢型,差異顯著(P <0.05)。
3 轉染基因在蛋白水平的表達
Western blotting 顯示,轉染WT1(17AA-/KTS-)異構體的單克隆細胞中WT1 (17AA-/KTS-)蛋白表達較對照組HL-60 和HL-60/CMV 明顯增高(0.661 ±0.058 vs 0.295 ±0.070,0.661 ±0.058 vs 0.298 ± 0.025,P <0.05),陽 性 轉 染 組 WT1(17AA+/KTS+)蛋白表達較對照組HL-60 和HL-60/CMV 明顯降低(0.394 ±0.036 vs 0.498 ±0.039,0.394 ±0.036 vs 0.489 ±0.027,P <0.05),而對照組HL-60 和HL-60/CMV 之間差異無統計學意義(P>0.05),見圖2、3。

Figure 2. The expression of WT1 isoforms in HL-60 cells detected by Western blotting. 1 ~3:HL-60/WT - / -;4:HL-60;5:HL-60/CMV圖2 Western blotting 檢測HL-60 細胞中WT1 異構體的表達

Figure 3. The relative expression of WT1 isoforms detected by Western blotting. Mean ± SD. n =3. * P <0.05 vs other groups.圖3 Western blotting 檢測WT1 異構體的表達水平
4 As2O3 對細胞的生長抑制作用
HL60/WT1-/-組的細胞生長抑制率均明顯高于HL-60/CMV 及HL-60 組,差異顯著,進一步提示轉染WT1 (17AA-/KTS-)異構體能明顯抑制HL-60細胞的增殖,見表1。

表1 MTT 法測定轉染組與對照組在各時點的抑制率Table 1. Proliferation inhibitory rates at different time points measured by MTT (%.Mean±SD. n=3)
5 形態學檢測
光鏡下可見 HL-60、HL-60/CMV 和 HL-60/WT1-/-細胞核圓形,染色質均勻疏松。加As2O3培養24 h 形態變化不明顯,處理48 h 后,各組細胞都出現了凋亡形態,細胞變形,胞膜完整,部分胞膜出現偽足樣突起,核固縮,染色質凝聚于核周邊,處理72 h 凋亡進一步加重;但凋亡形態改變以HL-60/WT1-/-更為明顯,見圖4。

Figure 4. Apoptosis of HL-60 cells shown by Wright-Giemsa staining (× 1 000). A:HL-60-cells;B:HL-60 cells treated with As2O3 for 72 h;C:HL-60/CMV cells treated with As2O3 for 72 h;D:HL-60/WT1 - / - cells treated with As2O3 for 72 h.圖4 瑞特-姬姆薩染色觀察HL-60 細胞的凋亡
6 細胞早期凋亡的變化
不加藥物的2 組均以活細胞為主,僅有少量細胞凋亡。加As2O3(2 μmol/L)24 h 后,各組細胞Annexin V+/PI-亞群均增多,而HL-60/WT1-/-組Annexin V+/PI-亞群更明顯多于HL-60/CMV 及HL-60組,差異有統計學意義(P <0.05),見圖5、表2。此結果提示轉染WT1(17AA-/KTS-)異構體能夠增加HL-60 細胞對As2O3的敏感性,使As2O3對HL-60細胞的促凋亡作用更加明顯。

Figure 5. Early apoptotic rates of the transfected HL-60 cells analyzed by Annexin Ⅴ/PI double staining assay. A:HL-60 cells;B:HL-60 cells treated with As2O3 for 72 h;C:HL-60/CMV cells treated with As2O3 for 72 h;D:HL-60/WT1 - / - cells treated with As2O3 for 72 h.圖5 AnnexinⅤ/PI 法檢測轉染細胞的凋亡

表2 As2O3 作用不同時間各組細胞的凋亡百分率Table 2. Apoptotic rates at different time points induced by As2O3(%. Mean±SD.n=3)
討 論
WT1 為一種具有激活和抑制雙重作用的轉錄因子,參與造血細胞增殖、分化和凋亡等過程的調控。近年來學者發現WT1 在各類白血病細胞中高表達,然而WT1 不同異構體的存在及其功能的不同使得研究變得復雜,要真正明確WT1 在白血病中的作用及其機制尚需結合異構體類型及比例作進一步深入探討。
體外實驗則表明WT1(KTS-)蛋白可通過調節一些基因如PDGFA、EGFR、PAX-2 和WT1 本身的表達而影響這些下游轉錄因子的活性及功能。有報道顯示WT1(17AA-)既能激活也能抑制下游基因的轉錄,這取決于此基因上究竟有1 個還是2 個WT1 核蛋白的DNA 結合位點[4]。Richard 等[5]將WT1 的4種異構體分別轉染至人胚腎293 細胞,發現僅17AA+異構體能抑制紫外線照射誘導的細胞凋亡,進一步顯示了17AA+異構體在細胞凋亡中的抑制作用。Loeb 等[6]將WT1 (17AA-/KTS-)cDNA 轉染鼠源性造血祖細胞32Dcl3 細胞,發現WT1(17AA-/KTS-)可以減慢細胞增殖,加速細胞分化,且減慢細胞周期。而Inoue 等[7]同樣采用鼠源性32Dcl3 細胞,轉染WT1(17AA+/KTS+)異構體,發現WT1(17AA+/KTS+)可以抑制細胞分化,促進細胞增殖。我們的實驗通過將HL-60 細胞中WT1 異構體表達的比例由17AA+/KTS+優勢型轉變為17AA-/KTS-優勢型,細胞增殖受到抑制,這與Loeb 等的實驗結果基本一致。
目前對WT1 調節細胞凋亡的機制存在較多爭論,一般認為WT1 通過與bcl-2、c-myc 等基因相互作用,在維持細胞增殖和凋亡之間的平衡起一定的作用。bcl-2 基因在細胞凋亡過程中起關鍵性作用,其第 2 外顯子存在 WT1/EGR 結合的位點(GCGGGGGCG),WT1 通過調節bcl-2 的轉錄而參與細胞凋亡的調控[8]。新近研究表明WT1 調節細胞周期和凋亡途徑,WT1 17AA+異構體在內源性凋亡途徑中在線粒體上游某些位點起著抗凋亡作用[9-10]。Menke 等[11]將WT1 基因4 種異構體瞬間轉染2 種肝癌細胞株,發現WT1(KTS-)可誘發細胞凋亡,而WT1(KTS+)則不能。我們的實驗中轉染WT1 (17AA-/KTS-)異構體能夠增加HL-60 細胞對As2O3的敏感性,使As2O3對HL-60 細胞的促凋亡作用更加明顯,這與Menke 等的研究結果大致相似。
綜上,我們成功構建了穩定表達WT1 (17AA-/KTS-)的白血病細胞株HL-60,觀察到HL-60 細胞中WT1 異構體的優勢型轉變為17AA-/KTS-后細胞增殖受抑制,對As2O3誘導的凋亡更加敏感,具體機制及其與增殖和凋亡相關基因之間的關系有待進一步研究。
[1] Lopotová T,Polák J,Schwarz J,et al. Expression of four major WT1 splicing variants in acute and chronic myeloid leukemia patients analyzed by newly developed four realtime RT PCRs[J]. Blood Cells Mol Dis,2012,49(1):41-47.
[2] Kramarzova K,Stuchly J,Willasch A,et al.Real-time PCR quantification of major Wilms’tumor gene 1(WT1)isoforms in acute myeloid leukemia,their characteristic expression patterns and possible functional consequences[J].Leukemia,2012,26(9):2086-2095.
[3] 徐 菁,王宏偉,楊 濤,等. 維甲酸誘導HL-60 細胞分化過程中WT1 基因表達及其異構體比例變化的研究[J]. 中華病理學雜志,2010,39(3):183-186.
[4] Gannon AM,Turner EC,Reid HM,et al. Regulated expression of the alpha isoform of the human thromboxane A2receptor during megakaryocyte differentiation:a coordinated role for WT1,Egr1,and Sp1[J]. J Mol Biol,2009,394(1):29-45.
[5] Richard DJ,Schumacher V,Royer-Pokora B,et al.Par4 is a coactivator for a splice isoform-specific transcriptional activation domain in WT1[J].Genes Dev,2001,15(3):328-339.
[6] Loeb DM,Summers JL,Burwell EA,et al.An isoform of the Wilms’tumor suppressor gene potentiates granulocytic differentiation[J]. Leukemia,2003,17(5):965-971.
[7] Inoue K,Tamaki H,Ogawa H,et al. Wilms’tumor gene(WT1)competes with differentiation-inducing signal in hematopoietic progenitor cells[J]. Blood,1998,91(8):2969-2976.
[8] 胡紹燕,陳子興,顧偉英,等. WT1 基因增強子構建位點對WT1 基因啟動子轉錄活性的影響[J]. 中國病理生理雜志,2008,24(2):209-214.
[9] Ito K,Oji Y,Tatsumi N,et al. Antiapoptotic function of 17AA(+)WT1 (Wilms’tumor gene)isoforms on the intrinsic apoptosis pathway[J]. Oncogene,2006,25(30):4217-4229.
[10]Gu W,Hu S,Chen Z,et al. High expression of WT1 gene in acute myeloid leukemias with more predominant WT1 +17AA isoforms at relapse[J]. Leuk Res,2010,34(1):46-49.
[11]Menke AL,Shvarts A,Riteco N,et al. Wilms’tumor 1-KTS isoforms induce p53-independent apoptosis that can be partially rescued by expression of the epidermal growth factor receptor or the insulin receptor[J]. Cancer Res,1997,57(7):1353-1363.

