關于理想氣體混合熵變的討論
岳凡 陳華梅 孫都成
(新疆大學化學化工學院 新疆烏魯木齊 830046)
物理化學是大學化學專業學生必修的四大專業基礎課之一,而化學熱力學則是物理化學中非常重要的內容之一。化學熱力學理論性強,數學處理比較復雜,公式較多,而且公式的使用限制條件也較多,學生不易掌握。因此,在物理化學教學中,可盡量通過比較形象化的方式使學生理解,并適當地將理論與實際相聯系,使學生體會到學習物理化學的樂趣,從而達到在有限的教學課時內使學生對本課程內容更好掌握的目的[1]。
在文獻[2]第3章第87~88頁中,討論了理想氣體的等溫等容混合熵變,這是一個比較容易出錯和容易混淆的概念。
原文提出,對于相同理想氣體的等溫等容混合,如圖1所示。
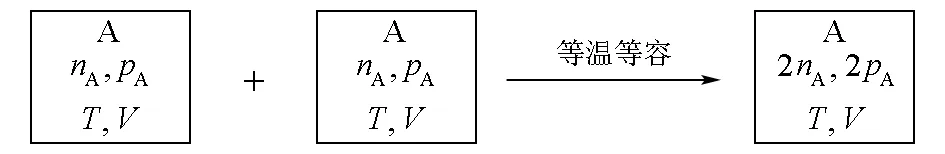
圖1 相同理想氣體等溫等容混合
由于是相同分子的混合,每個分子在混合后的活動范圍縮小一半,相當于體積縮小一半,氣體被壓縮,所以混合后熵減少,其熵變為:
不同理想氣體的等溫等容混合如圖2所示。
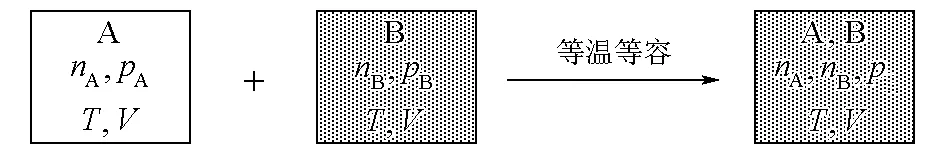
圖2 不同理想氣體等溫等容混合
因為是理想氣體的等溫物理變化過程,所以ΔmixU=0。終態壓力p=pA+pB,有:
Δ(pV)=pV-(pAV+pBV)=0
所以有:
ΔmixH=ΔmixU+Δ(pV)=0
對于不做非膨脹功的等容可逆過程,QR=ΔmixU=0,所以
ΔmixS=0
因為是不同理想氣體的混合,根據理想氣體的微觀模型,氣體分子之間的相互作用力可以忽略不計,分子本身的體積也可以忽略,所以混合前后兩種不同分子的活動范圍都沒有發生變化,混合時沒有熱效應,所以也就沒有熵的變化。
關于這點,學生學習時會感到很迷惑,其一是,書中對第二種情況推導所得的ΔmixU=0以及ΔmixH=0在對第一種情況似乎同樣適用,當然這一步事實上是正確的。那么問題就在下一步,“對于不做非膨脹功的等容可逆過程,QR=ΔmixU=0,所以ΔmixS=0。”這段話,應該只適用于第二種情況,而對相同氣體的這一過程來說,這段話并不適用,學生對于這一點有疑義,由于這種懷疑心理而產生的不確定感,導致學生認為物理化學課程學習有些不可掌握,從而產生一定程度的陌生感及厭學情緒。為克服學生的這些負面感覺,在教學過程中可采用學生較熟悉的推導過程來證明這一結論;另外,由于形象化教學更易理解,更易記憶,在教學過程中也被嘗試采用。
首先,用學生比較熟悉的兩個過程來模擬這一過程,從而證明這一結論的正確性。
對于相同的理想氣體,先設計第一步,將兩等壓等體積的相同理想氣體,經一等溫等壓過程,合并為兩體積的理想氣體,如圖3所示。
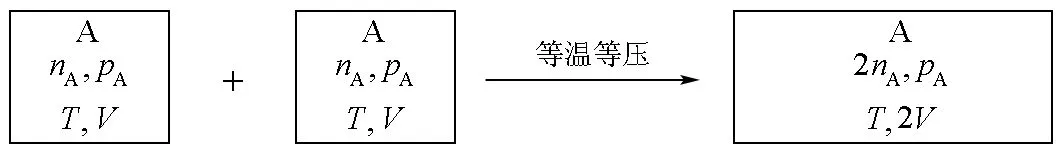
圖3 相同理想氣體等溫等壓混合
學生很容易從這一過程得出熵變為0的結論。
第二步,將這一氣體等溫壓縮至體積為原來的一半,即上述過程的終態。在這一過程中,由于是等溫變化,所以ΔU=0,QR=-WR。對于等溫可逆過程,有:
所以有:
與課本結果相同。
對于不相同的理想氣體,也經過同一過程(圖4)。

圖4 不同理想氣體等溫等壓混合
在第一步時,由于是不同氣體發生混合,則混合熵可根據前面第2節的結論,得計算結果為:
然后將這一混合氣體等溫壓縮為原來的一半,這時,根據與上面同樣的理由,可得此時的熵變為:
將兩式相加,可得這一過程的總熵變為0。
通過以上過程的證明,一方面使學生對該問題有了可掌握感,另一方面,也是對以前教學內容的一種復習鞏固。
另外,為形象地解釋這種熵變產生的原因,可由熵的玻爾茲曼定義[2]S=klnΩ(Ω為微觀狀態數)對這一過程進行討論。
在相同氣體分子進行混合時,為簡化討論,將其設為一個小球在兩個格子里的排列,對于兩體積氣體混合前后的過程,可以簡化表示如圖5。
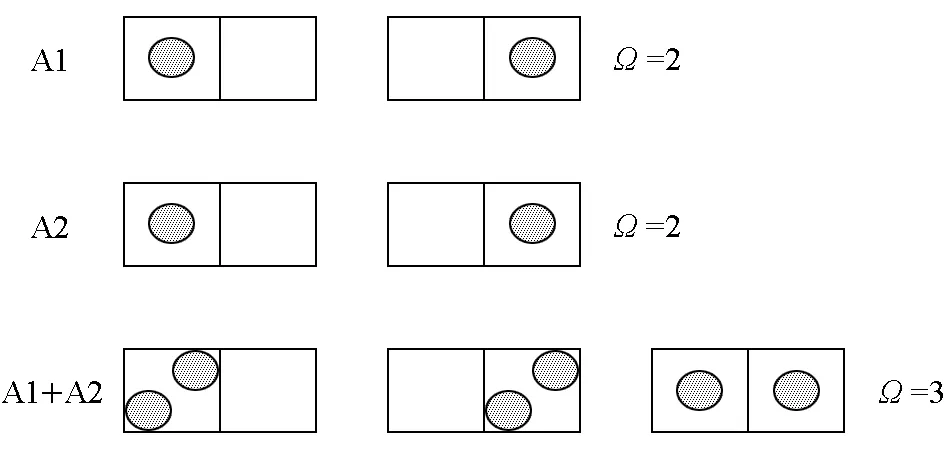
圖5 相同理想氣體等溫等容混合簡化統計表達
此時總的微觀狀態數為3,小于前兩者分開時總的微觀狀態數4。經觀察之后,學生可發現,在A1+A2狀態時,第3種狀態由于A1與A2的不可區分性,由兩種狀態變成了一種狀態,就是由于這一原因,造成同一理想氣體在等溫混合時產生了熵減。
對于不同理想氣體等溫等容混合時,其統計學圖像簡化如圖6。此時,混合前后微觀狀態數不變。
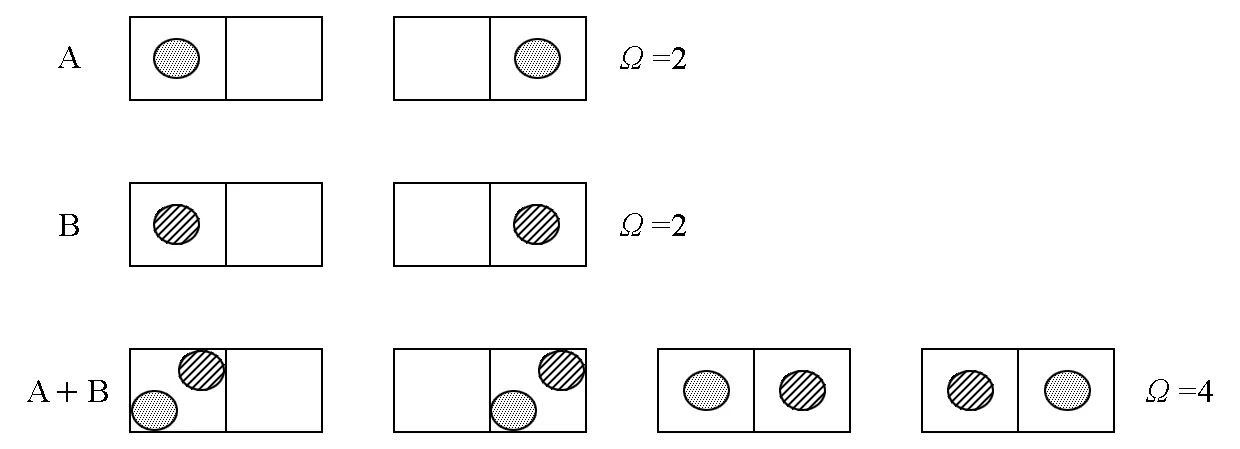
圖6 不同理想氣體等溫等容混合簡化統計表達
從統計角度可清楚地揭示兩種混合狀態物理圖像的差別。在A+B中,第3種狀態與第4種狀態是不同的,表明此時A在左與A在右有區別,就好像A+B之后,A仍然獨立地占有兩個格子;所以,對于A來說,這是一個等容過程。而在A1+A2中,這兩種狀態變成不可區分的一個狀態,此時A1在左與A1在右沒有區別,就好像A1+A2后,A1只占據其中一個格子一樣;所以,對于A1來說,這是一個體積減小了一半的非等容過程。
問題討論到此,學生還有一個疑問,就是關于這個問題的熱力學解釋的實際意義。如果不能應用于解決實際問題,就純粹是一個抽象的理論游戲,這樣學生就缺乏掌握此概念的動力,認為這是一個既麻煩,又無用的章節。下面采用一個在化工生產中非常重要的反應來進行說明。
對于這個反應來說,達到平衡時,有如下關系:
ΔrG=ΔrH-TΔrS=0
對此體系加入一惰性氣體,使總壓增加一倍,而體積保持不變。這就相當于上面討論的不同理想氣體等溫等容混合。因為是理想氣體等溫混合過程,所以沒有混合熱,此反應的ΔrH不變。對于O2(g)及CO(g)來說,由上面結論可知,兩物質的熵也不改變,所以ΔrG仍然等于0,平衡不發生改變,與用平衡常數討論的結果相同。而當加入反應氣體時,由于混合熵改變,將導致反應平衡被打破。
通過以上討論,能使學生從多個角度來理解理想氣體混合熵變這一過程,使抽象的問題具體化。通過該教學設計,不但不會加重學生的負擔,反而會提高學生對不同過程熵變的計算及其推論的理解,在介紹新概念的同時,達到復習舊課程、提高記憶準確性的目的。在實施新課改的今天,我們讓學生從不同的角度認識和解決同一類問題,有利于培養學生分析問題和解決問題的能力,提高學習效果。
參 考 文 獻
[1] 劉瑞泉,張金萍.烏魯木齊成人教育學院學報,1997(2):54
[2] 沈文霞.物理化學核心教程.第2版,北京:科學出版社,2009

