蛋白質的研究歷程與諾貝爾科學獎
顧家山 劉麗 汪豐云 孫影 余妍霞
(安徽師范大學化學與材料科學學院 安徽蕪湖 241000)
諾貝爾科學獎的成果在相當大程度上可反映出20世紀以來科學的主要成就和科學的發展情況,因此從與蛋白質相關的科研工作獲取諾貝爾科學獎的情況,可了解100多年來蛋白質研究的發展歷史。
1 蛋白質的基本概況
蛋白質作為生命的物質基礎,參與生物體內的生命活動過程;蛋白質有其自身固有的特點,它的基本化學組成主要是碳、氫、氧、氮4種元素,有些蛋白質還含有硫、磷、鐵等元素,這些元素按一定結構組成氨基酸。氨基酸是蛋白質的組成單位,自然界中的氨基酸有20多種,這20多種氨基酸以不同數目和不同順序連接構成種類繁多、千差萬別的蛋白質,發揮各自不同的生理功能。因此,要想真正揭開生命現象的奧秘,必須進行蛋白質水平的研究。科學家從早期對蛋白質組成、結構、性質的初步認識到現代對蛋白質組的深入研究,經歷了艱難曲折的歷程,在科學史上寫下了輝煌的篇章。
2 蛋白質研究的歷程
2.1 蛋白質研究方面諾貝爾科學獎的統計
有關蛋白質研究方面獲得諾貝爾科學獎的詳細情況見表1。
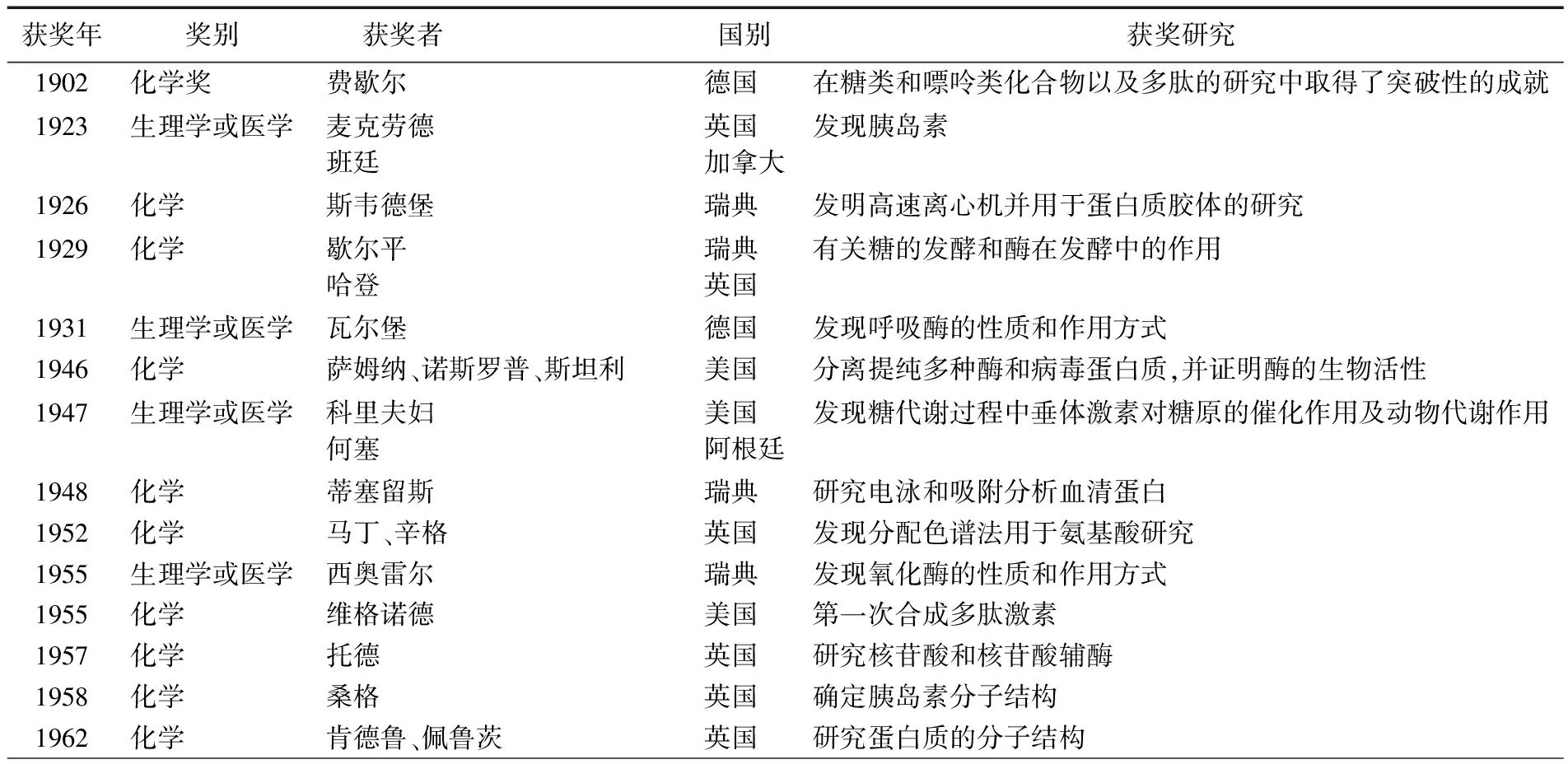
表1 蛋白質研究方面獲得的諾貝爾科學家

續表
統計數據源于:顧家山,汪豐云,余妍霞.諾貝爾科學獎與科學精神.合肥:中國科技大學出版社,2009,8。
2.2 蛋白質研究的初期階段
17世紀后出現了有機化學這門學科,并逐漸形成了有機結構理論。18世紀后期,法國化學家馬凱爾(P.J.Macquer)把雞蛋清類的物質稱為“蛋白性”物質。當時人們發現雞蛋清在加熱后會從液態變為固態,并且該過程不可逆。這是人們對蛋白質的最初認識。19世紀初期,人們從動物和植物中分離出一些與禽蛋白相似的物質,把它稱為Proteos(希臘文,最重要的),被認為是“植物為食草動物準備的一種首要或主要的營養成分,后者又將其傳遞給食肉動物”。1838年,瑞典化學家貝采利烏斯(J.J.Berzelius)提出蛋白質的概念。當時蛋白質被簡單地定義為“加熱易聚集”的物質[1],并認為蛋白質是生物機體組織的基本構成形式。限于當時的科學認識水平和實驗技術手段,要想弄清蛋白質的組成、結構和性質,困難是很多的。后來由于科學家的努力,發現生物體中存在各種各樣成分的蛋白質。化學家采用了在酸性或堿性溶液中加熱到100℃水解蛋白質的研究方法,使蛋白質分解成多肽和氨基酸。用這種方法,在19世紀末已經得到了14種不同的氨基酸。這種分析的研究方法也給后來的研究工作指明了方向。
2.3 蛋白質研究的發展階段
2.3.1 蛋白質結構的測定
蛋白質結構測定是蛋白質研究領域中的一個重要環節,只有知道蛋白質的空間結構才能了解它的功能,才能清楚地認識到蛋白質在體內所起的作用及機理。
有機化學家費歇爾(E.Fischer)從1899年開始連續10年從事蛋白質的研究,提出蛋白質的多肽結構理論,榮獲了1902年諾貝爾化學獎。費歇爾借鑒了前人的分析研究方法,將蛋白質水解,得到了氨基酸混合物,再把氨基酸一一分離出來,從而確定出組成蛋白質的氨基酸的種類和數量,使人們對蛋白質組成的認識向前邁出了重要的一步。接下來,費歇爾又運用合成的方法,從各種氨基酸中選出多種組合進行連接。1907年,費歇爾成功地合成了由18個氨基酸分子連結成的鏈狀物質,相對分子質量為1213,并測得這種十八肽具有與天然蛋白質類似的性質。說明蛋白質分子是許多氨基酸由肽鍵相連而成的長鏈高分子化合物,這就是著名的多肽結構理論[2]。
多肽結構理論為化學家研究蛋白質的結構提供了一個框架,但要真正弄清蛋白質的結構,僅僅知道肽鏈的結構還是不夠的。二戰后,多肽鏈中氨基酸順序的測定成為蛋白質研究中重要的新課題。1923年,維格諾德(Vgeneaud)開始研究腦垂體后葉分泌出的激素, 其中一個是控制子宮收縮的后葉催產素, 另一個是使血壓增高的后葉增壓素。他成功地解決了這兩個多肽激素的結構問題。在合成催產素時, 一步一步地把鏈加長, 然后使之形成一個環,最后完成了多肽激素的合成工作。維格諾德由于在生物化學方面所做的重要工作, 特別是第一次合成了多肽激素而獲得了1955年諾貝爾化學獎。美國化學家桑格(F.Sanger)經過多年的研究,找到一種試劑(2,4-二硝基氟化苯(桑格試劑)),用以測定胰島素的分子結構。后經10年的努力,應用逐段分解和逐步遞增的方法,測定出胰島素兩條肽鏈分別含有的21個和30個氨基酸的排列順序和位置,并于1955年測定了胰島素的一級結構,從而為胰島素的實驗室合成奠定了基礎,促進了蛋白質結構的研究,打開了測定蛋白質結構之門,桑格因此而獲得1958年諾貝爾化學獎[3]。桑格后來又因設計出一種測定DNA內核苷酸排列順序的方法,獲1980年諾貝爾化學獎。
蛋白質研究是20世紀50年代的熱點,我國科學家在1958年確立的合成胰島素的課題, 也是建立在當時蛋白質化學發展的基礎之上;并于1965年在世界上首次用人工方法成功地合成了具有生物活性的蛋白質——結晶牛胰島素。
蛋白質的生物活性不僅決定于蛋白質分子的一級結構,而且與其特定的空間結構密切相關。1959年,英國化學家佩魯茨(F.Perutz)和肯德魯(C.Kendrew)利用X射線對血紅蛋白和肌血蛋白等球狀蛋白進行結構分析,提出肌紅蛋白的三維空間結構分子模型,獲1962年諾貝爾化學獎。
在一級結構和空間結構研究的基礎上,科學家開始探索二者之間的關系。1961年,美國化學家安芬森(B.Anfinsen)研究了核糖核酸酶的去折疊和重折疊過程,發現在相同的環境中去折疊的蛋白質都會恢復到原來的空間結構,認為蛋白質鏈會以自由能最低的方式形成三維結構,由此推測蛋白質的折疊密碼隱藏在氨基酸排序中,即所謂的安芬森原則:蛋白質一級排序決定三維結構。化學家穆爾(S.Moore)和斯坦(H.Stein)因共同開發蛋白質分析儀,研究核糖核酸酶分子的活性中心與化學結構,闡明核糖核酸分解酵素的氨基酸序列及其立體結構關系,并開發了利用離子交換管柱分析氨基酸組成的方法,測定出牛胰臟核糖核酸酶分子的氨基酸序列,并闡明了其化學組成與活性機制。他們共同獲得1972年諾貝爾化學獎。
隨著研究的深入,對蛋白質結構的研究越來越多地利用了物理的方法。如電子晶體學(二維電鏡技術)、X射線衍射晶體學、核磁共振技術等。
英國化學家克魯格(A.Klug)自1962年起在劍橋大學的分子生物實驗室從事病毒、染色體等的電子顯微鏡研究,利用X射線照射于電子顯微鏡,闡明蛋白質、核酸的微結構以及核酸和蛋白質復合物的立體結構;并利用電子顯微鏡開發出立體結構分析法,闡明了煙草鑲嵌病毒的三維結構,獲得1982年諾貝爾化學獎。20世紀50年代后,豪普特曼(A.Hauptman)和卡爾勒(J.Karle)建立了以應用X射線分析的直接法測定晶體結構的純數學理論,在晶體研究中具有劃時代的意義,特別是在研究大分子物質如激素、抗生素、蛋白質及新型藥物分子結構方面起了重要作用,他們因此獲1985年諾貝爾化學獎。
德國化學家戴森霍費爾(J.Deisenhofer)、胡貝爾(R.Huber)和米歇爾(H.Michel)確定了光合反應中心的三維結構。將擔負光合作用中心任務的一種膜蛋白質分離出來后,利用X射線分析這種膜蛋白質的晶體,既闡明了光合作用的機制,也闡明了與膜蛋白質有關的神經傳導機制,由于這方面的杰出工作,獲得1988年諾貝爾化學獎。
瑞士聯邦技術研究所的庫爾特·維特里希(K.Wuthrich)、日本化學家田中耕一(K.Tanaka)和美國的約翰·芬恩(J.Fenn)開創性地應用核磁共振光譜鑒定和分析了蛋白質等生物大分子的結構,獲得2002年諾貝爾化學獎[4]。
由上述研究的獲獎歷程可以看出,化學家對蛋白質結構的研究,是一個不斷認識的過程,研究方法由低級向高級發展,由起初的試劑法到X射線衍射晶體學、電子晶體學、核磁共振技術等方法;由蛋白質的氨基酸排列順序測定轉向空間結構的探討。對蛋白質結構所做的詳細分析,使人們對生命過程有了更深入的了解。
2.3.2 蛋白質功能的研究
蛋白質是一類能對環境做出自發響應的、復雜而神奇的大分子化學物質。我們身體內的任何功能,從催化生物化學反應到抵御外來侵略都是蛋白質作用的結果。我們能行走、運動,靠的是肌肉中肌動蛋白的工作;我們身體的骨架是由蛋白質骨膠原加強的;細胞的分裂也是通過蛋白質調節控制的。
人類對于蛋白質功能的認識是循序漸進、不斷發展的。最早被賦予特定生物學功能的蛋白質是血紅蛋白。1864年,利用分光光度計已經觀察到了血紅蛋白具有可逆結合氧氣的能力。同時,人們也逐漸認識到生物能量產生的重要途徑之一是氧氣參與細胞中的氧化反應。這使人們逐漸認識到血紅蛋白的功能是輸送氧氣。
在1926~1930年間,美國化學家薩姆納(B.Sumner)、諾斯魯普(H.Northrop)和斯坦利(M.Stanley)通過結晶和活性測定研究,揭示出具有生物催化功能的酶分子也是蛋白質,這對蛋白質功能的認識是一次飛躍性的發展。在之后的研究工作中,蛋白質功能的研究可分為兩種模式:一是先分離鑒定某種蛋白質,然后再試圖揭示其生理功能。美國諾斯魯普精制酵素與病毒蛋白質,發明了丙酮發酵法,成功地將胃液酵素、胰蛋白酶、胃蛋白酶、胰凝乳蛋白酶、胰蛋白酶原結晶化,并闡明了這些蛋白質的性質,獲得了1946年諾貝爾化學獎。瑞典的蒂塞留斯(K.Tiselius)是1948年諾貝爾化學獎得主,他主要研究電泳及吸附分析,發現了血清蛋白質的復合性。利用蒂塞留斯電泳裝置,將血清蛋白質分成白蛋白及α、β、γ球蛋白,開發出濾紙電泳法、隔間法等,可用于分析氨基酸、蛋白質。
1992年,費希爾(E.Fischer)、克雷布斯(E.Krebs)因發現了蛋白質的可逆磷酸化調節機制;1994年,吉爾曼(G.Gilman)和羅德貝爾(M.Rodbell)因發現G蛋白及其在細胞中傳導信息的作用;1999年,布洛貝爾(G.Blobel)因發現蛋白質由內部信號決定蛋白質在細胞內的轉移和定位;2000年,卡爾森(A.Carlsson)、格林加德(P.Gireengard)、坎德爾(E.Kandel)因研究其他蛋白質相互作用而產生自身調節機制等分別獲得諾貝爾生理或醫學獎[5]。
2004年,諾貝爾化學獎授予了在揭示蛋白質標記與降解的過程中做出卓越貢獻的以色列化學家切哈諾夫(A.Cichanove)、赫爾什科(A.Hershko)和美國化學家羅斯(I.Rose);表彰他們找出了蛋白質分解的秘密——泛素調節的蛋白質降解過程。泛素是由76個氨基酸組成的多肽,在蛋白質降解過程中起類似標簽的作用。這項開創性的研究在進一步揭示生命的奧秘以及在醫學研究中具有重要意義[6]。
蛋白質功能研究的另外一種模式是從已知的特定生理功能(如免疫防御、視覺等)開始,揭示參與的蛋白質種類。如2008年度諾貝爾化學獎獲得者下村修(O.Shimomura)、查爾菲(M.Chalfie)以及錢永健,他們因發現和研究綠色熒光蛋白(簡稱GFP)而獲獎。他們根據水母可以發光的生理現象,經實驗研究發現了綠色熒光蛋白后又進一步研究其功能。通過把GFP連接到一個蛋白質上,可以跟蹤其運動并看到它與其他蛋白質的相互作用。正是得益于GFP的綠光,現在科學家已經能夠在顯微鏡下對單個蛋白質進行追蹤[7]。
從本質上講,蛋白質功能是蛋白質間相互作用的一種關系,因此這對解決蛋白質相互作用問題具有舉足輕重的意義。目前,這方面的研究大致可分為兩個方向:一是從微觀層次建立模型,模擬蛋白質結構間的相互作用。二是宏觀地從系統科學的角度研究蛋白質相互作用網絡,從而探索生化途徑中的代謝和調控功能[8]。
2.3.3 蛋白質組學的發展
20世紀90年代以來,隨著人類及一些物種基因組測序的順利完成,分子遺傳學已形成了較為完備的研究技術和理論體系,生命科學已進入后基因組時代。1995年,Wasinger等人提出了蛋白質組學(proteomies)的科學概念[9]。蛋白質組學就是從整體的角度出發來研究細胞內蛋白質的組成及其活動規律的一門科學。基因雖能提供蛋白質一級結構的信息,但翻譯后的多肽又需經歷翻譯后的加工修飾才能形成具有一定生物學功能的蛋白質。這些加工修飾的類型有200來種,其中最重要的是蘇氨酸、絲氨酸殘基的磷酸化反應;其次是糖基化、乙酰化、脫氨基及多種酸化反應以及蛋白質水解等。換句話說,一個基所對應的蛋白質不是一種而可能是幾種甚至是數十種。再者,包容了數千甚至數萬種蛋白質的細胞是如何運轉的? 或者說這些蛋白質在細胞內是怎樣工作,如何相互作用、相互協調的? 所有這些工作必須由蛋白質組學研究來完成。
蛋白質組學不同于傳統蛋白質學科之處在于它所研究的內容涵蓋了某個機體或某個細胞全部的蛋白質的結構和功能,其研究的目的是闡明生物體全部蛋白質的表達模式與功能模式,內容十分廣泛,包括蛋白質的表達、存在方式(化學修飾)、結構與功能的相互依賴關系以及從某個生物體或某個細胞全部蛋白質整體活動角度揭示與闡明生命活動的基本規律。從技術上講,蛋白質組學可劃分為3種類型: 第一類是蛋白表達蛋白質組學(proteinexpression proteomics ),它是定量研究蛋白質表達的技術;第二類是結構蛋白質組學(structural proteomics ), 主要任務是闡明蛋白質復合體或一個細胞器內的蛋白質的結構;第三類是功能蛋白質組學(functional pro-teomics),主要任務是從分子水平分析亞細胞結構中蛋白質在功能上的組織構成及蛋白質表達譜。
蛋白質的種類與數量在同一機體內的不同細胞中各不相同,即使同一細胞在不同的細胞周期、不同條件下,蛋白質組也是不斷變化的,而且在病理條件下或藥物治療過程中,細胞蛋白質組成與正常生理情況下也不盡相同。其次,蛋白質的翻譯后修飾使一個mRNA所能產生的蛋白質數量遠遠多于基因數量,況且蛋白質不能像DNA那樣能被擴增,低水平蛋白質難于被檢測出來。因此,蛋白質組學研究包括用現代分析技術和手段對蛋白質進行分離、鑒定及圖譜制作等。
3 蛋白質研究的啟示
從百年諾貝爾科學獎來看,蛋白質化學的研究不等同于傳統意義上的化學,它是一個交叉學科,涉及到化學、生物學以及物理學的方法等,因此它可以授予化學獎,也可以授予生理或醫學獎。
蛋白質化學研究歷程預示著在“后基因組時代”的生物化學中,蛋白質結構研究具有戰略性的關鍵地位。以蛋白質為主的生物大分子的功能主要決定于它們的三維結構及其運動。因此,對有機體重要生命活動規律的研究,不僅需要基因的信息,還必須全面了解相關蛋白質的精細三維結構及其功能的關系。例如,80多年前菲比格(G.Fibiger)發現了癌基因,并因此獲得了1926年的諾貝爾生理或醫學獎(后來認為是錯誤的理論)。自那時以來,關于這些基因及其相關蛋白質序列已被作為研究的熱點,但其致癌的分子機理始終不清楚。直到1997年,隨著對朊病毒的精細三維結構的測定,才精確揭示了其致病機理,并因此獲得了諾貝爾獎。美國人普魯西納(S.Prusiner)發現的朊病毒揭示了某些疑難病癥是與特定蛋白質的錯誤折疊和有害結構相關。了解了這些疑難病癥的分子機理,對于推動新藥設計和研發,有重要的現實意義。這些實例充分說明了基因與蛋白質、蛋白質的結構與功能以及蛋白質與生命活動等方面的關系。
蛋白質的研究歷程還表明,研究方法和研究手段上的重大突破,是取得一系列科學成就并導致重大科學發現的關鍵因素。費歇爾所運用的分析合成方法,桑格所運用的一系列物理化學方法,切哈諾夫等人所運用的泛素調節方法,這些方法給他們帶來的成功,有力地證明了這一科學發展規律。
從蛋白質的研究歷程中,我們還可以清晰地看到科學認識是無止境的,不存在永恒不變的科學真理。科學在本質上是相對的、可變的、處在不斷的修正和發展過程中。從費歇爾創立多肽結構理論到桑格揭秘胰島素的結構,再到維特里希描繪蛋白質的三級結構,充分說明了相對性和動態性是科學的本質,也為我們滲透科學價值觀教育提供了良好素材。
參 考 文 獻
[1] 馬靜,葛熙,昌增益.生命科學,2007,19(3):294
[2] 王秋,張瀟文,高鋒.化學教學,2007(1):41
[3] 吳祺.中學化學教學參考,2007(5):38
[4] 張守林,馬宏佳,陶亞奇.化學教育,2003(1):4
[5] 倪菊華,周愛儒.中國生物化學與分子生物學報,2009,25(5):393
[6] 朱永侃.化學教學,2004(12):32
[7] 楊梅,劉艷梅,劉克文.化學教育,2009(1):6
[8] 唐澤耀,戴淑芳,陳華,等.醫學與哲學,2005,26(1):53
[9] 李文凱,李子博.長沙醫學院學報,2007,12(25):31

