價電子對互斥理論與電價理論相結合判定分子的共軛類型*
吳貴升 袁聯群
(上海應用技術學院化學與環境工程學院 上海 201418 )
共軛效應為有機化學與結構化學的重要理論之一,可以有效分析具有共軛效應化合物分子、離子或自由基的穩定性,酸堿性以及反應活性,同時,也可以解釋該類分子的顏色效應[1-2]。通常只含碳原子化合物的共軛效應比較簡單,但是對于一些包含雜原子并且共軛π鍵不是特別明顯的有機分子或離子,共軛效應判定較為困難,這也是學生學習的難點之一。
分子軌道理論、價鍵理論和配位場理論是近代研究化學鍵的3大基本理論,其中分子軌道理論能解釋許多其他理論不能解釋的實驗事實,它認為原子軌道依據一定的規則線性組合成一組全新的分子軌道,偏重于對整個分子進行分析[1-2]。價鍵理論則偏重于對成鍵原子間的價電子對進行分析,其中雜化軌道理論和價電子對互斥理論又為價鍵理論的補充內容,關于二者的關聯和互補已有不少文獻闡述,其基本出發點都是基于分子中中心原子的價電子對采取何種構型使分子能量最低[3-8]。但是利用分子軌道理論和價鍵理論相結合來討論分子化學鍵則鮮有報道。
在分析共軛π鍵時,其先決條件是分子中所有參加共軛的原子必須在同一個平面上,其次是π電子數小于參加成鍵的p軌道的2倍[1-2]。因此判定哪些原子在同一平面,并且確定共軛電子數為分析共軛π鍵形成的兩大重要步驟,但僅通過分子軌道理論有時較難處理。本文通過價電子互斥理論,先確定中心原子的電子對結構,并得出哪些原子處于同一平面;然后根據雜化軌道理論得出中心原子的雜化類型,排除σ鍵,僅分析π鍵,并根據價鍵理論確定參加共軛的原子對共軛π鍵所貢獻的電子數,最終達到確定分子共軛類型的目的。
1 價電子對互斥(VSEPR) 理論要點
VSEPR理論認為[1-2]分子的幾何構型由中心離子或原子周圍的價電子對決定,即總是采取電子對排斥作用最小的幾何結構,從而保持分子的能量最低。價電子對包括成鍵電子對和孤對電子,當知道成對電子和孤對電子的數目時,可以很方便地判定分子的構型。
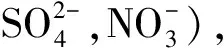
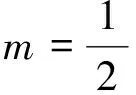



根據總電子對的數目,可以初步判定總電子對的空間構型以及中心原子或離子的雜化類型,與本文相關的類型見表1。

表1 總電子對的數目、空間構型以及中心原子雜化類型之間的關系
2 化合物共軛類型的判別
2.1 判別規則
對于一個共軛類型的化合物,其共軛類型可以根據以下步驟進行判別:
1) 確定中心原子或離子,化合物中不止包含一個中心離子,要逐一判別;
2) 根據VSEPR理論,求其總電子對數,判定雜化類型,并確定其σ鍵以及孤對電子;
3) 確定摒除雜化軌道所用的p軌道,確定其所剩余的p軌道(pz或py和pz,簡稱p剩)的電子數;
4) 根據價鍵理論,分析中心原子或離子相連的原子的p剩電子數,并確定其共軛中心數目;
5) 確保中心原子的σ鍵的成鍵鍵電子對數和孤對電子數目為2的前提下,體系所剩余的電子均放到共軛π鍵上,最終確定共軛電子數。
2.2 實例分析
2.2.1 中心離子僅包含碳原子的體系
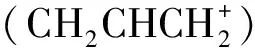
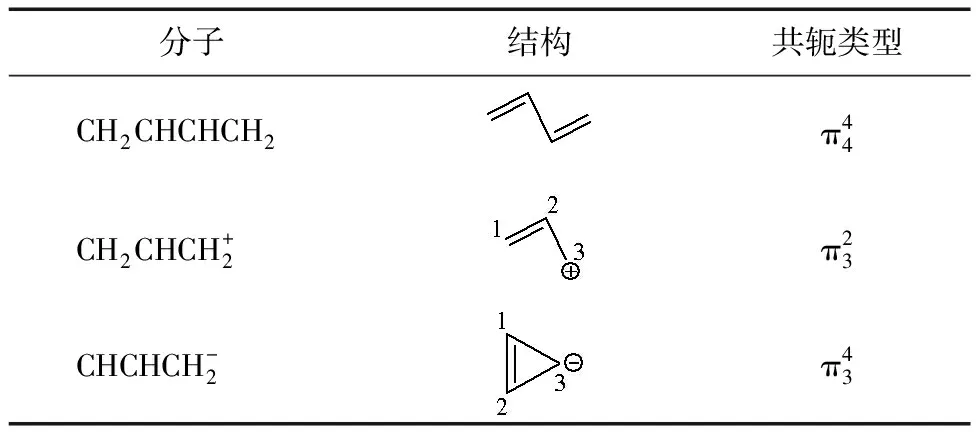
表2 碳原子體系的分子結構與共軛類型
2.2.2 含雜原子的體系

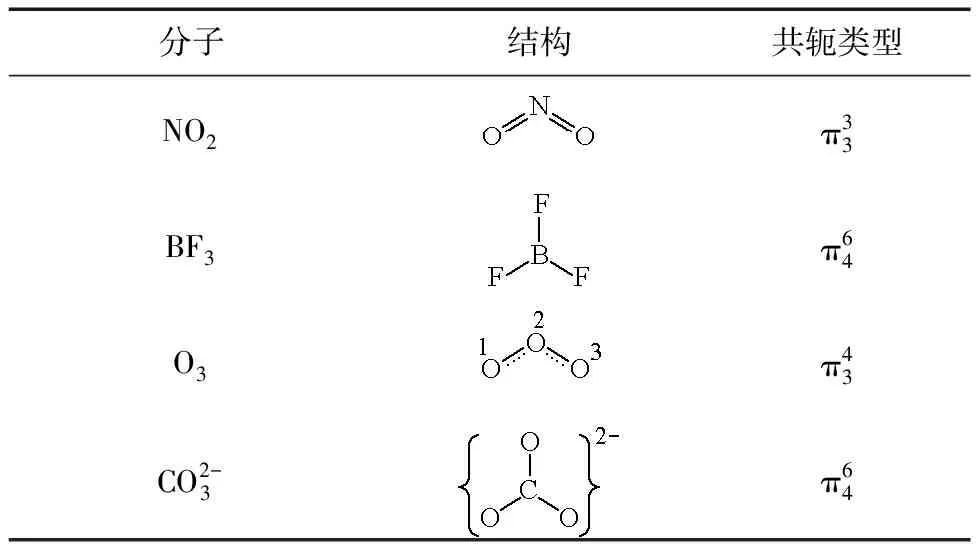
表3 含雜原子體系的分子結構與共軛類型
2.2.3 含有多個共軛體系
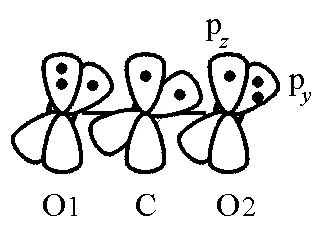
圖1 CO2的分子結構以及共軛類型
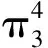
3 結論
采用價電子互斥理論與雜化軌道理論相結合的方法,首先確定中心原子或離子的雜化類型以及總電子對的結構,判定哪些原子在同一平面;然后根據雜化軌道理論得出中心原子的雜化類型,然后摒除σ鍵,僅分析π鍵,并根據價鍵理論,確定參加共軛的原子對共軛π鍵所貢獻的電子數,最終達到確定分子共軛類型的目的。雖然價鍵理論和分子軌道理論是兩種不同的理論,但是兩者結合可以簡化對分子,尤其是含有雜原子分子共軛類型的判別。
參 考 文 獻
[1] 夏少武.簡明結構化學教程.第2版.北京:化學工業出版社,2008
[2] 潘道凱,趙成大,鄭載興.物質結構.第2版.北京:高等教育出版社,1987
[3] 馮軍.中學化學教學參考,2008(Z1):41
[4] 朱斌.四川師范學院學報(自然科學版),2003,24(2):240
[5] 鄧玉良.武警學院學報,2007,23(2):86
[6] 王福民.渭南師范學院學報,2002,17(5):29
[7] 席改卿.邯鄲師專學報,2000,10(3):46
[8] 張文廣,王祖浩.化學世界,2008(3):189
[9] 陳益.化學教學,2007(6):73

