英夫利昔、沙利度胺對大鼠實驗性結腸炎的治療作用及其機制研究*
盛露露 楊曉娣 朱水津 馬天樂 江石湖
上海交通大學醫學院附屬瑞金醫院消化內科(200025)
炎癥性腸病(IBD)包括潰瘍性結腸炎(UC)和克羅恩病(CD),歐美國家比較常見,近年發展中國家的發病率呈上升趨勢[1]。CD是一種慢性非特異性、復發與緩解交替的肉芽腫性炎癥,目前病因尚未明確,缺乏根治藥物,需長期維持用藥,傳統療法存在療效不佳和安全性問題。隨著對IBD發病機制的深入研究,其治療已進入免疫調節分子靶向治療的時代。生物制劑英夫利昔是針對腫瘤壞死因子-α(TNF-α)的單克隆抗體,臨床效果明顯且見效快,但其具有選擇性,且需序列重復用藥,價格昂貴,長期輸注的安全性亦有待證實[2,3]。近年研究表明沙利度胺對TNF-α mRNA具有降解作用,對IBD的療效基本得到肯定。且相對英夫利昔,沙利度胺口服方便、價格低,但應注意其可能的毒副作用[4]。本實驗擬通過制備三硝基苯磺酸(TNBS)大鼠結腸炎模型,并比較英夫利昔、沙利度胺的治療效果,旨在從免疫調節、抑制病理性血管生成、抑制凋亡三方面探討兩者治療IBD的作用機制。
材料與方法
一、材料
1.實驗動物:健康成年雄性Sprague-Dawley(SD)大鼠 46 只,體質量(200±10) g,均購自中國科學院上海生命科學研究院。飼養條件均為SPF級,晝夜節律12 h/12 h,無特殊實驗要求時正常供應飼料和飲水。購入后適應性飼養1周。
2.主要試劑和儀器:50 g/L TNBS溶液(Sigma-Aldrich Co.);英夫利昔(RemicadeTM,美國 Centocor公司惠贈);沙利度胺(商品名:反應停,常州制藥廠有限公司);TRIZOL抽提試劑(Invitrogen by Life Technologies);普通PCR試劑盒、逆轉錄試劑盒、Real-time PCR 試劑盒(TaKaRa Bio Inc.);質粒抽提試劑盒[生工生物工程(上海)有限公司];兔抗大鼠 TNF-α、血管內皮生長因子(VEGF)、caspase-3 多克隆抗體(Abcam plc.);GAPDH 多克隆抗體、HRP標記的山羊抗兔二抗(上海康成生物工程有限公司);TUNEL細胞凋亡檢測試劑盒(南京凱基生物科技發展有限公司);免疫組化試劑盒(福州邁新生物技術開發有限公司)。實時定量PCR儀(Stratagene Mx3000P QPCR System,Agilent Technologies,Inc.);普通 PCR 儀(GeneAmp,PCR system 9700);凝膠成像分析系統(美國Bio-Rad);紫外分光光度計(Pharmacia Biotech,Ultrospec 3000)。
二、實驗方法
1.結腸炎模型的建立和藥物干預:大鼠隨機分為正常對照組(n=10)、結腸炎組(n=12)、英夫利昔組(n=12)和沙利度胺組(n=12)。造模前大鼠禁食不禁水36 h,經乙醚麻醉后,將直徑2 mm的硅膠管從肛門插入腸道深約8 cm處,注入含TNBS 20 mg的50%(v/v)乙醇溶液約 0.8 mL(TNBS 按照 100 mg/kg給藥加上等體積的無水乙醇)[5];正常組給予等量0.9%NaCl溶液灌腸,倒懸位持續5 min。造模后第1 d,觀察各組大鼠一般情況,將制模成功的大鼠納入后續實驗,每天同一時間段給予藥物干預,英夫利昔組:英夫利昔(10 mg/mL)腹腔注射 5 mg/kg[6];沙利度胺組:沙利度胺藥片碾磨成粉狀后溶于橄欖油(50 mg/mL)經管喂,200 mg/kg[7];正常對照組/結腸炎組:每組各一半大鼠分別給予等量橄欖油管喂或0.9%NaCl溶液腹腔注射,連續治療7 d。
2.觀察指標:①大鼠的一般情況:每天固定時間段內觀察大鼠精神狀態、毛發光澤、活動、飲食情況等并記錄體質量變化、大便性狀和便血情況,對后三項行疾病活動指數(DAI)評分[8]。②大體形態損傷指數(CMDI)評分:連續給藥7 d后,處死各組大鼠,取遠端結腸約12 cm,沖洗干凈后行局部結腸CMDI評分[9]。 ③組織損傷指數(TDI)評分:取部分病變腸段組織立即放于40 g/L多聚甲醛液中固定,石蠟包埋后切片行HE染色和TDI評分[10]。
3.Real-time PCR檢測大鼠結腸組織TNF-α、VEGF、caspase-3 mRNA表達:取適量結腸組織勻漿后,按TRIZOL說明書抽提總RNA,逆轉錄成cDNA,行PCR擴增(PCR特異性引物序列見表1)。PCR反應產物電泳鑒定后割膠回收純化。PMD-18T載體連接PCR純化產物,連接產物轉化感受態細菌,繼而行細菌擴增和培養。挑選克隆行PCR鑒定,選取條帶與目的條帶相符的細菌行基因測序。測序結果與Genbank相應序列匹配一致后,抽提菌液質粒,計算基因濃度。將已知基因濃度的質粒逐步10倍稀釋后,行Real-time PCR反應。繪制各個目的基因和管家基因的標準曲線。將各組結腸樣本cDNA行Real-time PCR反應,對照標準曲線,計算各標本中不同基因的拷貝數。
4.蛋白質印跡法檢測 TNF-α、VEGF、caspase-3蛋白表達:取適量結腸組織加入1 mL RIPA勻漿,冰浴30 min后12000 r/min 4℃離心30 min。取上清水煮變性后行SDS-PAGE電泳,然后轉移至硝酸纖維素膜,電壓100 V,時間1 h 30 min,5%脫脂奶粉 37℃封閉 1 h;分別加入兔抗大鼠 TNF-α、VEGF、caspase-3 多克隆抗體(1∶1000 稀釋),4 ℃孵育過夜;加入二抗(1∶3000 稀釋),室溫孵育 1 h,ECL顯影;Image-Pro Plus 6.0軟件行灰度掃描分析蛋白表達的相對值。
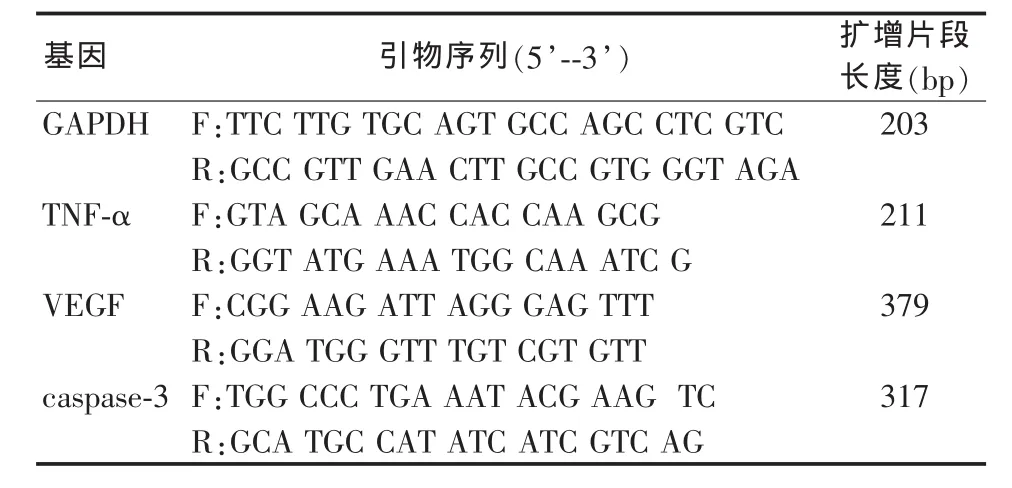
表1 PCR引物序列
5.TUNEL法檢測結腸上皮細胞凋亡:常規脫蠟水化,20 g/L蛋白酶K 37℃消化30 min,PBS漂洗后浸入封閉液(3%H2O2溶于甲醇),室溫封閉10 min,加 rTdT 酶反應液反應 60 min,以 1∶100 稀釋的 Streptavidin-HRP 37℃反應 30 min,DAB顯色,蘇木精復染,封片鏡檢。細胞呈棕褐色顆粒者,并結合細胞形態學改變,判斷為凋亡細胞。
6.免疫組化法檢測 TNF-α、VEGF、caspase-3 表達:常規脫蠟至水;3%H2O2室溫孵育10 min,滅活內源性過氧化物酶活性;正常山羊血清室溫封閉 20 min;滴加兔抗大鼠 TNF-α(1∶2000)、VEGF(1∶200)、caspase-3(1∶100)一抗,4 ℃過夜;加入山羊抗兔二抗室溫靜置或37℃ 1 h;DAB顯色5~10 min,蘇木精復染、脫水、透明、封片、鏡檢。
三、統計學分析
結 果
一、結腸炎模型
1.一般情況:造模后24 h,正常對照組大鼠一般情況基本正常,體質量基本無變化。其余三組大鼠均出現稀便、血便或隱血試驗陽性,毛發豎起,精神不佳,飲食、活動減少,體質量下降。結腸炎組造模后第2~4 d平均DAI評分達到高峰,在造模后7 d內無明顯下降趨勢;而英夫利昔組、沙利度胺組給藥后第2 d開始部分大鼠一般情況稍有改善,稀便、便血減少,活動、飲食增加,同時體質量開始緩慢升高。結腸炎組平均DAI評分明顯高于正常對照組(P<0.01),英夫利昔組、沙利度胺組明顯低于結腸炎組(P<0.01),英夫利昔組平均DAI評分明顯低于沙利度胺組(P<0.01)(見表 2)。
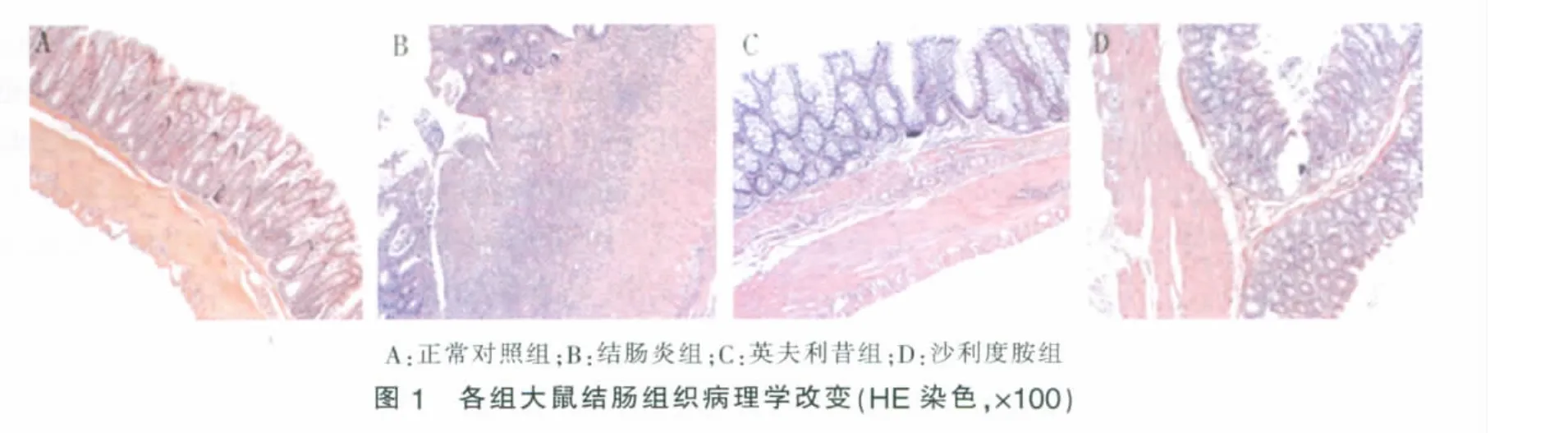
2.大體形態學改變:正常對照組大鼠腸壁薄而光滑,周圍結構清楚,無黏連。結腸炎組大鼠病變部位腸黏膜充血水腫,嚴重節段性糜爛、潰瘍、壞死,腸壁與周圍組織黏連,腸腔狹窄,部分大鼠結腸近端呈巨結腸樣改變,腸壁僵硬易斷;英夫利昔組、沙利度胺組僅表現為局部黏膜充血水腫,糜爛潰瘍基本愈合,腸壁增厚或瘢痕形成,黏連無或減輕,少部分存在輕度糜爛和淺潰瘍。結腸炎組CMDI評分明顯高于正常對照組(P<0.05),英夫利昔組、沙利度胺組明顯低于結腸炎組(P<0.05),英夫利昔組與沙利度胺組相比無明顯差異(P>0.05)(見表2)。
3.組織病理學改變:正常對照組結腸上皮完整,細胞形態正常,固有層腺體排列規則,各層結構清晰;結腸炎組黏膜上皮壞死脫落,潰瘍糜爛形成,全層透壁性炎癥,大量中性粒細胞、淋巴細胞以及少量嗜酸性粒細胞浸潤,可見血管增生和肉芽組織,全層結構消失;英夫利昔組、沙利度胺組潰瘍基本愈合,炎性細胞浸潤減少,腸壁結構基本恢復(見圖1)。結腸炎組平均TDI評分明顯高于正常對照組(P<0.05),英夫利昔組、沙利度胺組明顯低于結腸炎組(P<0.05),兩治療組無明顯差異(P>0.05)(見表 2)。
表2 各組大鼠平均 DAI、CMDI、TDI評分比較()

表2 各組大鼠平均 DAI、CMDI、TDI評分比較()
與正常對照組比較,*P<0.05,**P<0.01;與結腸炎組比較,▲P<0.05,▲▲P<0.01;#與沙利度胺組比較,P<0.01
二、Real-time PCR結果
結腸炎組結腸組織 TNF-α、VEGF、caspase-3 mRNA表達均明顯高于正常對照組(P<0.05),英夫利昔組、沙利度胺組明顯低于結腸炎組(P<0.05),而兩治療組間均無明顯差異(P>0.05)(見表3)。
表3 各組大鼠結腸組織TNF-α、VEGF、caspase-3 mRNA表達比較()
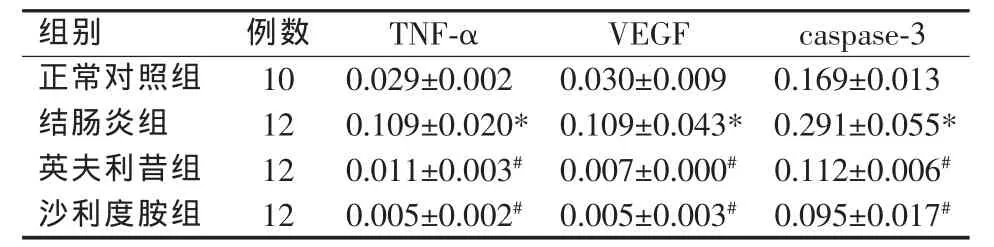
表3 各組大鼠結腸組織TNF-α、VEGF、caspase-3 mRNA表達比較()
*與正常對照組比較,P<0.05;#與結腸炎組比較,P<0.05
三、蛋白質印跡結果
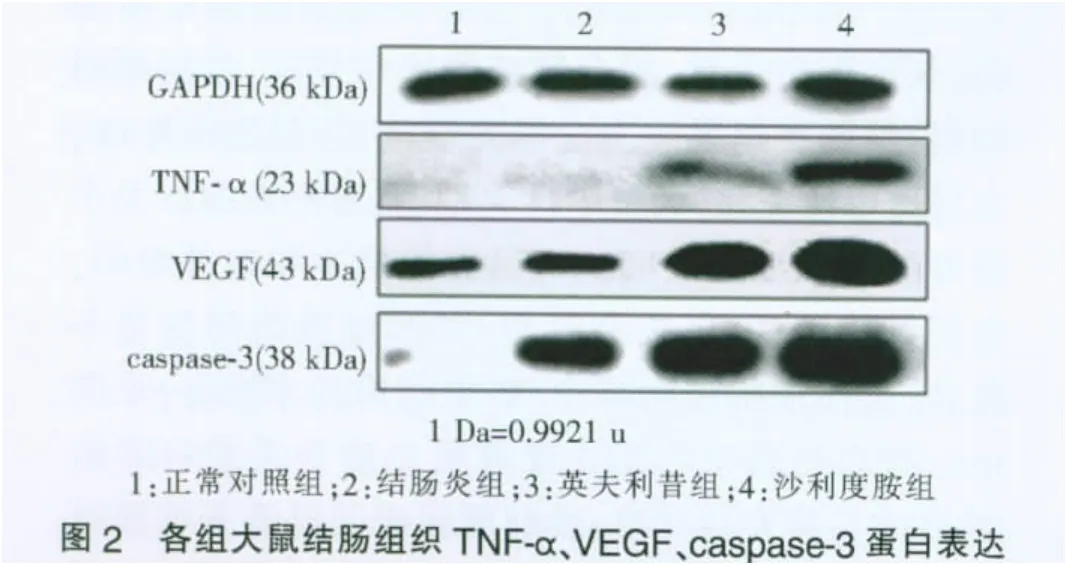
與正常對照組相比,結腸炎組結腸組織TNF-α、VEGF、caspase-3 蛋白表達均明顯升高(P<0.05),英夫利昔組、沙利度胺組蛋白表達較結腸炎組均明顯下降(P<0.05),兩治療組間TNF-α蛋白表達無明顯差異,而英夫利昔組VEGF、caspase-3蛋白表達均明顯低于沙利度胺組(P<0.05)(見圖2)。
四、結腸上皮細胞凋亡
正常對照組大鼠結腸上皮僅少量凋亡細胞,結腸炎組凋亡現象普遍,英夫利昔組、沙利度胺組大鼠結腸上皮細胞凋亡明顯改善(見圖 3)。
五、免疫組化
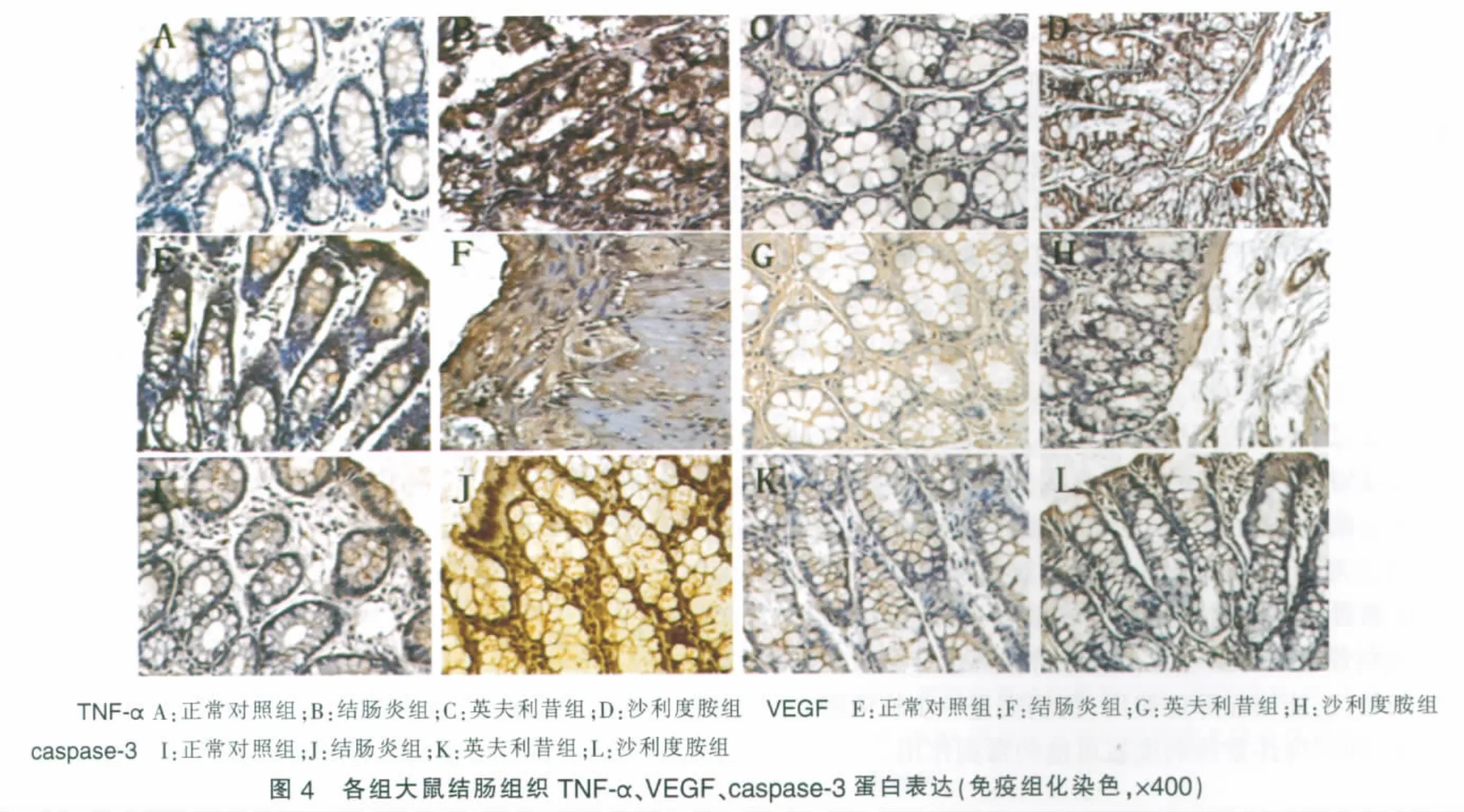
TNF-α在正常對照組大鼠腸組織中基本無表達,結腸炎組腸上皮細胞質中可見明顯棕色強表達,而英夫利昔組、沙利度胺組TNF-α表達明顯減弱,呈散在表達;VEGF在正常對照組表達較弱,結腸炎組腸上皮細胞、血管內皮細胞及其間質炎細胞、成纖維細胞中均可見VEGF強表達,英夫利昔組、沙利度胺組表達均明顯減弱;正常對照組caspase-3表達較弱,結腸炎組表達顯著增強,陽性細胞呈棕黃色,主要位于腸上皮細胞質和部分胞核,英夫利昔組、沙利度胺組表達明顯減弱(見圖4)。
討 論
目前IBD的發病機制尚不清楚,建立適當的腸道炎癥動物模型對研究其發病機制和藥物療效具有積極意義。在多種構建腸道炎癥動物模型的方法中,TNBS/乙醇法目前的應用最為廣泛,該方法誘發的體內免疫反應以Th1型反應為主,類似于人類CD。本實驗采用TNBS/乙醇混合液灌腸制備大鼠結腸炎模型,結腸炎組大鼠平均DAI、CMDI、TDI評分與正常對照組相比均顯著升高,提示造模成功。
腸道黏膜免疫異常在IBD的發病中處于中心地位,反復抗原刺激使腸黏膜免疫細胞聚積、激活,并刺激黏膜固有層細胞因子激活和分泌增加,如白細胞介素(IL)-6、IL-12、TNF-α、干擾素(IFN)-γ 等,促進Th1型炎癥的發生。TNF-α作為一種促炎癥因子和免疫調節因子,在CD免疫反應和病理過程中起關鍵作用。研究表明活動性IBD患者血液、腸上皮組織以及糞便中TNF-α水平均明顯升高[11]。

IBD患者腸黏膜組織反復形成潰瘍和上皮再生,血管生成是IBD中的必然過程。正常情況下,促血管形成因子與抑制因子處于平衡狀態,一旦打破會激活血管系統,使血管過度生成或抑制。促血管形成因子-抑制因子的平衡狀態、微環境以及IBD患者異常表達的細胞因子,可調節生理性血管生成向病理性血管生成的演變,且這種病理性血管生成可能對IBD慢性炎癥的發生和維持起一定作用。近年有學者提出病理性血管生成可作為IBD的發病因素之一[12,13]。另一方面,炎癥和免疫反應對病理性血管生成亦起調節作用。有研究[14]發現,在IL-10基因敲除和DSS誘導的小鼠慢性和急性腸道炎癥模型中,僅在活動性炎癥浸潤的區域可見明顯血管生成。VEGF是最直接的血管內皮細胞促分裂素,與受體結合后發揮一系列促進血管生成的生物學功能。研究[15]表明血清VEGF水平與IBD的疾病活動度密切相關,VEGF是監測血管生成的重要指標之一。
目前,越來越多的研究證實IBD炎癥腸黏膜組織內存在細胞凋亡紊亂。腸上皮細胞是腸黏膜屏障的重要機械屏障,完整的腸上皮細胞不僅能阻止細菌和毒素等大分子滲透至腸黏膜固有層,還能激活固有層免疫細胞以維護腸黏膜屏障功能的穩定,避免黏膜異常免疫反應的發生[16]。研究表明IBD存在大量結腸上皮細胞凋亡,導致上皮損傷,破壞腸黏膜屏障,這也是造成IBD腸道炎癥發生和持續的重要原因[17]。caspase是一類與凋亡密切相關的蛋白水解酶家族,caspase-3在凋亡的執行階段對全部或部分關鍵性蛋白進行酶切,從而引起凋亡的激活或滅活,活化的caspase-3可作為細胞凋亡的標記。
慢性復發頑固性IBD患者的治療仍是臨床面臨的挑戰,高達1/3的IBD患者對傳統治療無效或耐受。對于這部分患者,英夫利昔單抗的療效較好。英夫利昔是針對TNF-α的人鼠嵌合性單克隆抗體,與TNF-α結合后可激活補體和抗體介導的活動性CD4+T細胞和巨噬細胞的細胞毒反應。目前英夫利昔已用于對常規保守治療無效以及活動性瘺管形成的中重度CD患者。雖然生物治療的療效肯定,但部分患者的身體狀況以及經濟情況限制了其使用,且隨著抗抗體產生而降低療效,生物制劑長期使用的安全性問題(如感染、惡性腫瘤等)亦存在諸多爭議[18]。沙利度胺具有抑制TNF-α的作用,近年發現其具有抗炎、免疫調節、抑制血管生成等活性。1997年Wettstein等[19]首先采用沙利度胺治療1例對皮質類固醇治療無效的CD患者,取得良好效果。動物模型研究[20]發現沙利度胺通過下調促炎因子基因的表達而損傷內皮細胞-粒細胞的相互作用,對TNBS誘導的CD樣結腸炎起治療作用;Bariol等[21]發現沙利度胺對IBD患者癥狀的短期療效較好;羅政仁等[22]的隨機對照研究認為沙利度胺對輕中度CD患者有效,且其療效優于傳統藥物柳氮磺吡啶。由此可見,沙利度胺可望成為治療IBD的一種新型藥物。但沙利度胺治療CD的作用機制較復雜,尚未有統一的定論。有學者[23]指出對英夫利昔治療有反應的患者,沙利度胺可作為其維持緩解的橋接治療。
本實驗中,結腸炎組 DAI、CMDI、TDI評分明顯升高,TNF-α、VEGF、caspase-3 mRNA 和蛋白表達亦顯著升高,腸上皮細胞凋亡顯著增加;英夫利昔組、沙利度胺組上述各項指標均較結腸炎組明顯改善,且英夫利昔組VEGF蛋白表達明顯低于沙利度胺組,提示兩種治療藥物對IBD炎癥的療效較好;能有效抑制IBD病理性血管生成,且英夫利昔抑制血管生成的作用略優于沙利度胺;兩種藥物能有效抑制腸上皮細胞凋亡,保護腸黏膜上皮屏障。
總之,本實驗表明英夫利昔、沙利度胺均能通過抑制TNF-α、VEGF、caspase-3表達, 對 IBD 的免疫失衡、病理性血管生成以及腸上皮細胞凋亡起調節作用。對于傳統治療無效且無法使用英夫利昔的IBD患者,沙利度胺可能是治療的一種新選擇;對于英夫利昔治療有反應者,其維持緩解治療可以沙利度胺替代,能明顯降低費用。但仍需進一步臨床研究驗證,同時應注意沙利度胺可能的毒副作用。
1 Bernstein CN,Shanahan F.Disorders of a modern lifestyle:reconciling the epidemiology of inflammatory bowel diseases[J].Gut,2008,57(9):1185-1191.
2 Caspersen S,Elkjaer M,Riis L,et al.Infliximab for inflammatory bowel disease in Denmark 1999-2005:clinical outcome and follow-up evaluation of malignancy and mortality[J].Clin Gastroenterol Hepatol,2008,6(11):1212-1217.
3 Stallmach A,Hagel S,Bruns T.Adverse effects of biologics used for treating IBD[J].Best Pract Res Clin Gastroenterol,2010,24(2):167-182.
4 Ng SC,Chan FK,Sung JJ.Review article:the role of nonbiological drugs in refractory inflammatory bowel disease[J].Aliment Pharmacol Ther,2011,33(4):417-427.
5 Tirosh O,Levy E,Reifen R.High selenium diet protects against TNBS-induced acute inflammation,mitochondrial dysfunction,and secondary necrosis in rat colon[J].Nutrition,2007,23(11-12):878-886.
6 Fries W,Muja C,Crisafulli C,et al.Infliximab and etanercept are equally effective in reducing enterocyte APOPTOSIS in experimental colitis[J].Int J Med Sci,2008,5(4):169-180.
7 Carvalho AT,Souza H,Carneiro AJ,et al.Therapeutic and prophylactic thalidomide in TNBS-induced colitis:synergisticeffectson TNF-alpha,IL-12 and VEGF production[J].World J Gastroenterol,2007,13(15):2166-2173.
8 Murano M,Maemura K,Hirata I,et al.Therapeutic effect of intracolonically administered nuclear factor kappa B(p65)antisense oligonucleotide on mouse dextran sulphate sodium(DSS)-induced colitis[J].Clin Exp Immunol,2000,120(1):51-58.
9 Butzner JD,Parmar R,Bell CJ,et al.Butyrate enema therapy stimulates mucosal repair in experimental colitis in the rat[J].Gut,1996,38(4):568-573.
10 王皓,歐陽欽,胡仁偉.三硝基苯磺酸結腸炎動物模型的建立[J].胃腸病學,2001,6(1):7-10.
11 張子其,劉婧.腫瘤壞死因子與炎癥性腸病[J].中國實用內科雜志,2007,27(18):1439-1442.
12 Danese S,Sans M,de la Motte C,et al.Angiogenesis as a novel component of inflammatory bowel disease pathogenesis[J].Gastroenterology,2006,130(7):2060-2073.
13 Pousa ID,Gisbert JP,Maté J.Vascular development in inflammatory bowel disease (Article in Spanish)[J].Gastroenterol Hepatol,2006,29(7):414-421.
14 Danese S,Sans M,Spencer DM,et al.Angiogenesis blockade as a new therapeutic approach to experimental colitis[J].Gut,2007,56(6):855-862.
15 Kapsoritakis A,Sfiridaki A,Maltezos E,et al.Vascular endothelial growth factor in inflammatory bowel disease[J].Int J Colorectal Dis,2003,18(5):418-422.
16 毛靖偉,王英德.腸黏膜屏障在炎癥性腸病中作用機制的研究進展[J].世界華人消雜志,2010,18(7):695-698.
17 Salim SY,S?derholm JD.Importance ofdisrupted intestinal barrier in inflammatory bowel diseases[J].Inflamm Bowel Dis,2011,17(1):362-381.
18 顧于蓓,袁耀宗.生物制劑治療在炎癥性腸病中的長期療效和安全性問題[J].中華消化雜志,2010,30(1):63-66.
19 Wettstein AR,Meagher AP.Thalidomide in Crohn’s disease[J].Lancet,1997,350(9089):1445-1446.
20 Lienenlüke B,Stojanovic T,Fiebig T,et al.Thalidomide impairment of trinitrobenzene sulphonic acid-induced colitis in the rat-role of endothelial cell-leukocyte interaction[J].Br J Pharmacol,2001,133(8):1414-1423.
21 Bariol C,Meagher AP,Vickers CR,et al.Early studies on the safety and efficacy of thalidomide for symptomatic inflammatory bowel disease[J].J Gastroenterol Hepatol,2002,17(2):135-139.
22 羅政仁,姒建敏.沙利度胺治療克羅恩病療效觀察[J].現代消化及介入診療,2008,13(2):82-83.
23 Sabate JM,Villarejo J,Lemann M,et al.An open-label study of thalidomide for maintenance therapy in responders to infliximab in chronically active and fistulizing refractory Crohn’s disease[J].Aliment Pharmacol Ther,2002,16(6):1117-1124.

