替普瑞酮對萎縮性胃炎大鼠胃黏膜p16、TGF-β1表達的影響
張紅珠 張 琪 張翠萍 孫向紅 王輝明
青島大學醫學院附屬醫院消化科(266003)
慢性萎縮性胃炎(chronic atrophic gastritis,CAG)是一種胃癌癌前狀態,幽門螺桿菌(Helicobacter pylori,Hp)感染與CAG和胃癌,尤其是腸型胃癌的發生密切相關[1],預防和阻止CAG向胃癌進展是一個重要臨床問題。CAG經腸化生、異型增生向胃癌演變的過程中有多種因素參與,包括癌基因激活、抑癌基因失活、細胞周期調節因子調控異常、免疫調節異常等。本實驗以Hp相關CAG大鼠模型為研究對象,通過觀察黏膜保護劑替普瑞酮對模型動物CAG發生、發展過程中腫瘤抑制基因p16和轉化生長因子-β1(TGF-β1)表達的影響,探討替普瑞酮對CAG的防治作用。
材料與方法
一、實驗動物、菌株和藥物
健康雄性清潔級 Wistar大鼠70只,體質量150~200 g,由山東魯抗醫藥股份有限公司質監中心提供(許可證號:SCXK魯20080002)。Hp SS1菌株由江蘇省人民醫院潘曉林博士惠贈。替普瑞酮[衛材(中國)藥業有限公司,商品名:施維舒,50 mg/粒,國藥準字:J20030052,批號:101105A]、阿莫西林(山東淄博新達制藥有限公司,商品名:新達貝寧,250 mg/粒,國藥準字:H37020470,批號:110840)、吲哚美辛(臨汾奇林藥業有限公司,25 mg/片,國藥準字:H14020549,批號:1010031)分別與蒸餾水以 5∶1、17.5∶1、0.9∶1 的質量比例配制成溶液。
二、方法
1.動物分組和CAG模型制備:70只大鼠隨機分為正常對照組(n=20)、CAG模型組(n=25)和替普瑞酮干預組(n=25)。Hp懸液和CAG模型的制備參考既往文獻并加以改進[2~4]。CAG模型組和替普瑞酮干預組先序貫予阿莫西林175 mg/kg(1周)和吲哚美辛9 mg/kg(5 d)灌胃預處理,再予Hp懸液(1×1012cfu/L)灌胃,每次1.5 mL,隔日一次,共6次。灌胃前后分別禁食12 h和4 h。間隔2周后以60%(v/v)乙醇溶液 與20 g/L水楊酸鈉溶液按50∶1的體積比例配制灌胃,每次1 ml/100 g,每日一次,共26周。正常對照組僅以0.9%NaCl溶液灌胃,每次1 ml/100 g,每日一次,共26周。除規定禁食時間外,所有大鼠均自由進食、飲水。
2.替普瑞酮干預:替普瑞酮干預組于乙醇-水楊酸鈉溶液灌胃后5 h以50 mg/kg替普瑞酮灌胃,兩次灌胃間禁食、禁水,共干預26周。
3.一般情況觀察:實驗過程中觀察并記錄各組大鼠一般情況,每周測量體質量,根據體質量變化調整藥物劑量。
4.標本獲取和組織病理學檢查:最后一次灌胃結束后禁食24 h,頸椎離斷法處死大鼠。剪開腹腔,取出全胃,沿大彎側剪開,以0.9%NaCl溶液沖洗干凈,觀察胃黏膜大體形態(黏膜色澤、光滑度、有無損傷以及胃體、胃竇厚度)。標本以4%甲醛溶液固定24 h,沿大彎側橫向取材,包括胃體和胃竇,寬約4 mm,脫水,石蠟包埋,切片,行HE染色。光學顯微鏡下觀察胃黏膜組織學表現。
5.免疫組化染色:采用非生物素即用型二步法。鼠p16單克隆抗體、小鼠超敏二步法免疫組化檢測試劑、兔TGF-β1多克隆抗體、兔二步法免疫組化檢測試劑、DAB試劑盒均為北京中杉金橋生物技術有限公司產品。具體操作步驟參照試劑說明書。
p16、TGF-β1免疫陽性物質呈棕黃色或棕黑色。于光學顯微鏡下隨機選取15個高倍視野(×400),每視野計數200個細胞,計算陽性細胞百分率,取均值。陽性細胞百分率≥10%為陽性,<10%為陰性。
三、統計學分析
應用SPSS 19.0統計軟件,計量資料以百分率表示,組間比較采用χ2檢驗,P<0.05為差異有統計學意義。
結 果
一、一般情況
正常對照組大鼠皮毛白亮光滑,兩眼有神,活動敏捷,食量大,實驗過程中體質量呈上升趨勢,糞便呈黑色顆粒狀,無便溏現象。CAG模型組大鼠皮毛發黃,無光澤,兩眼無神,動作遲緩,拱背,聚集成堆,食量小,起初體質量緩慢上升,第15周后逐漸下降,有便溏現象,四肢和尾部略蒼白。替普瑞酮干預組大鼠皮毛略發黃,兩眼有神,活動較敏捷,食量可,體質量明顯高于同時點CAG模型組,接近正常對照組,起初有便溏現象,藥物干預21 d后癥狀逐漸緩解。CAG模型組第3周、第12周、第15周各有1只大鼠死亡,死亡原因考慮分別與灌胃后嗆咳、窒息、肺部感染可能和腸道巨大膿腫所致的腸梗阻有關;替普瑞酮干預組第2周有2只大鼠死亡,死因為灌胃后嗆咳、窒息。圖1為三組大鼠實驗期間體質量變化情況。
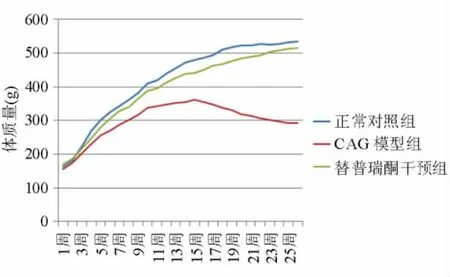
圖1 各組大鼠體質量變化
二、組織病理學表現
1.肉眼觀察:正常對照組胃黏膜呈紅色,表面光滑,無顆粒感,厚度約2 mm。CAG模型組大鼠多有胃腸動力障礙,禁食24 h后胃內仍有殘留食物;胃黏膜以白色為主,多數出現糜爛和陳舊性出血點,以胃竇部為主,黏膜變薄。替普瑞酮干預組胃黏膜紅潤光滑,無出血、糜爛,胃竇部黏膜較正常對照組略變薄(見圖2)。
2.光學顯微鏡觀察:正常對照組胃黏膜腺體排列規整,偶可見炎性細胞浸潤。CAG模型組胃黏膜變薄,腺體間隙較大,排列不規整,腺體出現萎縮,細胞數目減少。替普瑞酮干預組胃黏膜較CAG模型組增厚,腺體排列規整,腺體數目較CAG模型組增多(見圖3)。
三、胃黏膜 p16、TGF-β1 蛋白表達
p16陽性表達主要定位于細胞核(見圖4)。正常對照組、CAG模型組、替普瑞酮干預組胃黏膜p16陽性表達率分別為 95.0%(19/20)、36.4%(8/22)、73.9%(17/23),正常對照組和替普瑞酮干預組顯著高于 CAG 模型組(χ2=15.688,P=0.000;χ2=6.421,P=0.011),但正常對照組與替普瑞酮干預組間差異無統計學意義(χ2=2.114,P=0.146)。
TGF-β1陽性表達主要定位于細胞質(見圖4)。正常組對照、CAG模型組、替普瑞酮干預組胃黏膜TGF-β1 陽性表達率分別為 10.0%(2/20)、81.8%(18/22)、30.4%(7/23),正常對照組和替普瑞酮干預組顯著低于CAG 模型組(χ2=21.663,P=0.000;χ2=12.024,P=0.001),但正常對照組與替普瑞酮干預組間差異無統計學意義(χ2=2.699,P=0.100)。

圖2 各組大鼠胃黏膜大體形態
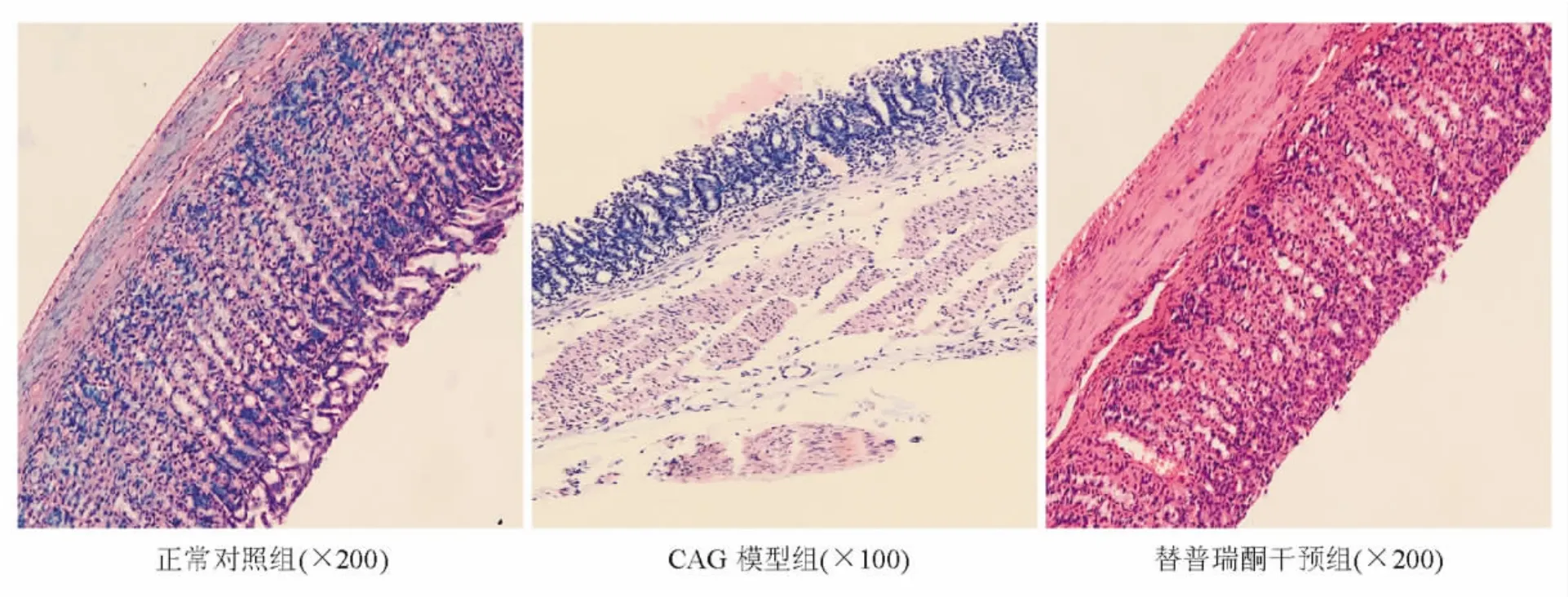
圖3 各組大鼠胃黏膜組織學表現(HE染色)
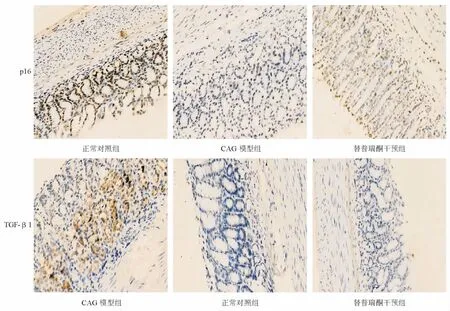
圖4 各組大鼠胃黏膜p16、TGF-β1蛋白表達(免疫組化染色,×200)
討 論
替普瑞酮是一種具備良好理化特性的黏膜保護劑,可促進胃黏膜、胃黏液中主要再生防御因子、高分子糖蛋白、磷脂的合成和分泌,提高胃黏液中的碳酸氫鹽含量,改善受損胃黏膜增生區細胞的增殖能力,增加胃黏膜中前列腺素的生物合成,改善胃黏膜血流,對急、慢性胃炎和胃潰瘍具有良好療效。研究證實替普瑞酮可有效預防非甾體消炎藥(NSAIDs)相關胃黏膜損傷[5,6];并可通過促進胃黏膜熱休克蛋白70(HSP70)表達參與胃黏膜修復[7]。有臨床治療中,替普瑞酮能明顯改善CAG患者的臨床、內鏡和組織學表現,患者胃黏膜炎癥、活動性、腺體數目減少、腸化生和異型增生評分均較治療前顯著降低[8];還能增加慢性非萎縮性胃炎患者的胃黏膜氨基己糖(反映黏蛋白分泌情況)含量,并有效抑制Hp[9]。本研究顯示替普瑞酮干預可明顯改善CAG模型大鼠的一般情況以及胃黏膜大體形態和組織學表現,模型大鼠胃黏膜增厚,腺體數目增多,無出血、糜爛,表明其能修復胃黏膜損傷,且對胃黏膜萎縮有部分逆轉作用。
p16為公認的腫瘤抑制基因,定位于人類染色體9p21,多數惡性腫瘤存在p16基因缺失或突變。p16基因編碼蛋白是一種細胞周期調節蛋白,可與cyclin D競爭性結合細胞周期蛋白依賴性激酶(CDK)4/6,阻止細胞從G1期進入S期,從而對有絲分裂進行負反饋調節,發揮抑癌作用。p16基因缺失、突變或啟動子區甲基化所致的基因功能缺失及其蛋白表達異常參與了惡性腫瘤的發生。現已發現p16基因改變,尤其是基因缺失與腫瘤進展和轉移顯著相關[10,11]。既往研究[12~14]顯示,在大鼠CAG的發生、發展過程中,從正常胃黏膜至萎縮、腸化生和異型增生,p16蛋白表達逐漸降低。本實驗中CAG模型大鼠胃黏膜p16蛋白陽性表達率顯著低于正常大鼠,而接受替普瑞酮干預的模型大鼠p16蛋白陽性表達率較未接受干預者顯著增高,與正常大鼠相比差異無統計學意義,證實p16基因功能缺失和蛋白表達異常參與了CAG的發生、發展,而替普瑞酮干預可通過恢復p16的表達和功能阻止CAG進一步發展。
TGF-β是一類具有多種生物學功能的細胞因子家族,哺乳動物中有 TGF-β1、β2、β3三種亞型表達,其中以TGF-β1含量最高,具有代表性。TGF-β1通過與細胞膜上的TGF-β受體結合,調節細胞增殖、分化和形態形成,在血管生成、損傷修復、免疫抑制、細胞外基質形成、纖維化和腫瘤發生中亦發揮重要作用。腫瘤細胞分泌的TGF-β1可促進初始T細胞向具有免疫抑制作用的調節性T細胞分化,通過抑制宿主免疫系統,使腫瘤逃避機體的免疫監視,從而促進腫瘤發生、侵襲和轉移[15,16]。研究發現從正常胃黏膜、慢性非萎縮性胃炎、CAG、腸化生/異型增生至胃癌,胃黏膜TGF-β1蛋白表達隨黏膜病變的加重而逐漸增高[15,17],同時機體細胞免疫功能逐漸降低[15]。本實驗中CAG模型大鼠胃黏膜TGF-β1蛋白陽性表達率顯著高于正常大鼠,與既往研究結果一致,證實TGF-β1參與了正常胃黏膜由胃癌癌前狀態逐步進展至胃癌的演變過程;而接受替普瑞酮干預的模型大鼠TGF-β1蛋白陽性表達率較未接受干預者顯著降低,與正常大鼠相比差異無統計學意義,表明普瑞酮干預可能通過下調TGF-β1表達抑制CAG的發生、發展。
綜上所述,在大鼠正常胃黏膜向CAG轉變的過程中,胃黏膜 p16蛋白陽性表達率呈下降趨勢,TGF-β1蛋白陽性表達率呈上升趨勢。造模期間給予替普瑞酮干預能修復胃黏膜損傷,部分逆轉胃黏膜萎縮,阻止CAG的發生、發展,其機制可能部分與恢復p16表達和功能以及下調TGF-β1表達有關。上述發現為應用黏膜保護劑替普瑞酮治療CAG并阻止其癌變提供了實驗依據。
1 Correa P,Piazuelo MB.Helicobacter pylori infection and gastric adenocarcinoma[J].US Gastroenterol Hepatol Rev,2011,7(1):59-64.
2 張琳,姚冬梅,姚希賢,等.大鼠Hp相關性慢性胃炎模型的制做[J].中國比較醫學雜志,2004,14(3):161-165.
3 劉翔,盧放根.SPF級BALB/c小鼠感染幽門螺桿菌的造模方法研究[J].臨床和實驗醫學雜志,2007,6(7):3-5.
4 唐旭東,張翠萍,張琪,等.改良式Hp感染萎縮性胃炎大鼠模型的建立[J].青島大學醫學院學報,2012,48(3):247-249,252.
5 馬娟,元剛,陳旻湖.非甾體類消炎藥對胃黏膜的損傷及替普瑞酮預防作用的實驗研究[J].中華醫學雜志,2006,86(40):2868-2873.
6 Ushijima H,Tanaka K,Takeda M,et al.Geranylgeranylacetone protects membranes against nonsteroidal antiinflammatory drugs[J].Mol Pharmacol,2005,68(4):1156-1161.
7 劉瑋麗,姒健敏,孫柯科.胃黏膜保護劑替普瑞酮對慢性萎縮性胃炎大鼠熱休克蛋白表達的影響[J].中國藥學雜志,2005,40(20):1549-1553.
8 張翠萍,孫學國,趙清喜,等.替普瑞酮治療慢性萎縮性胃炎100例[J].世界華人消化雜志,2008,16(10):1069-1073.
9 董秀云,葉嗣懋,林三仁,等.替普瑞酮對幽門螺桿菌和氨基己糖作用的臨床研究[J].北京醫科大學學報,1997,29(5):443-445.
10 Ignatov A,Bischoff J,Schwarzenau C,et al.P16 alterations increase the metastatic potential of endometrial carcinoma[J].Gynecol Oncol,2008,111(2):365-371.
11 Günther T,Schneider-Stock R,Pross M,et al.Alterations of the p16/MTS1-tumor suppressor gene in gastric cancer[J].Pathol Res Pract,1998,194(12):809-813.
12 姒健敏,王良靜,陳淑潔,等.鼠慢性萎縮性胃炎胃黏膜形態特征和細胞增殖調控因子變化研究[J].中華消化雜志,2004,24(8):476-479.
13 王卓才,黃小讓,馬建青,等.疏肝養胃通脈沖劑治療慢性萎縮性胃炎后胃黏膜P16,P53和Rb蛋白表達的觀察[J].山西醫藥雜志,2008,37(10):867-869.
14 陳海金,王惠吉.大鼠胃黏膜萎縮過程中的組織學變化和p16、Bcl-2、增殖細胞核抗原表達[J].胃腸病學,2008,13(1):22-26.
15 李紅平,趙逵,毛萬姮,等.胃黏膜TGF-β1在幽門螺桿菌感染中的表達及與外周血T細胞亞群變化的關系[J].世界華人消化雜志,2010,18(5):506-511.
16 孟欣穎,馬健,江晨,等.胃癌組織中IL-17、IL-6和TGF-β1的表達及其臨床意義[J].胃腸病學,2011,16(10):593-596.
17 張川,江佛湖,戴強,等.胃癌及其癌前病變中轉化生長因子β1、細胞周期蛋白A表達與細胞凋亡關系的研究[J].胃腸病學,2001,6(2):97-99,106.

