應用鄰近擴張皮瓣修復局部晚期乳腺癌根治術后胸壁軟組織缺損
陳 靜, 張晨芳, 周岳平, 梁祎諾
局部晚期乳腺癌根治術面臨的最大問題是胸壁軟組織大面積缺損的修復,現有的修復手段主要是皮瓣轉移和游離植皮術,但均存在不少弊端。我們對13例局部晚期乳腺癌患者在實施乳腺癌根治術的同期以局部擴張皮瓣修復胸壁軟組織大面積缺損,收到滿意效果,現報道如下。
1 臨床資料
1.1 一般資料 本組13例來自東莞市虎門醫院和廣州軍區廣州總醫院2009年1月—2010年11月收治的患者,均為女性,年齡43~65歲,腫瘤發生于左側乳房9例,右側乳房4例。就診時均表現為乳房巨大腫塊,腫瘤侵犯表皮面積最大達15 cm×12 cm,最小達10 cm×9 cm,乳房變形,皮膚及乳頭水腫、增厚,局部潰瘍,腋窩淋巴結腫大融合。經腫塊穿刺活檢,診斷為浸潤性導管癌,其中局部晚期9例,局部晚期伴肝、肺、胸椎轉移4例。
1.2 治療方法 根據每位患者的腫瘤生物學特征、經濟能力、身體狀況不同,制定相應的個體化綜合治療方案。術前給予解救化療、術前化療使腫瘤降期,方案為C500E100F500×6或C500E100F500×3→T100×3。化療2~3個療程后經MRI復查評估療效,見13例患者原發灶腫塊縮小均超過30%(按實體腫瘤療效評價標準計算),伴肝、肺、胸椎轉移的4例患者轉移灶消失。遂于第4個療程化療前,在乳房周圍鄰近腫瘤的安全區域(一般在腫瘤侵犯范圍2 cm以外),根據腫瘤大小預測胸壁缺損范圍,按每修復1 cm2的缺損需注水3.5~4.5 mL的計算公式,埋置相應容量擴張器;定期注水擴張皮瓣,維持擴張至少6周[1],直至達到可修復預計皮膚缺損的面積;第6個療程化療結束后2周(不超過3周),在化療的安全區間內[2]行乳腺癌根治術,同期以擴張皮瓣修復胸壁軟組織大面積缺損。
2 結果
術后病理報告所有病例切緣均陰性,腫瘤累及皮膚組織切除徹底。13例皮瓣全部成活,切口Ⅰ期愈合,無“補丁”樣外觀。術后10天行局部放療,放療結束后行內分泌治療。隨訪時間最長1年9個月,最短1個月,無局部復發及轉移跡象,全身情況良好。
典型病例:魯××,51歲,因發現左乳無痛性腫塊2年,增大伴局部潰瘍半年,于2010年2月收住虎門醫院。體檢見左乳房變形,皮膚、乳頭水腫,乳暈外側見巨大腫塊,局部充血潰爛,皮膚受累面積達15 cm×11 cm(圖1),左腋窩淋巴結腫大、融合、固定。MRI示左乳腫塊41 mm×24 mm×52 mm大小,左腋窩見多個腫大淋巴結,最大 23 mm×16 mm。腹部、胸部CT掃描提示肝內多發占位病變,右下肺結節,胸椎、腰椎多個椎體破壞,考慮轉移瘤。腫瘤標志物 CEA為 3.56 ng/mL、CA15-3為65.94 U/mL,明顯升高。腫塊穿刺活檢診斷為浸潤性導管癌,WHO分級Ⅲ級,免疫組化ER(++),PR(++),CerbB2(++),臨床分期Ⅳ期。因患者經濟條件所限,選擇CEF方案化療:環磷酰胺500 mg/m2、表阿霉素100 mg/m2、氟尿嘧啶500 mg/m2靜脈滴注,d1;21天為1療程。2個療程后評估化療效果:CT掃描示肝、肺原病灶消失,胸、腰椎病灶不明確;乳房腫塊及腋窩淋巴結明顯縮小,MRI示左乳腫塊34 mm×18 mm,左腋下腫大淋巴結縮小為8.8 mm ×5.3 mm,潰瘍面愈合,腫瘤標志物 CEA、CA15-3降至正常,目標病灶最長徑縮小超過35%,臨床達到部分緩解(PR)(圖2)。于第4個療程化療前在左乳房下方、外側距腫瘤1 cm以上的安全區域,根據每修復1 cm2缺損需注水3.5~4.5 mL的計算公式,分別埋置350 mL和200 mL 2個皮膚軟組織擴張器,每5~7天按容量10%的注水量注水擴張皮瓣,直至達到預計可修復胸壁的缺損面積。維持擴張皮瓣6周,于第6個療程化療結束后2周(圖3)檢查見腫塊進一步縮小,B超顯示左乳腫塊20 mm×10 mm,縮小超過61%,腋窩未探及腫大淋巴結,肝臟未見異常。于7月19日行左乳腺癌根治術,以擴張皮瓣修復胸壁軟組織大面積缺損(圖4~6)。術后切口Ⅰ期愈合,外形滿意(圖7)。術后10天如期行放射治療,放療結束后行內分泌治療。
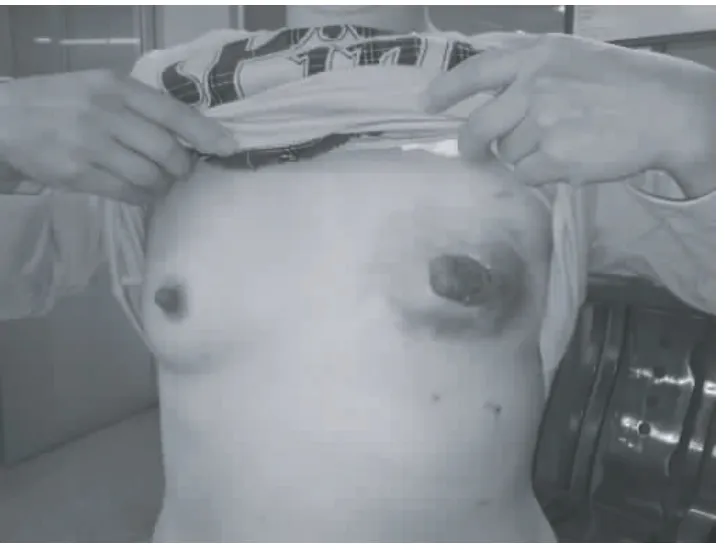
圖1 化療前
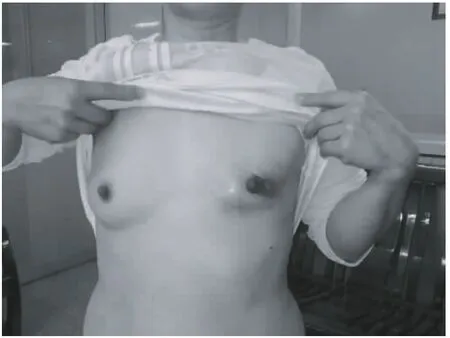
圖2 3個療程化療后
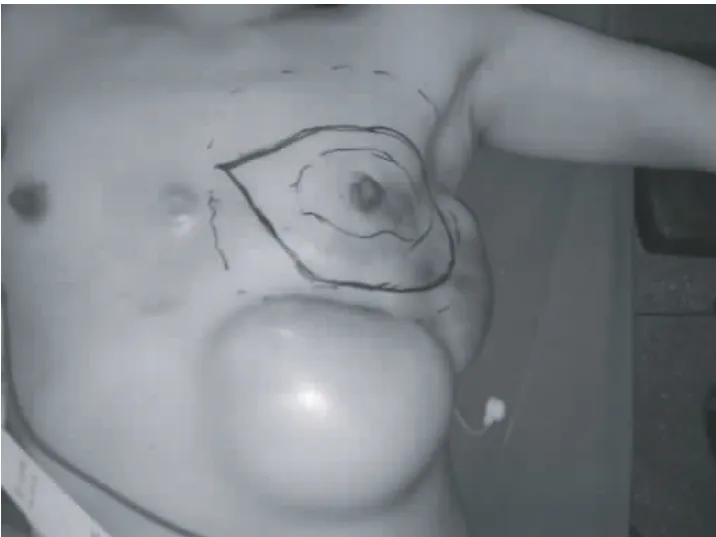
圖3 第6個療程化療后2周術前設計
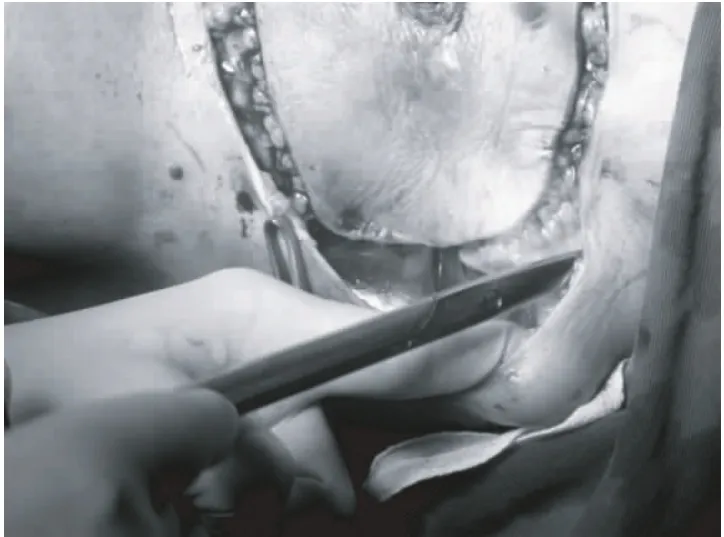
圖4 取擴張器

圖5 乳腺癌根治術中胸壁缺損
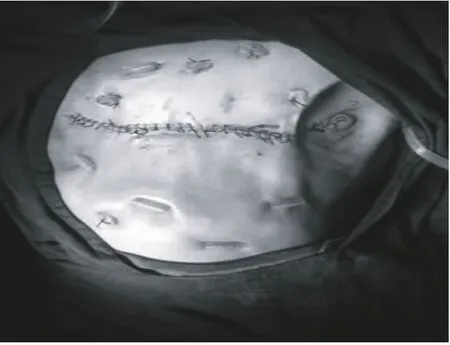
圖6 手術結束
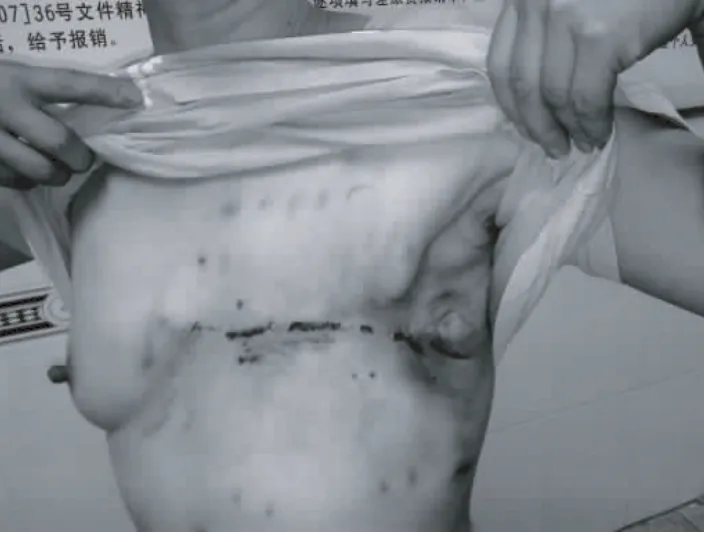
圖7 術后1個月
3 討論
據全球流行病學調查,乳腺癌發病率居于女性惡性腫瘤首位,約占31%,而局部晚期乳腺癌約占就診乳腺癌的10% ~15%[3]。局部晚期乳腺癌是指原發腫瘤直徑>5 cm,已侵及皮膚或胸壁,伴有腋窩淋巴結融合固定和同側鎖骨上、下淋巴結有轉移者。以往,由于治療手段的缺乏,且術后復發率高而將其定義為不可手術乳腺癌,使這部分患者失去了可能的治療和生存機會。
20世紀70年代初,新輔助化療首次被報道用于局部晚期乳腺癌的治療[4],可以使乳腺癌病灶縮小、降期,有助于局部病灶的手術切除,可以早期殺滅乳腺癌的亞臨床病灶,因此,目前在國際上新輔助化療已成為局部晚期乳腺癌標準的治療方案[5]。而且,在無病生存率和總生存率方面,新輔助化療和術后化療的效果是等同的[6]。但局部復發是局部晚期乳腺癌術后最為嚴重的問題,提示受累皮膚的充分切除對減少術后復發至關重要,而充分切除帶來的大面積皮膚軟組織缺損的修復就成了亟待解決的問題。
以往轉移肌皮瓣和游離植皮是局部修復的主要手段,轉移肌皮瓣用于局部晚期乳腺癌修復的最嚴重的問題是供區腫瘤細胞的種植風險,到目前為止,放療科醫生并不接受術后輔助放療應包括供區范圍(如腹部、背部等)以阻止腫瘤種植發生的建議。事實上大面積的同期放療也會給患者帶來嚴重的放射損傷和并發癥,而且大面積的局部缺損以肌皮瓣修復也存在皮膚組織量不足的困難。游離植皮修復面積過大的缺損時,常常因為營養問題出現壞死或部分壞死,而且放療耐受性差,易發生放射性潰瘍。
上世紀80年代,我國開始應用擴張皮瓣進行燒傷瘢痕切除術后的體表修復,并取得了良好的療效,但僅限于良性體表缺損的修復。如此良好的修復技術一直未在腫瘤領域里開展的原因,主要是擴張皮瓣的形成需要一定的時間,在沒有有效的控制腫瘤的方法之前,應用此法有可能使腫瘤進一步發展而延誤治療。隨著術前輔助化療的開展,尤其是作為乳腺癌新輔助化療標準藥物蒽環類藥物的應用,為擴張皮瓣提供了廣闊的應用前景[7]。在術前化療有效、轉移灶消失、腫瘤病灶逐漸縮小降期的同時,在乳房周圍鄰近腫瘤的安全區域根據需要埋置若干個擴張器,定期注水使其表面皮膚面積不斷擴大直至達到可修復預計的皮膚缺損面積,在乳腺癌根治手術的同期行局部軟組織缺損修復。此方法將皮瓣的生養階段融合在腫瘤降期的治療中,皮瓣修復術后傷口的短期愈合,可使后續的放療如期進行,縮短了腫瘤治療的整體時間,有效地減少了患者住院時間和治療費用。此外,局部擴張皮瓣由于提供的組織量足夠,可修復大面積的組織缺損,從而使醫生可以按腫瘤手術原則切除應切除的組織范圍,減少術后局部復發的機會。
總之,鄰近擴張皮瓣與傳統的修復手段相比,無供區的附加損傷,可避免腫瘤細胞沿蒂部發生的供區種植風險,與切除部位的組織來源一致,修復的創面術后無“補丁”樣外觀,局部畸形較輕,放療能顧及供區,耐受性好,不影響腫瘤的整體治療時間,值得在腫瘤領域里開展。
[1] 王煒.整形外科學[M].杭州:浙江科學技術出版社,1999:294.
[2] 徐兵河.乳腺癌[M].北京:北京大學醫學出版社,2005:180.
[3] 張晨芳,田浩,張玉新,等.鄰近擴張皮瓣對局部晚期乳腺癌術中胸壁軟組織缺損的修復[J].中國普通外科雜志,2009,18(11):1229-1230.
[4] Piccart MJ,Kerger J,Tomiak E,et al.Systemic treatment for locally advanced breast cancer:what we still need to learn after a decade of multimodality clinical trials[J].Eur J Cancer,1992,28(2-3):667-672.
[5] 李成貽,陳艷,洪永強,等.46例局部晚期乳腺癌的新輔助化療[J].腫瘤基礎與臨床,2009,22(6):481-483.
[6] 哈里斯.乳腺病學[M].王永勝,于金明,葉林主譯.濟南:山東科學技術出版社,2007:850.
[7] 沈鎮宙,邵志敏.乳腺腫瘤學[M].上海:上海科學技術出版社,2005:275-276.

