重組人胰島素樣生長因子-1對db/db小鼠應激性血糖升高的保護作用*
孔繁強 周樹民 趙榮蘭 孫 蓓 梁東春
機體在遭受感染、創傷等應激作用時會出現糖代謝改變,若糖的生成率超過清除率則會出現應激性高血糖。持續的高血糖可導致高滲血癥、代謝性酸中毒和組織細胞損傷。應激期間血糖控制的好壞是評價糖尿病預后的一個重要指標[1]。對于應激性高血糖,臨床上常采用強化胰島素治療的方案,效果較好[2]。但對于伴有胰島素抵抗(insulin resis?tance,IR)的糖尿病患者,強化胰島素治療卻收效甚微。研究表明,胰島素樣生長因子(insulin-like growth factor,IGF)-1對糖尿病特別是IR糖尿病患者具有較好的治療作用[3]。本文旨在研究重組人IGF(rhIGF)-1對2型糖尿病(T2DM)伴IR小鼠應激性血糖升高的治療作用。
1 材料與方法
1.1 材料 瘦素受體基因缺陷的db/db小鼠(n=30)及同品系的正常小鼠(n=15)均購自南京大學動物中心;rhIGF-1為本實驗室自行制備[4];SYBR green Real-time PCR試劑盒和TaqDNA聚合酶為大連寶生物公司產品;兔抗小鼠葡萄糖轉運酶(GLUT)4多克隆抗體及HRP標記的上樣抗兔IgG購自北京中杉生物技術有限公司;小鼠胰島素測定試劑盒購自瑞典Mercodia公司;小鼠IGF-1測定試劑盒購自美國Antigenix公司。
1.2 方法
1.2.1 db/db小鼠血糖及血胰島素水平的監測 自6周齡后,每隔3 d隨機抽取db/db小鼠及正常對照小鼠各6只,內眥靜脈取血,EDTA抗凝,葡萄糖氧化酶法測定血糖,酶聯免疫吸附法(ELISA)測定血漿胰島素及血漿IGF-1水平。當抽檢的db/db小鼠表現出明顯的高血糖及高胰島素血癥后,測定全部小鼠的血糖、血漿胰島素及IGF-1水平,篩選出血糖升高顯著、胰島素抵抗明顯的db/db小鼠18只用于此后的應激實驗。
1.2.2 應激性高血糖的誘發 選取入選實驗的db/db小鼠及正常小鼠各6只,放入22 cm×20 cm×20 cm的籠內,籠底由細銅柵構成,通過銅柵給予小鼠足底電脈沖刺激。脈沖頻率及強度由電腦控制,每2~10 s間隨機發生1次,電壓50 V,每次持續50 ms,共刺激5 min。刺激前及刺激后每30 min尾靜脈放血,以美國Therasense公司微型血糖儀及血糖試紙測定血糖1次,觀察應激性高血糖的發生及持續時間。同時測定未經電脈沖刺激的db/db小鼠(n=6)及正常小鼠(n=6)的血糖作為對照。4組小鼠分別命名為正常對照小鼠(NC),電刺激的正常小鼠(NS),db/db對照小鼠(DC),電刺激的db/db小鼠(DS)。
1.2.3 應激性高血糖的干預 (1)實驗動物分組:將上述18只入選實驗的db/db小鼠測量血糖后,隨機分為3組。A組(db/db對照組,n=6),頸背部皮下注射等體積溶媒(鹽酸酸化生理鹽水,pH 5.2);B組(胰島素治療組,n=6),頸背部皮下注射胰島素0.45 IU/kg;C組(rhIGF-1治療組,n=6),頸背部皮下注射rhIGF-1 600 μg/kg。D組(正常對照組,n=6),同品系的正常小鼠,頸背部皮下注射等體積溶媒。(2)干預方式:尾靜脈取血測定每只小鼠應激前血糖,隨即進行電脈沖刺激,刺激結束后立即進行上述不同方式的干預,此后每30 min測定血糖1次,共測定3 h。
1.2.4 Real time-PCR檢測骨骼細胞中GLUT4基因表達水平 干 預結束后立即處死各組小鼠,剪取適量骨骼肌組織置于凍存管內,-80℃低溫保存。取0.5g凍存的骨骼肌組織置于1 mL Trizol試劑中,提取組織總RNA。取1.0 μg總RNA逆轉錄合成cDNA。以管家基因β-actin為內參照,采用SYBR green Real time-PCR試劑盒檢測GluT4基因cDNA。小鼠β-actin基因的擴增引物為:上游5′-AGGGTGTGATGGT GGGAATG-3′,下游5′-CTCATTGTAGAAGGTGTGGTGC-3′;PCR產物大小為158 bp。小鼠GluT4基因的擴增引物為:上游5′-CAGAGCTA CAATGCAACG-3′,下 游 5 ′-GCCAATGAGAAAGGAAGAG-3′ ;PCR產物大小為141 bp。PCR反應在Roche LightCyler定量PCR儀上完成,反應條件為95℃預變性15 s,95℃5 s,55℃20 s,72 ℃ 1 0 s,45個循環。靶基因cDNA相對含量以2-ΔCt表示。
1.2.5 Western blot檢測細胞膜中GLUT4 取0.5 g冷凍保存的骨骼肌組織置于1.5 mL RIPA裂解液中充分勻漿,1 000×g離心10 min。取上清液于40 000×g離心1 h,以0.5 mL含1%TritonX-100的PBS溶液懸浮沉淀,20%能量輸出條件下超聲破碎3次,每次30 s,間隔3 min。再次40 000 ×g離心1 h,上清液中含有細胞膜蛋白。BCA法測定膜蛋白樣本的總蛋白質濃度,取50 μg膜蛋白行SDS-PAGE,半干法轉膜,4%脫脂奶粉對NC膜進行封閉,以兔抗小鼠GLUT4多克隆抗體為一抗,HRP標記的山羊抗兔IgG為二抗與膜進行溫浴。將膜于發光底物溶液中浸泡4 min后對X線膠片進行曝光,隨后對膠片進行顯影及定影。
1.3 統計學分析 所 有數據均經SPSS 17.0統計軟件處理,實驗結果以x ±s表示。重復測量資料采用重復測量方差分析,2組比較采用t檢驗,多組比較采用方差分析,兩兩比較采用LSD-t法,以P<0.05為差異有統計學意義。
2 結果
2.1 db/db小鼠相關指標的檢測 與同品系的正常小鼠相比,db/db小鼠在生后8周表現出肥胖、高血糖及明顯的IR癥狀,血IGF-1水平也明顯低于正常對照組,見圖1、表1。
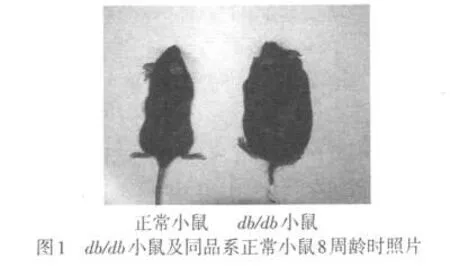
表1 8周齡db/db小鼠及正常對照小鼠的部分指標比較(n=6,±s)
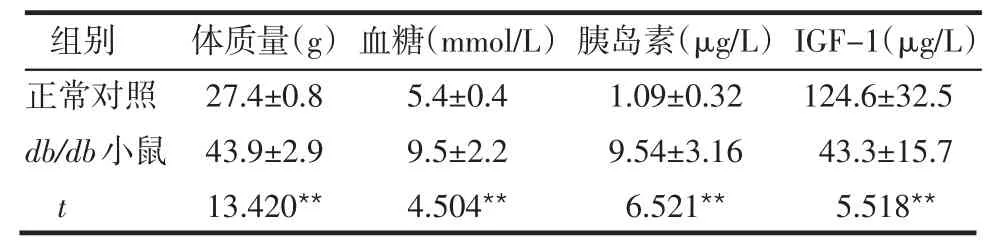
表1 8周齡db/db小鼠及正常對照小鼠的部分指標比較(n=6,±s)
**P<0.01
?
2.2 電脈沖刺激對血糖的影響 電脈沖刺激后,組間血糖水平的差異有統計學意義(F組間=48.915,P<0.05),組內不同時間點血糖水平差異無統計學意義(F時間=1.295,P>0.05),組間和時間無交互效應(F交互=1.046,P>0.05)。電刺激不同時間時,NC組和NS組差異均無統計學意義(P>0.05);DS組和NC、NS、DC組相比,在不同時間點差異均有統計學意義(P<0.05或P<0.001),見表2。
表2 電脈沖刺激對血糖水平的影響(n=6,mmol/L,±s)
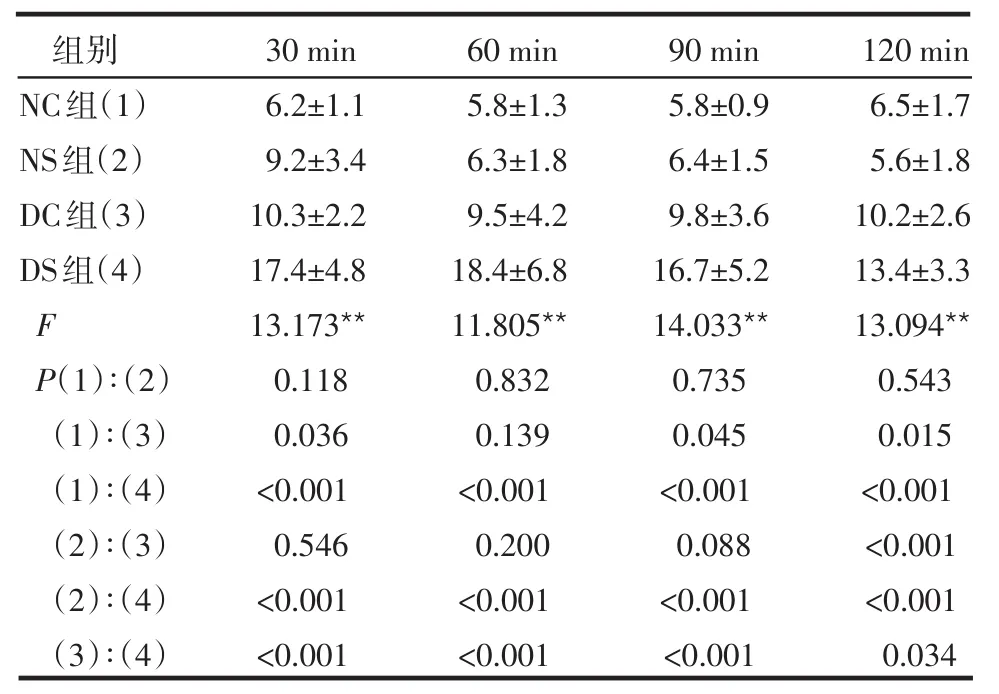
表2 電脈沖刺激對血糖水平的影響(n=6,mmol/L,±s)
**P<0.01
組別NC組(1)NS組(2)DC組(3)DS組(4)F P(1)∶(2)(1)∶(3)(1)∶(4)(2)∶(3)(2)∶(4)(3)∶(4)30 min 6.2±1.1 9.2±3.4 10.3±2.2 17.4±4.8 13.173**0.118 0.036<0.001 0.546<0.001<0.001 60 min 5.8±1.3 6.3±1.8 9.5±4.2 18.4±6.8 11.805**0.832 0.139<0.001 0.200<0.001<0.001 120 min 6.5±1.7 5.6±1.8 10.2±2.6 13.4±3.3 13.094**0.543 0.015<0.001<0.001<0.001 0.034 90 min 5.8±0.9 6.4±1.5 9.8±3.6 16.7±5.2 14.033**0.735 0.045<0.001 0.088<0.001<0.001
2.3 rhGF-1對應激性血糖升高的保護作用 干預后,組間血糖水平差異有統計學意義(F組間=36.947,P<0.05),不同時間點血糖水平差異有統計學意義(F時間=13.880,P<0.05),且組間和時間存在交互效應(F交互=11.769,P<0.05)。與 A組小鼠相比,rhIGF-1干預(C組)在干預60~90 min時即表現出了較明顯的降血糖作用,A、B組與D相比,在不同時間點的血糖水平差異均有統計學意義(P<0.05或P<0.01),見表3。
2.4 骨骼肌中GluT4基因的表達水平 db/db小鼠肌肉組織中GluT4基因的表達水平低于同品系的正常小鼠。給予外源IGF-1可顯著增加GluT4基因的表達,而胰島素則不具有此作用,見表4。
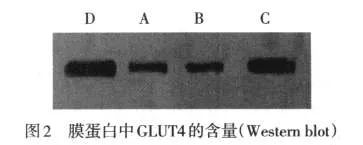
2.5 細胞膜中GLUT4的含量 所提取的膜蛋白經Western blot檢測,在與GLUT4蛋白分子質量相符的位置上出現單一的曝光斑。與正常對照小鼠(D組)相比,db/db對照(A組)及胰島素干預組(B組)細胞膜內GLUT4的含量明顯降低,IGF-1干預(C組)則可使GLUT4的含量顯著增加,見圖2。
表3 應激前和干預后180 min血糖變化情況(n=6,mmol/L±s)
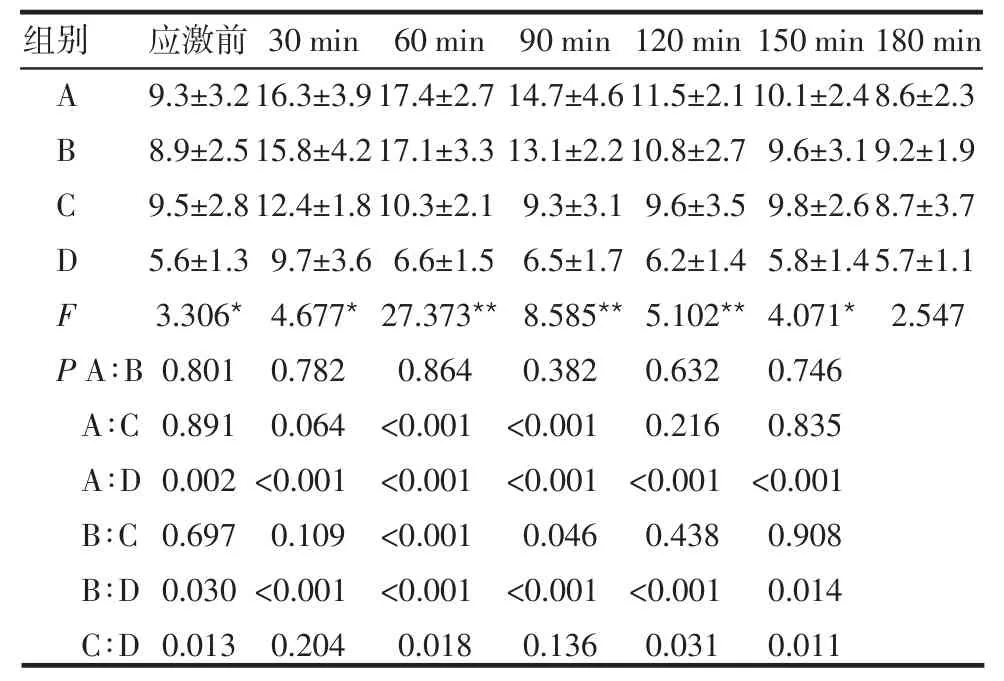
表3 應激前和干預后180 min血糖變化情況(n=6,mmol/L±s)
*P<0.05,**P<0.01
組別ABCDF P A∶B A∶C A∶D B∶C B∶D C∶D應激前9.3±3.2 8.9±2.5 9.5±2.8 5.6±1.3 3.306*0.801 0.891 0.002 0.697 0.030 0.013 30 min 16.3±3.9 15.8±4.2 12.4±1.8 9.7±3.6 4.677*0.782 0.064<0.001 0.109<0.001 0.204 60 min 17.4±2.7 17.1±3.3 10.3±2.1 6.6±1.5 27.373**0.864<0.001<0.001<0.001<0.001 0.018 90 min 14.7±4.6 13.1±2.2 9.3±3.1 6.5±1.7 8.585**0.382<0.001<0.001 0.046<0.001 0.136 120 min 11.5±2.1 10.8±2.7 9.6±3.5 6.2±1.4 5.102**0.632 0.216<0.001 0.438<0.001 0.031 150 min 10.1±2.4 9.6±3.1 9.8±2.6 5.8±1.4 4.071*0.746 0.835<0.001 0.908 0.014 0.011 180 min 8.6±2.3 9.2±1.9 8.7±3.7 5.7±1.1 2.547
表4 骨骼肌中GLUT4基因的表達水平 (±s)
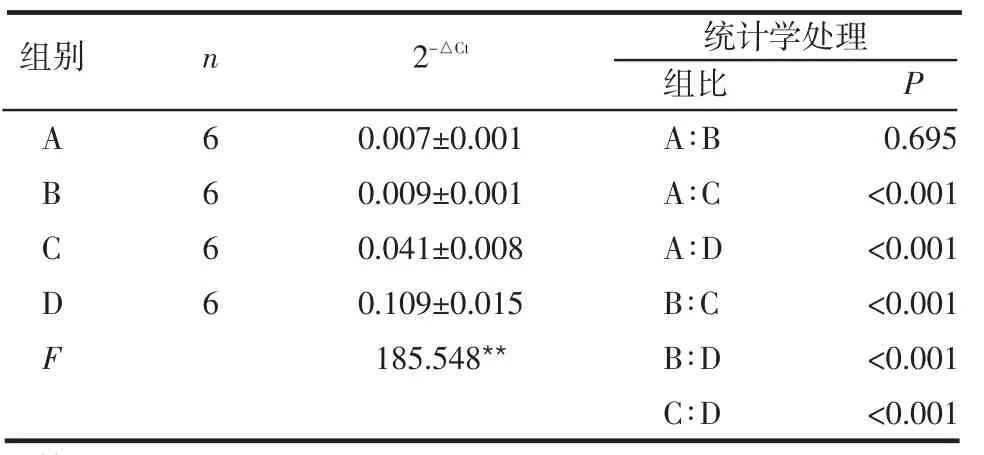
表4 骨骼肌中GLUT4基因的表達水平 (±s)
**P<0.01
ABCDF 0.007±0.001 0.009±0.001 0.041±0.008 0.109±0.015 185.548**組比A∶B A∶C A∶D B∶C B∶D C∶D P 0.695<0.001<0.001<0.001<0.001<0.001統計學處理組別 2-△Ct n 6666
3 討論
無論有無糖尿病,機體在面對刺激時均可能應激性升高血糖[5]。但是糖尿病患者的應激性高血糖難于控制且持續時間長,特別是伴有IR的T2DM患者所表現出的應激性高血糖難以被大劑量的胰島素所控制,預后較差。研究顯示,IGF-1有明顯的降糖作用,特別是對有IR的糖尿病患者作用明顯[6]。本研究以瘦素受體基因缺陷的db/db小鼠為動物模型,模擬伴IR的T2DM病例。db/db小鼠一般在生后6~10周表現出明顯的血糖升高及IR,本研究證實了db/db小鼠在生后8周發生了高胰島素血癥及高血糖。
采用胰島素和IGF-1干預顯示,對于胰島素治療無效的應激性高血糖,IGF-1表現出了良好治療效果。為了探究IGF-1的降糖機制,本文研究了IGF-1對骨骼肌組織中GLUT4表達及轉位的影響。GLUT4所介導的葡萄糖攝取是外周組織利用葡萄糖的主要限速步驟[7],GLUT4可通過表達的增加向細胞膜的轉位這2種途徑來增加細胞對葡萄糖的攝取[8-9]。經Real time-PCR及Western blot檢測證明,IGF-1不但可以顯著增加db/db小鼠骨骼肌組織中GluT4基因的表達,還可增加GLUT4在細胞膜的聚集,并可能因此增加糖的攝取而降低血糖。綜上,IGF-1可有效控制伴IR的T2DM產生的應激性高血糖,其機制與調節GLUT4的表達及轉位有關。
[1]劉曉青,鐘南山,劉思蓓,等.重癥SARS患者接受臨床營養支持及血糖水平胰島素用量與結局的關系[J].中國臨床營養雜志,2003,11(2):80-84.
[2]Van den Berghe G,Wouters P,Weekers F,et al.Intensive insulin therapy in critically ill patients[J].N Engl J Med,2001,345(19):1359-1367.
[3]Ranke MB.Insulin-like growth factor-I treatment of growth disor?ders,diabetes mellitus and insulin resistance[J].Trends Endocrinol Metab,2005,16(4):190-197.
[4]梁東春,左愛軍,吳亞鋒,等.重組人胰島素樣生長因子1的制備[J].天津醫藥,2005,33(7):434-436.
[5]Digman C,Borto D,Nasraway SA Jr.Hyperglycemia in the critically ill[J].Nutr Clin Care,2005,8(2):93-101.
[6]Mohamed-Ali V,Pinkney J.Therapeutic potential of insulin-like growth factor-1 in patients with diabetes mellitus[J].Treat Endocri?nol,2002,1(6):399-410.
[7]Tremblay F,Lavigne C,Jacques H,et al.Dietary cod protein re?stores insulin-induced activation of phosphatidylinositol 3kinase/Akt and GluT-4 translocation to the T-tubules in skeletal muscle of high-fat-fed obese rats[J].Diabetes,2003,52(1):29-37.
[8]Ikemoto T,Hosoya T,Takata K,et al.Functional role of neuroendo?crine-specific protein-like 1 in membrane translocation of GLUT4[J].Diabetes,2009,58(12):2802-2812.
[9]Aksentijevic D,Bhandari S,Seymour AM.Insulin resistance and al?tered glucose transporter 4 expression in experimental uremia[J].Kidney Int,2009,75(7):711-718.

