登革2型病毒包膜蛋白在畢赤酵母中的表達和病毒樣顆粒的組裝*
劉文權,江麗芳,劉 巖,江漢寧,湯云霞,方丹云
2.中山大學中山醫學院微生物學教研室,廣州 510089
登革病毒(Deng ue virus ,DENV)包含4個血清型(DENV-1,DENV-2,DENV-3和 D ENV-4),屬于黃病毒科、黃病毒屬[1]。DENV感染人體后,可引起登革熱(dengue fever,DF)和登革出血熱(dengue hemorrhagic fever,DHF)/登革休克綜合癥(dengue shock syndrome,DSS)[1-2]。根據 WHO統計,全世界每年約有 5千萬 ~1億的人感染DENV,其中約近7萬的人因感染DENV而死亡,大多是15歲以下的兒童[3-4]。目前,世界上尚無可有效預防登革熱的疫苗和相應的治療藥物。
黃病毒的基因組為單股正鏈RNA,分子量約為11kb[5]。病毒基因組 RNA編碼核蛋白(capsid,C)、膜蛋白(membrane,prM/M)、包膜蛋白(envelope,E)3種結構蛋白和7種非結構蛋白(NS1,NS2a,NS2b,NS3,NS4a,NS4b,NS5)[5-6]。其中,prM蛋白在和E蛋白是構成病毒顆粒的主要結構蛋白,在內質網腔中組裝成非感染性的未成熟病毒顆粒[6]。在宿主細胞的弗林蛋白酶(furin)的作用下,prM被切割為pr和M蛋白,并引發病毒顆粒表面的E蛋白發生重排,產生含 M蛋白的病毒顆粒[5-7]。
黃病毒的包膜E蛋白與prM蛋白在體外表達系統中共表達時,可折疊為類似病毒粒子的正確的空間結構的多聚體顆粒-病毒樣顆粒(Virus-like particles,VLPs)也稱作亞病毒顆粒(subviral particles,SVPs)[8]。通過cryo-EM分析TBEV病毒樣顆粒的分子結構,發現VLPs含有60個E蛋白組成的二聚體,呈二十面體結構,顆粒的直徑為30nm左右[8]。Schalich等通過對TBEV的VLP理化特性和生物學活性進行研究后,發現VLPs不僅含有與病毒粒子類似的雙層脂膜和E蛋白二聚體的表面排列,而且具有相似的prM和E蛋白的加工和糖基化修飾,甚至連抗原的表位也一致[9]。VLPs同樣具有類似成熟病毒顆粒的一些生物學活性方面,如VLPs能在低 pH條件下發生結構重排,具有HA活性以及與細胞膜的融合活性等[9]。
我們利用組成型表達的畢赤酵母系統表達登革2型病毒的prM和E蛋白,并利用透射電鏡技術對病毒樣顆粒在酵母細胞內的組裝特性進行了初步分析,為研制登革病毒樣顆粒疫苗的基礎,同時,病毒樣顆粒也將為研究登革病毒的組裝機制和生物學活性提供一個很好的模型。
1 材料與方法
1.1 病毒和細胞株 登革2型病毒(DENV-2)ZS01/01株由本實驗室分離并測定其全基因組序列,提交GenBank,登錄號為EF051521。
1.2 菌株和質粒 大腸桿菌(E.Coli)DH5α和巴斯德畢赤酵母(Pichia pastoris)宿主GS115均由本實驗室保存。畢赤酵母表達載體pGAPZαA為Invitrogen公司產品,含組成型表達啟動子GAP,釀酒酵母α-factor分泌信號肽編碼序列,以及作為選擇標記的編碼Zeocin抗生素的抗性基因。
1.3 酶、生化試劑及抗體 逆轉錄酶(Reverse T ranscriptase),EXTaq酶和各種限制性內切酶均為大連寶生物工程(Takara)公司產品。TRIzol和Zeocin抗生素為Invitrogen公司的產品。抗登革2型E蛋白的單克隆抗體(3H5-1)購自美國ATCC。鼠源抗登革2型病毒血清由本實驗室自制。
1.4 方法
1.4.1 引物設計 擴增含prM信號肽序列的包膜蛋白基因(SprME)的上游引物為DY1(5′-GACTTCGAAAATGAACATCT TGAACAGGAG-3′),斜體字部分為Bsp119Ⅰ酶切位點,下劃線部分代表ATG起始密碼子。下游引物為 DY2(5′-GAATCT AGATCAGGCCTGCACCATGACTC-3′)斜體字部分為XbaⅠ酶切位點,下劃線部分代表終止密碼子。所有引物均在Primer Premier 5軟件上設計,由廣州英駿公司合成。
1.4.2 登革病毒 RNA的抽提與RT-PCR 將DENV-2 ZS01/01病毒株接種C6/36細胞單層上,加入含2%滅活小牛血清的MEM培養液,于37℃培養至出現細胞病變為 “+++”,收集上清進行RNA的制備。RNA的制備的具體方法參照T RIzol抽提試劑盒的說明書。然后以RNA為模板進行RT-PCR擴增目的基因,具體操作步驟為:在一無 RNA酶的EP管中加入模板 RNA(5~10 μ g),2 μ L 下游引物(DY2),2 μ L dNTPs(100mmol/L)和3 μ L DEPC水,將上述成分混勻并在 65℃水浴 5 min,迅速在冰上預冷2 min以上。加入 4 μ L 5×PrimeScript Buffer,1 μ L RNase Inhibitor(40 U/μ L),0.5 μ L Reverse Transcriptase(200 U/μ L)。將上述溶液混勻,在 PCR儀上42℃保溫 30 min,70℃15 min;然后將PCR管置于冰上冷卻,得到的cDNA用于PCR擴增。反應程序為:94℃預變性5 min,然后94℃變性1 min,55℃退火45 s,72℃延伸2 min,循環 30次,再在 72 ℃延伸10 min。
1.4.3 重組表達載體的構建 將獲得的目的基因SprM和穿梭質粒pGAPZαA分別用Bsp119 I和Xba I進行酶切,并利用E.Z.N.A凝膠回收試劑盒回收所需的基因片段。將酶切回收后的基因片段與pGAPZαA載體在 T4 DNA Ligase的作用下進行連接反應。將連接產物轉化DH5α感受態細胞。通過含Zeocin抗生素的 Low Salt LB平板(25 μ g/mL)的篩選獲得轉化的陽性克隆菌落。利用E.N.Z.A質粒抽提試劑盒抽提陽性菌落的質粒DNA進行PCR,酶切和測序鑒定。
1.4.4 畢赤酵母轉化和表達、鑒定 利用Bgl II酶對重組質粒pGAPZA-SprME進行線性化處理,取100 μ L制備好的畢赤酵母感受態細胞,與10 μ g線性化的DNA混合,轉移到預冷的0.2 cm的電轉化杯中,冰浴5 min,在Bio-Rad電轉化儀中進行電擊轉化,電脈沖參數為電壓1500 V,5 ms。取200 μ L轉化細胞分別鋪在含有100 μ g/mL Zeocin的YPD平板上,放置在30℃恒溫培養箱中培養2~3 d至平板長出乳白的酵母轉化菌落。
挑取經PCR鑒定為陽性的含有pGAPZASprME質粒的酵母菌轉化子分別接種于3 mL YPD液體培養基(100μ g/mL Zeocin)中,30℃,250 r/min的條件下有氧振蕩培養12 h。然后按1∶100的比例將菌液接種至100 mL新鮮的YPD發酵培養液中,30℃下,振蕩培養,每隔12 h取出1mL菌液4℃條件下,10 000 r/min離心,分別收集上清和菌體。取80 μ L上清與20 μ L 5×上樣buffer混合,20 μ L裂解后的菌體與等量的2×上樣buffer混合,在沸水中水浴 10 min。樣品冷卻后,進行 SDSPAGE,每個樣品加入兩塊膠相對應的點樣孔。每個點樣孔加30 μ L樣品,在120 V電壓下電泳2 h左右。電泳結束后,將一塊膠進行考馬斯亮藍染色,相同點樣順序的另一塊膠上的蛋白通過電轉移至PVDF膜進行 Western blotting檢測。膜在含0.1%Tween-20和5%脫脂奶粉的TBS中4℃封閉過夜,然后加入適當稀釋的抗E單抗(3H5-1)或者抗DENV-2血清,室溫反應4h。用含0.1%Tween-20的TBS洗膜3次,每次10~15 min。然后加入1∶2 000稀釋的H RP標記羊抗小鼠IgG二抗溶液。室溫輕輕振蕩溫育2h。用TBST洗膜3次。最后加入DAB溶液顯色。
1.4.6 病毒樣顆粒的純化 取5mL的酵母菌體,加入預冷的 1mL Breaking Buffer(50 mmol/L NaH2PO4,1 mmol/L PMSF,1 mmol/L EDTA,5%glycerol,pH 7.4)加入酸洗玻璃珠(Sigma)冰浴條件下裂解細胞。裂解液在4℃條件下,12 000 g離心10 min。將裂解液上清移至含5%~50%的蔗糖梯度溶液的上層,在4℃153 000 g的條件下離心6 h(HATICHI,P80AT轉子)。離心結束后,取絮狀病毒樣顆粒層進行電鏡檢測。
1.4.7 電鏡檢測 細胞透射電鏡觀察:將培養72h的酵母發酵液,2 000 r/min離心5 min,收集菌體。小心的加入前固定液,切勿沖散管底的菌體。然后送中山大學電鏡室進行包埋,切片等程序,將樣品進行電鏡觀察(Philips CM10電子顯微鏡,工作電壓40 kV),并拍照。
免疫電鏡觀察:取90 μ L蔗糖密度梯度離心后的病毒樣顆粒,用PBS稀釋10倍。加入1∶100稀釋的特異性抗DENV-2病毒血清0.1 mL充分混合。置37℃作用1h,后再置4℃過夜。以17 000 r/min,離心60 min。吸去上清,將離心管口倒置于濾紙上,吸去殘留液體,沉淀物中加少量H2O混懸,用2%磷鎢酸 (pH7.2)負染1~2 min,滴加于 400目銅網Fomnvar膜上,用濾紙從銅網邊緣輕輕吸去多余的負染液。將樣品進行電鏡觀察(Philips CM10電子顯微鏡,工作電壓40 kV),并拍照。
2 結果與分析
2.1 包膜蛋白基因RT-PCR結果 以DENV-2 ZS01/01株病毒的RNΑ為模板,利用下游引物DY2進行RT-PCR擴增得到cDNΑ。然后以cDNΑ為模板用上下游引物DY1/DY2擴增SprME片段,PCR產物的大小約為2 250 bp,與預期的分子量相符,見圖1。
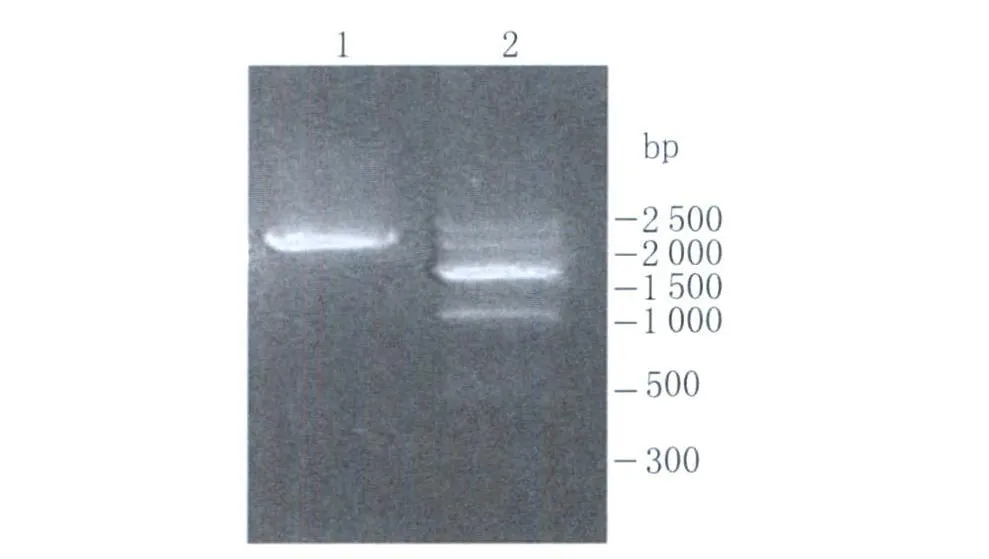
圖1 PCR擴增SprME基因1:SprME基因;2:DNA分子量標準ⅦFig.1 PCR amplication of SprME genes1:SprME;2:DNA markerⅦ
2.2 pGΑ PZΑ-SprME重組載體的構建和鑒定將獲得的SprME基因片段通過內切酶Bsp119 I和Xba I的作用插入pGΑ PZα Α載體的多克隆位點,然后在T4連接酶的作用下進行連接過夜。連接產物轉化DH5α感受態細胞。經Zeocin抗生素篩選后,進行 PCR鑒定,利用載體通用引物 5'pGAP Foward/3'AOX I進行擴增,可見一條大小約為2 300 bp的片段,空載體 pGΑ PZα Α擴增出來的片段大小約為530 bp(圖2A);利用基因特異的上下游引物DY1/DY2檢測,可擴增出一條大小約為2 250 bp的片段,而空載體未擴增出特異性條帶(圖2B)。最后通過測序表明含prM/E基因的重組表達載體構建成功。
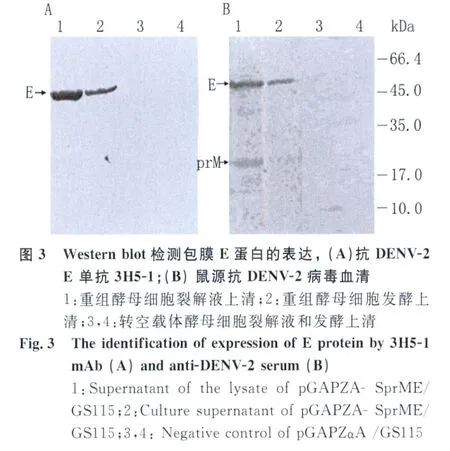
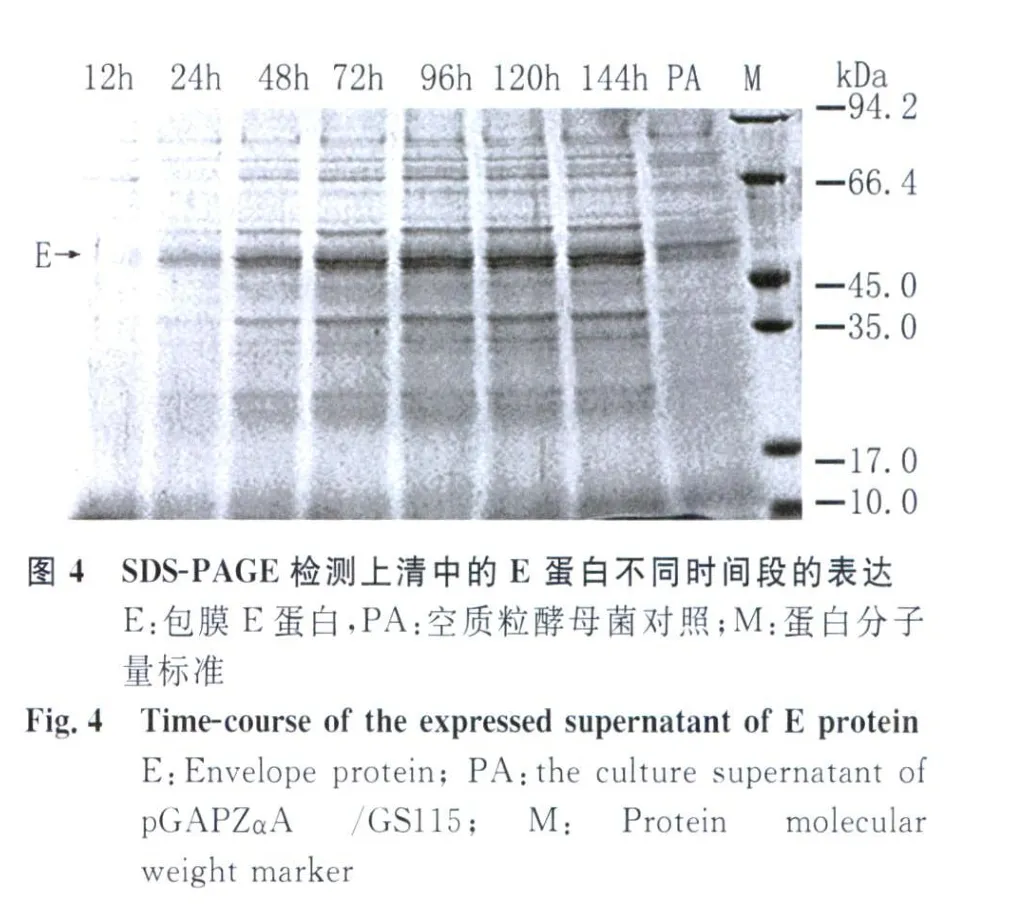
2.3 包膜蛋白的表達和鑒定 將重組質粒pGΑ PZΑ-SprME電轉化畢赤酵母GS115,通過抗生素Zeocin篩選和PCR鑒定后,進行發酵表達。收集不同時間段的發酵上清上清分別進行SDSPΑ GE電泳和Western blot檢測。免疫印跡結果顯示檢測52kDa的蛋白可與DENV-2 E單抗特異結合,表明該蛋白就是酵母菌分泌表達的DENV-2 E蛋白(圖3A);利用抗DENV-2血清孵育后,除檢測到52kDa的E蛋白條帶外,還在約20kDa的位置檢測到prM蛋白帶(圖3B)。利用凝膠掃描系統分析后發現,E蛋白的分泌表達量占總蛋白含量的23%左右,見圖4。
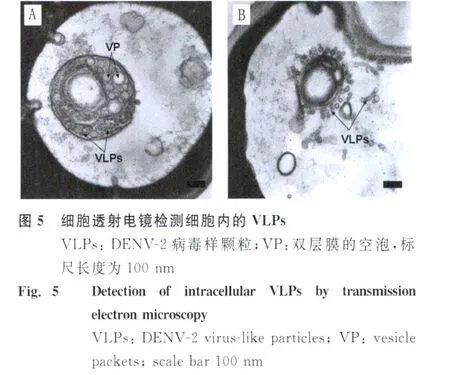
2.4 細胞透射電鏡 用細胞透射電鏡觀察表達病毒樣顆粒的重組酵母菌超微結構。在酵母細胞的胞漿中形成了一個大雙層膜的囊泡結構,大的囊泡中被同樣由雙層膜結構組成的小室間隔,小室里分布著大量的直徑為50-100nm的空泡(vesicle packets,VP)。在小室里的聚集30-50nm的病毒樣顆粒(virus-like particles,VLPs)以散狀或晶格狀排列(圖5A)。當囊泡的外膜破裂后,那些包裹在小室里面的病毒顆粒便被釋放到細胞漿,見圖5B。
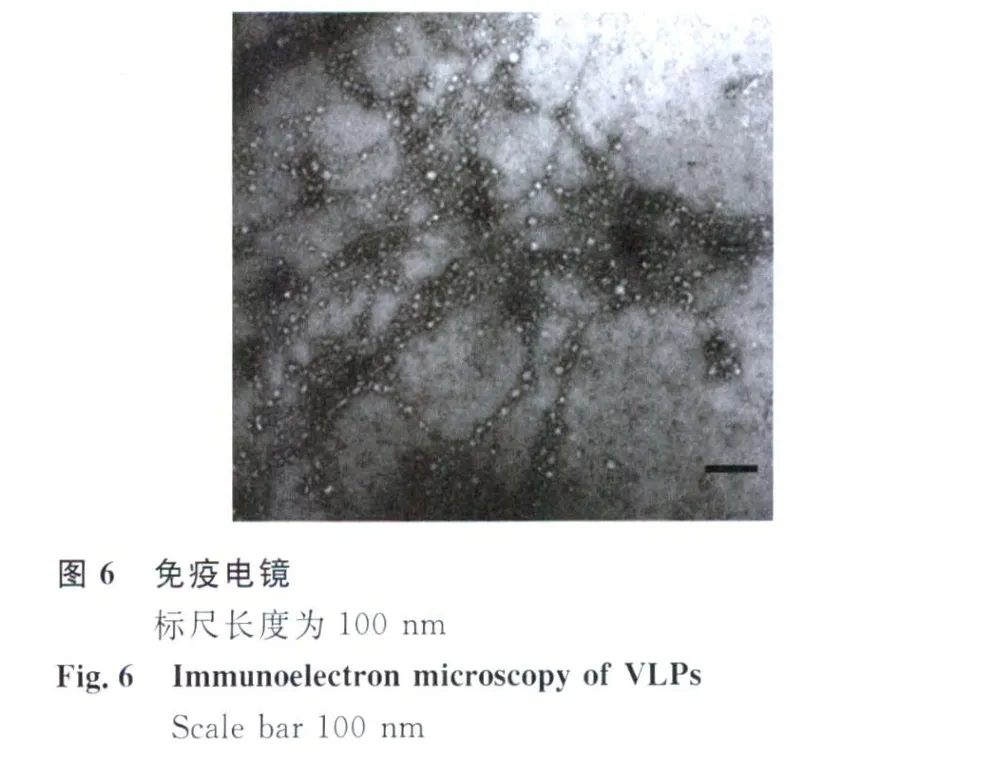
2.5 免疫電鏡觀察VLPs 經蔗糖密度梯度超速離心后,吸取絮狀的病毒樣顆粒,進行免疫電鏡觀察。在抗DENV-2血清的作用下發生聚集,顆粒的形態為規則的球形,直徑約為30-50 nm,見圖6。
3 討 論
病毒樣顆粒(Virus-like particles,VLPs)是指由病毒的一個或多個結構蛋白組裝成的,不含病毒核酸,不能進行自主復制的空心顆粒[10]。VLPs不包含病毒DNA或RNA,因此不存在毒力的回復和同源重組的隱患[10]。同時,VLPs保留了與天然病毒粒子相同或類似的空間構型和誘導中和抗體的抗原表位,具有很強的免疫原性。不但能誘導產生體液免疫,而且可以激發CD4+T細胞的增殖和CT L反應[10]。常用的表達VLPs的系統有桿狀病毒-昆蟲細胞表達系統,酵母表達系統,哺乳動物表達系統和腺病毒表達系統等[10]。其中,釀酒酵母表達系統生產的HBcAg VLPs和四價人乳頭狀瘤病毒(Human papillomavirus,HPV)VLPs疫苗已經通過FDA認證。
黃病毒樣顆粒的形成離不開E蛋白的正確折疊,以及prM和E的相互作用[8-9]。黃病毒的prM信號肽位于在C蛋白的C末端的疏水的區域,發揮引導prM進入粗面內質網功能[7]。通過對共表達黃病毒的prM和E基因發現,在prM的N端引入prM信號肽能有效的引導E蛋白以VLPs的形式分泌到上清中[11]。我們通過生物信息學軟件Singal IP對DENV-2 ZS01/01的C蛋白的C末端進行分析后發現,prM的信號肽序列位于C蛋白的C末端的20-25個氨基酸殘基序列。并用病毒自身的prM信號肽取代了pGAPZα A載體的α信號肽,實驗結果表明在prM信號肽的引導下包膜E蛋白被高水平的分泌表達。
用組成型表達的pGAPZα A載體取代傳統的甲醇誘導型表達載體是本研究的一大亮點。雖然醇氧化酶(alcohol oxidaseI,AOX I)啟動子已被成功應用并表達了多種外源蛋白。但使用甲醇誘導型表達系統存在諸多缺陷,如外源基因的轉錄水平受到甲醇的嚴格調控和誘導,殘留的甲醇對外源蛋白在食品和藥物應用的影響以及發酵培養時不間斷的添加甲醇而帶來的安全隱患等。因此,相比甲醇誘導型啟動子而言,無需甲醇誘導的含3-磷酸甘油醛脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAP)的組成型表達啟動子(GAP啟動子)更具吸引力。一系列的研究證實GAP啟動子具有很強的組成型表達能力,能提供與AOX1啟動子水平相當甚至更高效率的連續性表達[12]。同時,GAP啟動子還被應用在釀酒酵母和畢赤酵母中高水平表達了含HBsAg抗原的病毒顆粒[12]。我們的研究結果也證實GAP啟動子具有高效的表達能力,而且在培養過程中不需更換碳源,發酵工藝更為簡便,因此在表達DENV病毒樣顆粒疫苗方面顯示出了良好的應用前景。
我們還利用透射電鏡對DENV-2 VLPs在酵母細胞內的組裝特點進行了初步研究,發現在酵母細胞的DENV顆粒組裝時誘導了很多50~150 nm的呈圓形或橢圓形,具有雙層脂膜囊泡結構。而這種現象與黃病毒在感染細胞中組裝誘導出來的內質網膜重排是類似的。以前的研究結果表明這些空泡結構與病毒的復制密切相關[13],但由于我們表達的VLPs不含核酸也無核衣殼蛋白,因此我們推斷這些誘生出來的空泡結構與DENV病毒顆粒組裝密切相關。DENV-2 VLPs在酵母細胞中組裝特性說明酵母這種真核細胞能提供模擬登革病毒在感染細胞中的理想的環境。該表達系統可以作為潛在的研究登革病毒包膜蛋白功能和病毒顆粒組裝的理想模型。免疫電鏡結果進一步證實利用酵母系統生產的DENV-2 VLPs具有免疫反應性,利用該表達系統生產登革病毒樣顆粒是制備登革亞單位疫苗的一個有效途徑。
[1]Halstead S.Dengue[J].Lancet,2007,370:1644-1652.
[2]Holmes E,Twiddy S.The origin,emergence and evolutionary genetics of dengue virus[J].Infect Genet Evol,2003,3:19-28.
[3]秦顎德,秦成峰,姜濤.登革病毒與登革病毒病[M].北京:科學出版社,2008.
[4]Whitehead S,Blaney J,Durbin A,et al.Prospects for a dengue virus vaccine[J].Nature,2007,5:518-528.
[5]Kuhn R,Zhang W,Rossmann M,et al.Structure of dengue virus:implications for flavivirus organization,maturation,and fusion[J].Cell,2002,108:717-725.
[6]Zybert I,van der Ende-Metselaar H,Wilschut J,et al.Functional importance of dengue virus maturation:infectious properties of immature virions[J].J Gen Virol,2008,89:3047-3051.
[7]Beeck A,Rouille Y,Caron M,et al.The Transmembrane domains of the prMand E proteins of yellow fever virus are endoplasmic reticulum localization signals[J].J.Virol,2004,78:12591-12602.
[8]Ferlenghi I,Clarke M,Ruttan T,et al.Molecular organization of a recombinant subviral particle from tick-borne encephalitis virus[J].Mol Cell,2001,7:593-602.
[9]Schalich J,Allison S,Stiasny K,et al.Recombinant subviral particles from tick-borne encephalitis virus are fusogenic and provide a model sy stem for studying flavivirus envelope glycoprotein functions[J].J Virol,1996,70:4549-4557.
[10]Noad R,Roy P.Virus-like particles as immunogens[J].TRENDS in Microbiology,2003,11:438-443.
[11]Zhang F,Ma W,Zhang L,et al.Expression of particlulateform of Japanese encephalitis virus envelope protein in a stable transfected Drosophila cell line[J].Virology J,2007,4:17-24.
[12]Vassileva A,Chugh D,Swaminathan S,et al.Expression of hepatitis B surface antigen in the methylotrophic yeast Pichia pastoris using the GAP promoter[J].J Biotechnol,2001,88:21-35.
[13]Uchil P,Satchidanandam V.A rchitecture of the Flaviviral Replication complex[J].J Biological Chemistry,2003,278:24388-24398.

