美洲南瓜裸仁基因的A FLP和SCA R分子標記分析
李智媛,屈淑平,崔崇士
(東北農業大學園藝學院,哈爾濱 150030)
南瓜屬作物的種子屬于雙子葉無胚乳型種子,由種皮和胚組成。根據南瓜種子種皮的結構特點,將南瓜分為有殼南瓜種子和無殼南瓜種子,常見的南瓜為有殼南瓜,而無殼南瓜又稱裸仁南瓜,它是在有殼南瓜中發現的突變體,種殼在發育過程中退化為薄薄的一層膜,目前在美洲南瓜和中國南瓜中均存在無殼突變種[1-4]。控制美洲南瓜裸仁性狀的基因為隱性基因n,控制中國南瓜裸仁性狀的基因為隱性基因n-2[5]。無殼南瓜種皮退化,種仁裸露,可以直接加工食品和食用,免去了脫皮的加工工序和加工損失,降低加工成本,出仁率高,營養豐富,是一種優異的南瓜種質資源[6]。鑒定和克隆南瓜裸仁基因n對于南瓜育種具有重要理論和實踐意義。
本試驗中利用AFLP技術篩選與裸仁基因n緊密連鎖的分子標記,為建立裸仁性狀的分子標記輔助育種,開展裸仁南瓜育種提供技術基礎。
1 材料與方法
1.1 植物材料及基因組DNA的準備
以有殼品系“金輝二號-2”為母本,無殼品系“0516-2”為父本配制正反交組合,F1與無殼親本進行回交,F1代自交獲得F2代種子。2008年春季,在東北農業大學試驗實習基地種植親本、F1、F2及回交世代。對F2代和回交世代進行性狀分離調查,統計分離比率。父母本及各世代材料幼葉在液氮中冷凍,-80℃保存,DNA的提取采用CTAB微量法提取[7]。
1.2 AFLP反應程序
1.2.1 酶切-連接
采用Eco RⅠ和MseⅠ對基因組DNA進行雙酶切,酶切-連接一步進行,預擴引物為E00和M00組合,選擇性擴增采用E+2/M+3引物組合。在總體積25 μL的酶切-連接體系中Eco RⅠ(10 U·L-1)和MseⅠ(10 U·L-1)用量各為 0.25 μL、模板 DNA(50 ng·L-1)1 μL、Eco RⅠ接頭(5 pmol·L-1)和 MseⅠ接頭(50 pmol·L-1)各 0.5 μL、ATP (10 mmol·L-1)0.5 μL、10×Buffer 2.5 μL、T4DNA 連接酶(5 U·L-1)0.3 μL、ddH2O 19.2 μL,混勻后37℃下反應8 h。
1.2.2 預擴增
預擴增體系20 μL,其組成為酶切連接產物5 μL、10×PCR buffer 2 μL、dNTP (10 mmol·L-1)1.6 μL、E00 引物(50 ng·L-1)0.6 μL、M00 引物(50 ng·L-1)0.6 μL、Mg2(+25 mmol·L-1)2.5 μL、Taq酶(5 U·L-1)0.2 μL、ddH2O 8.8 μL。混勻離心后用以下程序擴增:94℃3min;94℃1min,56℃1min,72℃2 min,25 cycles;72℃10 min;4℃保存。
預擴增產物于-20℃保存或稀釋后用于選擇性擴增。
1.2.3 選擇性擴增
選擇擴增體系20 μL,其組成為預擴增產物稀釋 30 倍后取 5.0 μL、10×PCR buffer 2.0 μL、dNTPs(2.5 mmol·L-1)1.6 μL、Mg2+(25 mmol·L-1)1.2 μL、Eco RⅠ引物(50 ng·L-1)1.2 μL、MseⅠ引物(50 ng·L-1)1.2 μL、Taq 酶(5 U·L-1)0.25 μL、ddH2O 7.55 μL。混勻離心后用以下程序擴增:94℃3 min,1 cycle;94℃30 s,65 ℃ 30 s(-0.7 ℃/cycle),72 ℃1 min,12 cycles;94℃30 s,56℃30 s,72 ℃1 min(+1s/cycle),30 cycles;72 ℃ 10 min。
選擇性擴增產物用6%的變性聚丙烯酰胺凝膠電泳分離,銀染法進行染色。
1.2.4 AFLP引物的選擇
根據南瓜作物的基因組大小和堿基偏好性選擇了含有2個選擇性堿基的16個Eco RⅠ引物和含3個選擇性堿基的16個MseⅠ引物配對所得的256對引物組合,對親本間擴增條帶進行比較。選擇親本間多態性好、條帶清晰、重復性強的組合再進行復篩,篩選出20對差異性多和多態性好的引物做為F2代群體分離研究的引物組合(見表1)。
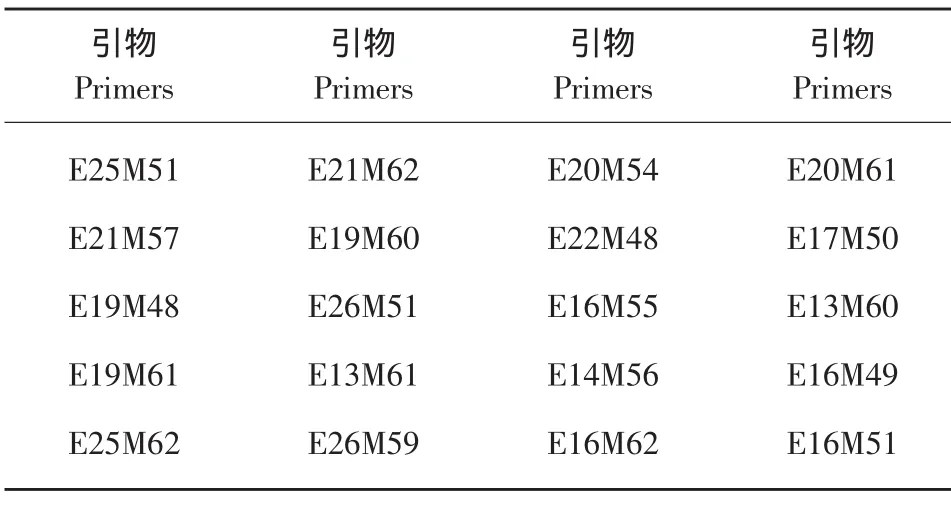
表1 用于金輝二號-2×0516-2 F2群體單株選擇性擴增的特異引物Table 1 Primers used for amplification of F2individual plants of Jinhui2-2×0516-2
1.2.5 AFLP特異片段的克隆、測序和SCAR標記轉化
直接用滅菌的手術刀片從聚丙烯酰胺凝膠上割取含目標片段的膠條,浸泡在30 μL ddH2O中,經37℃過夜,95℃水浴煮30 min,使其充分融化,5 000 r·min-1離心 3 min。浸出液 1 μL 用作PCR擴增模板,反應條件參照選擇擴增試驗,PCR擴增產物采用大連寶生物工程有限公司膠回收試劑盒進行,回收片段與載體選用Promaga生產的pGEM-T Easy vector進行連接、轉化,酶切驗證正確后委托上海生工生物工程技術服務有限公司進行測序。
測序結果用BLAST程序進行序列比對,根據序列結果,利用Primer 5.0設計1對SCAR引物:SCAR-E: 5′CAACATATGGAAAATCGGG 3′,SCAR-M:5′TGCGTACCAATTCGACACT 3′。以父母本、F1和F2各單株的DNA為模板進行SCAR引物的PCR特異性鑒定和獲得SCAR標記。
1.2.6 數據統計
利用χ2檢驗分析各標記是否符合分離比例、AFLP多態性標記與田間種皮性狀的分離情況,應用Mapmaker3.0軟件分析,利用Kosambi函數將重組率轉化為遺傳圖距(cM),以最大圖距50 cM作為劃分連鎖群和排列標記的基準距離。計算連鎖遺傳距離,臨界LOD值取3.0。
2 結果與分析
2.1 種殼性狀分離分析
F1代自交獲得193個F2代植株。通過逐一觀察植株果實種子表現出有殼和無殼兩種性狀,分離比例見表2。在193株F2代單株中發生性狀分離,表現為有殼150株,無殼43株,根據χ2測驗χ2c<χ2(0.05,1)=3.84,差異不顯著,表明南瓜種皮性狀在0.05水平上符合3∶1分離比,即南瓜種皮性狀符合一對等位基因的表型分離比例。回交共獲得100個植株,逐一觀察果實內種子,其植株間同樣出現了無殼與有殼兩種性狀,分離比例見表3。對表3結果同樣進行 χ2c檢驗,計算出 χ2c=2.89,而 χ2(0.05,1)=3.84,χ2c< χ2(0.05,1),檢驗未達顯著水平,表明回交后代種皮性狀分離符合1∶1比例。經以上自交、回交代結果分析表明,無種殼美洲南瓜種皮性狀F2代分離符合孟德爾分離規律,可以確認無種殼(裸仁)性狀是受一對隱性核基因 (nn)所控制,而且獨立遺傳,當隱性基因為同質時,種殼性狀表現為無殼(裸仁)。

表2 F2代群體種皮性狀分離統計Table 2 Segregation ratio of testa trait in F2populations

表3 回交世代種皮性狀分離統計Table 3 Segregation ratio of testa trait in backcross populations
2.2 AFLP引物篩選及F2單株PCR
用256對選擇性擴增引物對親本金輝二號-2和0516-2進行篩選,篩出差異引物94對,篩出率36.72%,每對引物擴增出70~100條譜帶。用基因池進行復篩,篩出20對差異性多和多態性好的引物。利用復篩得到的20對引物對金輝二號-2×0516-2 F2群體的193個單株進行選擇性擴增,共擴增出99條特異帶,平均每對引物擴增出4.95條特異帶。對每個標記的帶型在F2群體中的分布進行χ2測驗,結果基本符合3:1的分離比例,有4個位點產生偏分離(P<0.05),偏分離比例為4.04%。偏分離的原因可能是由于環境因素造成的配子比例失調。
2.3 F2群體遺傳距離的確定
采用Mapmaker3.0軟件對分離群體單株的裸仁性狀和分子標記的分離數據進行連鎖分析,找到4個與裸仁基因n連鎖的分子標記,分別為:E19M60-C、E22M48-B、E13M60-A 和 E25M51-D,遺傳距離分別為8.9、14.1、17.5和18.8 cM(見圖1)。
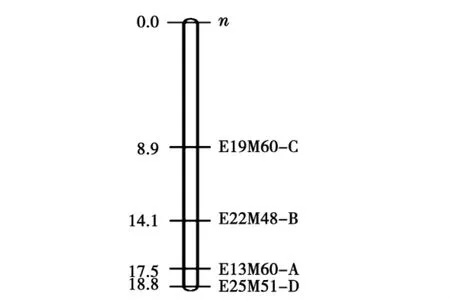
圖1 裸仁基因的AFLP標記定位Fig.1 Location of hull-less n gene by AFLP technique
2.4AFLP標記轉化為SCAR標記
將含有目的DNA片段的菌液,送交上海生工生物工程技術服務有限公司,結果表明序列的兩端均有AFLP引物的結合位點,進一步證實了克隆片段的正確性。堿基序列見圖2,該片段長度為318 bp。

圖2 E19M60-C片段核苷酸序列Fig.2 Nucleotide sequence of fragment E19M60-C
在NCBI中檢索與其具有相似性的基因信息,在核苷酸水平與在氨基酸水平均未發現明顯同源序列,推測為南瓜的一段新的基因片段。
根據測序結果設計SCAR引物,在55℃退火條件下獲得較好的擴增結果,PCR產物大小為318 bp,與其相對應的AFLP標記的擴增結果完全對應,命名為SCAR318。以此引物對F2群體中的單株進行PCR擴增,驗證SCAR標記的穩定性,以確定SCAR標記轉化的正確性。其部分擴增結果見圖3所示。結果表明,該對引物在裸仁親本、F1和F2代表現裸仁的單株中有擴增,在有殼親本及F2代表現有殼的單株中無擴增。
本研究中將AFLP標記轉化成穩定的SCAR標記,長度為318 bp。

圖3 SCAR標記在部分F2代群體的檢測結果Fig.3 Detection of the SCAR marker in F2population and parents
3 討論
無殼南瓜與有殼南瓜正反交,其F1代種子均表現為有殼,表明種殼性狀由核基因控制。雜種F2代有殼與無殼的分離比例為3∶1,回交后代其分離比例為1∶1,表明無種殼(裸仁)性狀的基因突變系點突變,是一對質量性狀,無殼性狀系隱性基因控制,這與以往研究結果相一致[2-4,8]。另外,在F2代中,無殼種子不同程度地出現了帶薄殼現象,這些薄殼的表現從種子邊緣帶殼到全種子表面帶薄殼的連續表現的性狀,推測南瓜種殼性狀遺傳還存在修飾基因控制,通過修飾基因控制這樣一個連續變異的性狀,張仲保等研究表明種子薄殼是數量性狀,系修飾基因控制,估算種子薄殼遺傳中至少涉及38對基因[8],Teppner認為至少受到9個微效基因的修飾[9],表明無種殼性狀遺傳比較復雜,不僅是簡單的單基因控制,還受到其他微效基因的控制,需要進一步明確其遺傳機理。
目前關于南瓜裸仁基因定位研究比較少。Zraidi等利用RAPD、AFLP、SSR和形態標記技術,對南瓜裸仁基因n進行定位,分別對兩個F2代群體分析,找到了7個標記與裸仁基因n距離小于7 cM,其中AW11-420與n相距4 cM[10];本研究以F2群體為試驗材料采用AFLP標記對南瓜種殼性狀進行標記,獲得4個與無殼(裸仁)性狀連鎖的分子標記,最近的標記為E19M60-C。本試驗得出的標記遺傳距離較遠,可能是由于引物數量少及試驗所用群體有關,因此,應加大引物量,構建近等基因系或重組群體以便找到與目標性狀緊密連鎖的標記。另外,獲得的SCAR標記只是在親本、F1和部分F2代中驗證與無殼表型的一致性,還應在其他種質資源材料中進一步驗證其準確性,以確定其使用價值。
4 結論
本研究以有殼品系“金輝二號-2”為母本和無殼品系“0516-2”為父本配制組合,獲得F1、F2和回交世代群體,遺傳規律分析表明,無種殼(裸仁)性狀是受一對隱性核基因所控制,而且獨立遺傳,當隱性基因為同質時,種殼性狀表現為無殼(裸仁)。以193個F2單株作為作圖群體,利用AFLP分子標記技術和集群分析法對與美洲南瓜裸仁基因連鎖的分子標記進行研究,找到了與裸仁基因n連鎖的4個AFLP標記:E19M60-C、E22M48-B、E13M60-A和E25M51-D,連鎖遺傳距離分別為8.9、14.1、17.5和18.8cM。并將E19M60-C轉化為SCAR標記。
[1] 劉恩璞,魏淑琴,王靜華.“80831”裸仁西葫蘆的選育[J].中國蔬菜,1989(2):6-8.
[2] Stuart S G,Loy J B.Comparison of testa development in normal and hull-less seeded strains of Cucurbita pepo L.[J].Botanical Gazette,1983,144:491-500.
[3] 周祥麟.裸仁南瓜的育成及其遺傳性研究[J].園藝學報,1987,14(2):115-118.
[4] 徐東輝,崔崇士,張耀偉.南瓜優勢育種及遺傳規律的研究進展[J].東北農業大學學報,2004,34(5):612-615.
[5]林德佩.南瓜植物的遺傳基因及種間雜交[J].中國西瓜甜瓜,2000(3):41-44.
[6] 孫清芳,崔崇士,張耀偉.南瓜營養品質育種的研究進展[J].東北農業大學學報,2004,35(6):754-758.
[7] Murray M.Rapid isolation of high molecular weight plant DNA[J].Nucleic Acids Res,1980,8(4):321-325.
[8] 張仲保.無種殼西葫蘆某些性狀遺傳規律的研究[J].西北農業學報,2004,13(3):93-96.
[9] Teppner H.Cucurbita pepo(Cucurbitaceae)-history,seed coat types,thincoatedseeds and theirgenetics[J].Phyton,2000,40:1-42.[10] Zraidi A,Stift G,Pachner M,et al.A consensus map for Cucurbita pepo[J].Mol Breeding,2007,20(4):375-388.

