ESAT6和CFP10融合蛋白抑制巨噬細胞自噬體形成的實驗研究*
師長宏 ,毛峰峰,趙 勇,張 海,張彩琴,白 冰,趙善民
自噬在針對結核分枝桿菌(M.tuberculosis,MTB)的固有免疫應答中起重要作用,通過自噬,入侵的 MTB可被巨噬細胞內吞,在自噬相關基因(autophagy-related genes,Atg)的調控下,來源于高爾基復合體、線粒體等細胞器蛋白成分組成新的膜性結構將MTB包裹,形成自噬體結構[1]。自噬體形成后可與溶酶體融合,并借助于溶酶體酸性環境降解入侵的MTB,從而達到免疫防御的目的[2]。但部分MTB毒株可以在巨噬細胞中長期存活,從而逃避巨噬細胞的免疫殺傷作用,提示可能存在某些免疫逃逸機制。ESA T6和CFP10是結核分枝桿菌重要的毒力因子,參與MTB的致病過程[3]。本研究通過雷帕霉素誘導的自噬模型,觀察 ESAT6和CFP10融合蛋白對MTB感染的小鼠巨噬細胞中自噬體形成的影響,探討該融合蛋白抑制自噬體清除MTB的機理。
1 材料與方法
1.1 材料 RPMI-1640細胞培養液購自于 Gibco公司。RNA提取、RT-PCR試劑盒、RIPA裂解液購自于杭州天根生物科技公司。β-actin抗體和Syber Green實時定量試劑盒由西安舟鼎國公司提供。7H10培養基購自于Becton Dicksion公司。MTB H37Rv菌株由本室保存。純化的 ESAT6-CFP10融合蛋白、抗atg5多克隆抗體及抗atg8單克隆抗體均由本室制備并保存[4-5]。自噬誘導劑雷帕霉素(Rapamycin)和自噬抑制劑3-MA由Sigma公司提供。小鼠巨噬細胞系RAW264.7、MTB毒株 H37Rv均由第四軍醫大學實驗動物中心保存。
1.2 自噬體檢測 實驗分4組,每組設6個復樣,分別為自噬誘導組、融合蛋白作用組、自噬抑制組和雷帕霉素組。自噬誘導組:1×105小鼠巨噬細胞培養至對數生長期后,加入50nmol/L的雷帕霉素作用3h,然后按MOI=1∶10比例加入1×108CFU的 H37Rv菌株作用4h,PBS(PH7.4)緩沖液洗脫3次以洗脫未結合的 H37Rv菌株。融和蛋白作用組:25μg/mL的ESAT6-CFP10融合蛋白作用小鼠巨噬細胞3h后,加入50nmol/L的雷帕霉素作用3h后,按 MOI=1∶10比例加入1×108CFU的H37Rv菌株作用4h。自噬抑制組:小鼠巨噬細胞加入自噬抑制劑3-MA(600 mg/L)作用12 h,然后按MOI=1∶10比例加入1×108CFU的 H37Rv菌株作用3 h。雷帕霉素組:小鼠巨噬細胞培養至對數生長期后,加入50nmol/L的雷帕霉素作用3h。上述細胞以0.25%胰酶消化后收集細胞,20%鋨酸固定過夜,透射電鏡觀察自噬體的形成。
1.3 菌落形成單位(CFU)檢測 ESAT6-CFP10融合蛋白作用組、自噬誘導組和自噬抑制組小鼠巨噬細胞用0.05%Triton X-100處理后收集,7 000r/min離心,收集沉淀,重懸后1∶107稀釋,取 100μL懸液接種于 7H10瓊脂培養基,37℃培養21d后進行菌落計數,所有實驗組設6個重樣。
1.4 實時定量PCR檢測atg mRNA表達水平 根據 Gen-Bank報道的 atg基因序列 ,分別設計 atg5、atg7、atg8、atg12特異性引物用于實時定量 PCR檢測。atg5上游引物為5’atgacagatgacaaagatg 3’,下游引物為 5’ctcataaccttctgaaagtg 3’;atg7上游引物為 5’atgggggaccctggactgg 3’,下游引物為5’gcagagtcaccattgtag 3’;atg8 上游引物為 5’tcggagaagaccttcaag 3’,下游引物為 5’catgttgacatggtcagg 3’;atg12 上游引物為 5’atgtcggaagattcagagg 3’,下游引物為 5’tttcttggtgtctccgggag 3’。上述各組細胞收集后加入1 mL TRIzol提取細胞總RNA并進行cDNA第一鏈合成。以cDNA為模板,加入25μL Syber Green進行PCR反應,PCR反應條件為:94℃預變性 2 min,94℃變性30 s,55℃退火30 s,72℃延伸 1 min,共進行30個循環。atg mRNA相對定量通過下列公式計算[5]:atg mRNA=2-△ct×100。
1.5 免疫印跡檢測atg5、atg8蛋白表達水平 收集細胞以RIPA裂解液提取細胞總蛋白。蛋白定量后進行 SDSPAGE電泳,將預先處理的 PVDF膜與 PAGE膠相貼,在恒壓100V條件下轉移電泳1h,50g/L脫脂奶封閉后,分別加入1∶50稀釋的鼠抗atg5多克隆抗體及atg8單克隆抗體,同時以β-actin作為內參對照,4℃過夜,1g/L Tween-20 PBS洗滌后,加入HRP標記羊抗鼠IgG抗體,37℃放置1h。PBS洗滌后,加入底物液顯色。
1.6 統計學分析 實驗結果的差異性采用LSD-t檢驗分析,P<0.05為差異顯著。
2 結 果
2.1 自噬體檢測 雷帕霉素作用小鼠巨噬細胞3h后感染H37Rv毒株,透射電鏡下可發現由單層膜組成的自噬囊泡出現,見圖1A;同樣,雷帕霉素也可直接誘導自噬體形成,見圖 1B;當加入 ESAT6-CFP10融合蛋白后,結果見圖1C,小鼠巨噬細胞中自噬體形成數目明顯減少(P<0.05,與自噬誘導組和雷帕霉素組相比較),達到自噬抑制組相同的水平,見圖1D;而相同條件下,未加融和蛋白的對照組小鼠巨噬細胞中自噬體數目無明顯變化,見圖1A,表明ESAT6-CFP10融合蛋白抑制了小鼠巨噬細胞自噬體的形成。
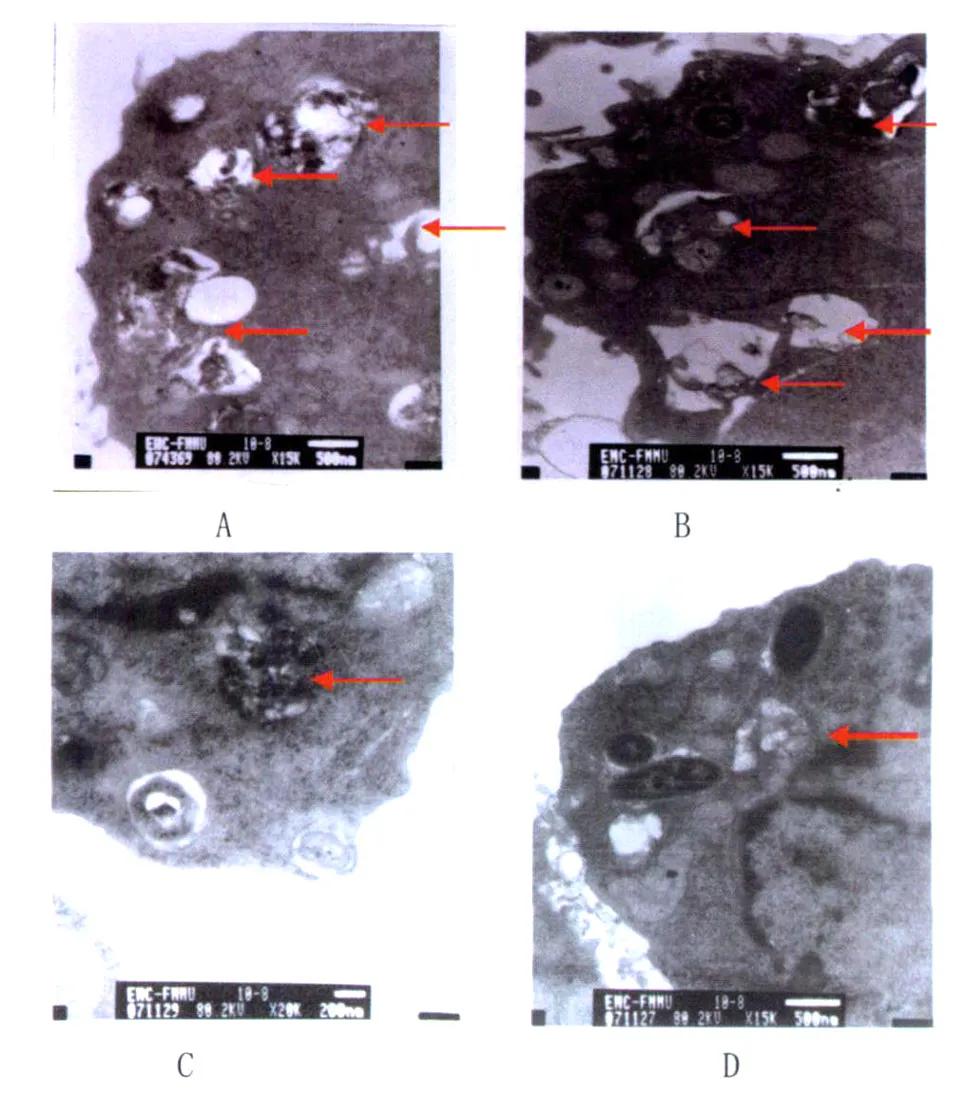
圖1 ESAT6-CFP10融合蛋白對MTB感染的小鼠巨噬細胞自噬體形成的影響A:雷帕霉素誘導感染MTB后巨噬細胞形成的自噬體(自噬誘導組);B:雷帕霉素誘導后巨噬細胞形成的自噬體(雷帕霉素組);C:ESAT6-CFP10融合蛋白作用后巨噬細胞形成的自噬體(融合蛋白作用組);D:3-MA抑制巨噬細胞自噬體形成(自噬抑制組)Fig.1 Effects on the autophagy formation by ESAT6-CFP10 fusion proteinA:Autophay induced by rapamycin after infection with MTB;B:Autophagy induced by rapamycin;C:Autophay inhibited by ESAT6-CFP10 fusion protein.D:Autophay inhibited by 3-MA
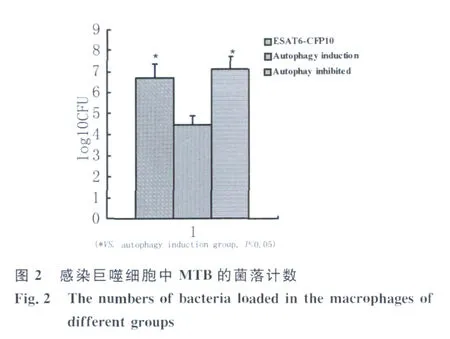
2.2 CFU檢測 H37Rv菌株感染細胞裂解后,稀釋后接種于 7H10培養基,經過 21d培養,計數CFU結果見圖 2。ESA T6-CFP10融合蛋白組H37Rv菌株CFU為6.68±0.69,而自噬誘導組組CFU為4.47±0.45,兩者相比有統計學意義(P<0.05),而自噬誘導組組的CFU指數最高,為7.13±0.57,結果說明 ESAT6-CFP10融合蛋白作用于巨噬細胞后,干擾了自噬體對胞內感染的 H37Rv菌株的清除作用。
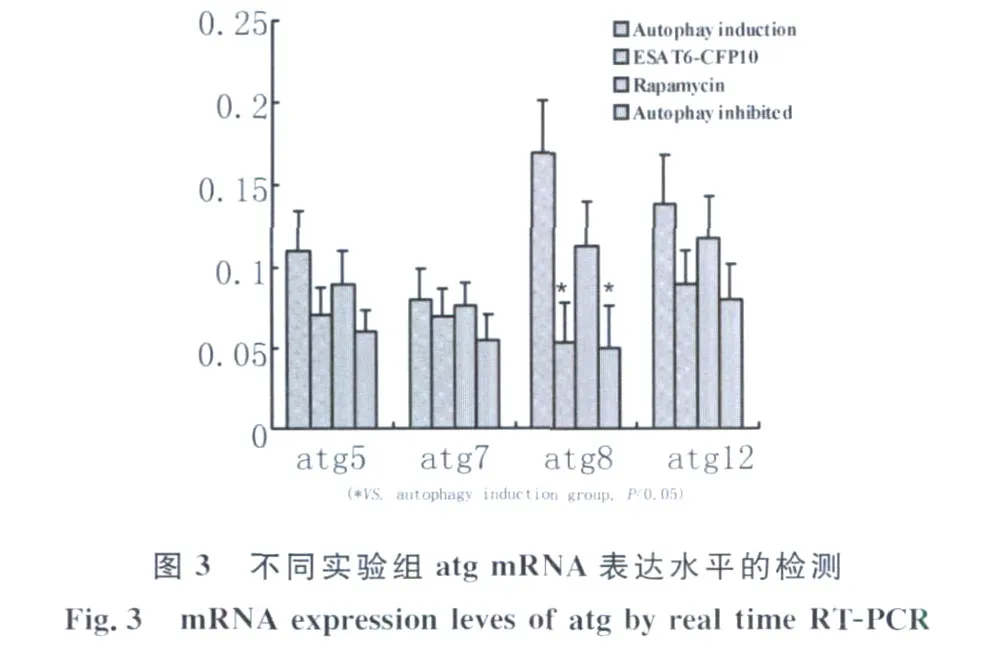
2.3 atg mRNA表達水平 MTB感染后,自噬誘導組中atg5、atg8、atg12表達水平均高于雷帕霉素組,在 ESA T6-CFP10融合蛋白作用下 atg分子mRNA表達均下調,其中尤以atg8分子mRNA表達水平下降最為明顯,見圖3,與自噬誘導組和雷帕霉素組相比均有顯著查差別(P<0.05),達到與自噬抑制組相同的水平。
2.4 atg5、atg8蛋白表達水平 分別以抗atg5多克隆抗體及atg8單克隆抗體與感染細胞總蛋白進行免疫印跡分析,結果如圖4所示,ESAT6-CFP10融合蛋白組和自噬抑制組中,無論是atg5蛋白還是atg8蛋白表達水平均明顯下降,而自噬誘導組和雷帕霉素組均無顯著變化。表明ESA T6-CFP10融合蛋白可能通過影響atg分子蛋白表達水平調控自噬體的形成。

圖4 免疫印跡分析atg5和atg8蛋白表達水平1:融合蛋白作用組;2:自噬抑制組;3:雷帕霉素組;4:自噬誘導組Fig.1 Expression of atg5 and atg8 detected by immuno blot1:ESAT6-CFP10 group;2:Autophayinhibited group; 3: Rapamycin group; 4:Autophagy induction group
3 討 論
越來越多的研究表明,胞內感染病原體可以通過某些機制逃避機體的自噬[6]。例如,MTB可能通過自身分泌的某些蛋白,干擾自噬體與溶酶體的融合,抑制巨噬細胞中的自噬體不被降解。MTB抑制自噬體的形成可能是其免疫逃逸的機制之一。與減毒的疫苗株BCG相比較,MTB毒株能在巨噬細胞中長期存活甚至大量繁殖;而非致病性的MTB在感染巨噬細胞后很快被巨噬細胞殺滅,提示毒力因子參與了對抗機體的防御機制。
我們在前期的實驗中已觀察到ESAT6-CFP10融合蛋白能夠抑制巨噬細胞自噬體的形成[4],但未對巨噬細胞清除MTB毒株的能力進行評價,同時前期使用的自噬細胞模型缺乏雷帕霉素的誘導,在巨噬細胞內形成的自噬較少,缺乏典型性,因此本研究實驗設計中,除了MTB毒株感染巨噬細胞外,同時使用了雷帕霉素進行誘導,以期與蛋白干預組形成鮮明的對照,同時在檢測指標中增加巨噬細胞中MTB的CFU計數,進一步量化巨噬細胞通過自噬清除MTB的能力。
cf p10和esat6均為 ESAT6/WXG-100超家族成員,僅存在于致病性分枝桿菌中,而在BCG及其它環境分枝桿菌中均缺失。這兩個基因受同一個啟動子調控,共同轉錄,分泌至體外形成緊密的1∶1蛋白復合物,在MTB的致病過程中具有重要作用,同時該融合蛋白能特異地與宿主細胞表面受體結合,從而調控宿主細胞免疫應答能力[7]。相對于單個ESAT6或CFP10蛋白來說,融合蛋白可提高這兩種蛋白的熱力學參數和生物學穩定性。此外,在對該復合物的研究中還發現,CFP10蛋白的羧基端氨基酸殘基對于維持 ESAT6的毒力是非常重要的,缺失CFP10蛋白后往往會導致 ESA T6毒力的下降,因此本研究選擇SAT6-CFP10融合蛋白作為毒力因子更具代表性。
本研究表明雷帕霉素可誘導小鼠巨噬細胞產生自噬體,當 H37Rv菌株感染巨噬細胞后,透射電鏡下可發現大量由單層膜組成的自噬囊泡,細胞中自噬體數目較多,加入 ESAT6-CFP10融合蛋白,可使巨噬細胞中自噬體數目明顯減少,表明 ESAT6-CFP10融合蛋白抑制了自噬體的形成。CFU檢測發現,自噬體形成后可明顯降低小鼠巨噬細胞中的CFU計數,有效清除胞內感染的MTB,進一步說明ESAT6-CFP10融合蛋白可能抑制了自噬的形成,使得胞內感染的MTB具有一定的免疫逃逸功能。在自噬體形成過程中,一些自噬相關基因的表達,如atg5、atg7、atg8、atg12 等 ,對自噬體的形成至關重要,其中atg8分子表達的LC3蛋白是自噬形成的標志物[8]。實時定量PCR檢測結果表明自噬形成后atg5、atg8及atg12表達量均上調。當 ESAT6-CFP10融合蛋白作用后,多種atg分子mRNA表達均下調,特別是atg8分子下降最為明顯。atg5和atg8兩種分子的蛋白表達水平也同時下降,因此,推測在MTB感染過程中 ESAT6-CFP10融合蛋白通過影響atg分子的表達水平,特別是抑制atg8的表達調控自噬體的形成,這可能是 ESAT6-CFP10融合蛋白致病機理之一。
[1]Shintani T,Glionky DJ.Autophagy in health and disease:a double-edged sword[J].Science,2004,306(5698):990-995.
[2]Levine B,Deretic V.Unveiling the roles of autophagy in innate and adaptive immunity[J].Nat Rev Immunol,2007,7(10):767-777.
[3]Renshaw PS,Lightbody KL,Veverka V,et al.Structure and function of the complex formed by theTuberculosis virulencefactors CFP-10 and ESAT-6[J].EMBO J,2005,24(14):2491-2498.
[4]趙勇,師長宏,張彩勤,等.結核分枝桿菌 ESAT6-CFP10融合蛋白對小鼠巨噬細胞自噬功能的影響 [J].中國比較醫學雜志,2010,20(6):13-16.
[5]趙勇,栗文彬,師長宏,等.自噬相關基因 Atg5的原核表達及多克隆抗體制備[J].生物技術通訊,2009,20(4):482-484.
[6]Schmid D,Dengjel J,Schoor O,et al.Autophagy in innate and adaptive immunity against intracellular pathogens[J].J Mol Med,2006,84(3):194 202.
[7]Meher AK,Bal NC,Chary KV,et al.Mycobacterium tuberculosisH37Rv ESAT-6-CFP-10 complex formation confers thermodynamic and biochemical stability[J].FEBS J,2006,273(7):1445-1462.
[8]Itakura E,Mizushima N.Characterization of autophagosome formation site by a hierarchical analysis of mammalian Atg proteins[J].Autophagy,2010,6(6):764-776.

