慢病毒載體介導IL-4基因修飾BMSCs內耳局部應用治療免疫性感音神經性聾的實驗研究
郭浪,譚長強,崔毓桂,李王偉
(1.南京醫科大學第一附屬醫院 耳鼻咽喉科,江蘇 南京 210029;2.南京醫科大學第一附屬醫院生殖中心實驗室,江蘇南京 210029)
免疫性內耳病(immune-mediated inner ear disease,IMIED)包括內耳局部的免疫炎性疾病和自身免疫性內耳疾病,可以造成內耳組織損傷和生理功能障礙(包括感音神經性聾和平衡功能障礙等)。免疫抑制劑(腎上腺皮質激素、細胞毒性免疫抑制劑)對內耳免疫炎性病變具有較為可靠的治療效果,但其毒副作用明顯,并存在停藥后易復發等問題[1]。基因治療具有一次給藥、長期有效的特點,而內耳局部解剖特點(即存在諸多腔隙)非常適合實施局部基因治療。
骨髓間充質干細胞(bone-marrow mesenchymal stem cells,BMSCs)由于具有多向分化潛能及在體內可向急性損傷部位遷移的特性,現已成為干細胞治療研究的熱點,也逐漸成為基因治療的主要靶細胞之一。體外實驗顯示,基因轉染的BMSCs能較長時間的表達外源基因,這使得基因修飾的BMSCs治療疾病成為可能。利用慢病毒載體能高效感染BMSCs,使其成為基因治療的載體再植入內耳的方法,與重組慢病毒載體直接注入轉染內耳組織相比較,可準確了解和調控導入的基因量。通過體內該載體干細胞移植,使治療基因更集中在病變部位,減少病毒載體的使用量從而減少不良事件的發生。而且BMSCs與自身免疫病的發生、發展有著密切的關系,即其本身具有免疫調節和治療效能。現已有研究發現并證實,BMSCs對許多自身免疫性疾病的免疫炎性病理損傷有較好的調節和治療作用[2]。
白細胞介素-4(IL-4)是Ⅱ型輔助T細胞(Th2細胞)分泌的細胞因子。IL-4能夠刺激活化B細胞和T細胞增殖、CD4+T細胞分化成Ⅱ型輔助T細胞,它也在調節體液免疫和適應性免疫中起關鍵作用。有研究表明,IL-4具有與IL-10、FasL同樣的抗炎作用,當炎性組織中Th2占優勢時,IL-4、IL-10、IL-13等細胞因子大量分泌,拮抗炎癥反應,疾病自發緩解。針對上述特點,目前在類風濕性關節炎(RA)的研究中,已有學者將免疫調節分子(如IL-4、IL-10)、可溶性腫瘤壞死因子受體、趨化因子拮抗劑、超氧化物歧化酶,反應性氧特異性清除酶等的基因轉導入關節腔,用以拮抗炎癥反應,誘發Th1向Th2的免疫偏移。IL-4質粒或腺相關病毒介導的IL-4基因經肌肉注射或關節腔內注射,可使RA病變得到緩解[3]。另有研究發現,IL-4與凋亡蛋白FasL聯合作為免疫性損傷治療均可達到抗炎目的[4]。基于上述情況,本研究選擇IL-4基因作為治療基因,利用其抗炎及免疫調節作用,探索其對免疫性內耳病的炎性損傷以及由此所造成的聽覺功能障礙的影響及治療作用。
1 材料與方法
1. 1 實驗動物
健康6~8周齡白毛紅目豚鼠44只,雌雄不拘,體重250~300 g,耳廓反射正常,耳鏡檢查排除中耳疾患,所有動物均由南京青龍山動物養殖場提供。
1. 2 抗原
鑰孔嘁血藍蛋白(keyhole limpet hemocyani,KLH)為一種深海軟體動物體內提取的純化蛋白,購自美國Sigma公司。
1. 3 免疫性感音神經性聾(immune-mediated sensorineural hearing loss,IMSNHL)動物模型制備及實驗分組
1.3.1 動物模型制備 將500 μg KLH溶解于250 μl PBS(0.01 mol·L-1,pH 7.4)中,與等量完全弗氏佐劑混勻后,注射于豚鼠右后足墊。2周后,將500 μg KLH溶解于 250 μl PBS(0.01 mol·L-1,pH 7.4)中,與等量不完全弗氏佐劑混勻,于豚鼠背部多點皮下注射,加強免疫。2周后,再于圓窗龕局部免疫,具體步驟:1%的戊巴比妥鈉(30 mg·kg-1)在豚鼠腹腔注射麻醉后,在耳廓后方作一弧形切口,分離并暴露聽泡,用電鉆鉆一小孔,顯露圓窗龕。在手術顯微鏡下將一小片吸附5.2 mg·ml-1KLH的明膠海綿放置于圓窗龕局部。最后一次加強免疫2周后,依據聽覺誘發電位Ⅲ波的閾值升高(超過免疫前全部動物均值2倍標準差)和血清中抗KLH特異性抗體水平升高(ELISA法,A490nm值超過免疫前全部動物均值加2倍標準差),判斷為免疫性內耳病模型動物[5]。本研究33只動物造模成功。
1.3.2 實驗分組 將造模成功的33只IMSNHL模型動物按配對設計,分為3組。IL-4基因修飾BMSCs組(A組):內耳注入重組慢病毒感染成功的IL-4基因修飾BMSCs懸液;BMSCs空載對照組(B組):內耳注入慢病毒空載體感染成功的BMSCs懸液;模擬手術對照組(C組):內耳注入PBS溶液。注入的液體量均為20 μl(BMSCs懸液中含 BMSCs 1.5 ×106~2.0 ×106個)。
1. 4 BMSCs的獲取、培養與標記
1.4.1 取股骨 將3~4周齡、體重250 g左右白毛紅目豚鼠乙醚麻醉后,用75%酒精浸泡20 min消毒后,斷頸處死。戴無菌手套用高壓滅菌之手術剪剪開大腿部皮膚、肌肉,暴露股骨,分離出兩側股骨,置于培養皿中的滅菌PBS液中,浸泡5 min。
1.4.2 BMSCs的分離、培養 將含10%胎牛血清的DMEM低糖培養基5 ml置于培養皿中,剪斷股骨兩端,用5 ml注射器吸取無血清的培養基來反復吹出股骨中的骨髓組織,直到股骨顏色由紅變白。將同一只大鼠兩側股骨骨髓吹在同一培養皿中,然后用注射器反復吹打均勻后,移入10 ml離心管,以1 000 r·min-1離心10 min,棄上清及脂肪層,細胞沉淀中加入含10%FBS和1%青、鏈霉素的L-DMEM培養基,細胞計數,調整細胞密度,按照1×106個·ml-1接種在25 cm2的培養瓶中。以上操作均在超凈臺中進行。
1.4.3 培養與傳代 細胞在37℃、飽和濕度、5%CO2恒溫培養箱中靜置培養,48 h后棄去原培養基和未貼壁細胞,更換新的全培養基,以后每隔3~4 d細胞換液,待細胞密度達到80% ~90%基本融合后,用0.25%的胰蛋白酶消化,1∶2的比例繼續傳代培養。
1.4.4 BMSCs獲取 利用改良直接貼壁法[6-7]獲得豚鼠BMSCs,置于DMEM培養基中培養、傳代。傳代3次后,獲得純度較高的 BMSCs,備慢病毒感染使用。
1. 5 慢病毒載體的包裝和重組慢病毒載體的鑒定
1.5.1 慢病毒載體的包裝和標記 將慢病毒載體包括包膜質粒 pVSG、包裝質粒 pHELPER、載體質粒pNL-IRES2.EGFP 3 種成分按1∶1∶1 的比例混勻,總量為8 mg,加入高糖DMEM培養基至0.5 ml,混合均勻。取20 μl Lipofectamine 2 000質體,加入高糖 DMEM 培養基0.5 ml,室溫孵育5 min,輕柔加入至培養有293 T細胞的60 mm培養皿中,于37℃、5%的CO2孵箱中培養6 h后,小心吸棄上清,更換為高糖DMEM完全培養液繼續培養。24 h后熒光顯微鏡觀察轉染情況。轉染后48、72 h 收集含病毒上清,以 4 500 r·min-1離心20 min,收集上清,保存于-70℃備用。
1.5.2 重組慢病毒pll 3.7-IL-4鑒定 分別將pll 3.7-IL-4慢病毒液2 ml感染80%融合的293細胞,待單層細胞大部分變圓但尚未脫落時收集細胞,反復凍融3次,取少許提取慢病毒DNA,進行PCR鑒定。
1. 6 慢病毒載體感染BMSCs
體外培養的BMSCs擴增至第3代,細胞達80%融合,吸棄培養基,每個25 cm2細胞培養瓶加入1×108ml-1重組IL-4慢病毒15 μl,同時加入聚凝胺至終濃度為8 mg·L-1,8 h后更換為低糖DMEM完全培養液繼續培養。24 h后熒光顯微鏡觀察,并重復第1天感染步驟再次感染(復染)。48 h后在熒光顯微鏡下觀察綠色熒光蛋白的表達,陽性呈明亮的黃綠色。當細胞融合達90%,可進行傳代。以慢病毒感染BMSCs的cDNA為模板進行PCR檢測慢病毒載體基因。空載BMSCs制取步驟同上述,但感染BMSCs的慢病毒為未重組IL-4基因的空載體。感染成功的BMSCs備用于內耳植入。
1. 7 BMSCs的內耳植入
將上述感染成功的BMSCs(G3)用胰酶消化,以1 000 r·min-1離心 10 min,無血清 DMEM 培養基重懸,并進行細胞計數,制備成(1.0 ~2.0)×1010L-1的細胞懸液。圓窗龕局部免疫后2周,豚鼠用1%的戊巴比妥鈉(30 mg·kg-1)腹腔注射麻醉后,在耳廓后方作一長約2~3 cm弧形切口,分離皮下肌肉與筋膜,顯露聽泡,用微型電鉆打開聽泡,暴露耳蝸底轉,在鼓階側壁的骨壁鉆一針尖大小的孔(不穿透內骨膜)。用微推進器將小兒頭皮針的針尖(針尖斜面已打磨變平)插入鼓階,深度不超過1 mm,先抽取少量(約10 μl)的外淋巴液,再依據分組情況,用微量注射機將BMSC細胞懸液或PBS(1 μl·min-1)注入鼓階。骨蠟封閉耳蝸底轉的骨孔。抗生素沖洗中耳腔3次,骨蠟封閉聽泡骨孔,逐層縫合切口(圖1~3)。所有操作均在無菌條件下進行。

圖1 鼓階內注射的手術照片Fig 1 The figure after the injectin in scala tympani
1. 8 觀察指標
1.8.1 特異性免疫反應測試 采用酶聯免疫吸附試驗(ELISA)測定特異性血清中抗KLH抗體水平。3次測試分別于免疫前、圓窗龕局部免疫后2周、鼓階內植入術后1周(即末次聽覺功能測試后)進行。心臟采血,分離血清。用100 μg·ml-1的 KLH 溶液包被 96孔酶聯板,于4℃過夜并封閉,加入1∶10稀釋的豚鼠血清,37℃下孵育2 h,洗板5次,加入1∶2 000稀釋的辣根過氧化物酶標記的葡萄球菌蛋白A(staphylococcal protein A-HRP,SPA-HRP),37 ℃下孵育1 h,洗板5 次,加入3,3,5,5-四甲基聯苯胺(3,3,5,5-tetramethyl benzidine,TMB)底物溶液,顯色10 min后用H2SO4終止顯色,在酶標儀下測定波長為490 nm的A值。
1.8.2 聽性腦干誘發電位(auditory brain-stem response,ABR)測試 分別于免疫前、圓窗龕局部免疫后2周、鼓階內植入術后1周采用TuckerDavisTechnology(TDT)BioSig SystemⅢ聽覺研究系統(TDT system 3)(美國TDT公司)測定聽覺功能。豚鼠頭頂冠狀縫與矢狀縫交界處插入針形電極作為測試電極,參考電極置于被測耳的耳廓后方靠近乳突尖,接地電極置于鼻尖,刺激聲信號采用Click,重復頻率為11次·min-1,疊加2 048次,記錄時程10 ms,測定Ⅲ波的閾值(dB,nHL)。
1.8.3 內耳光鏡觀察 各組分別于圓窗龕局部免疫后2周、鼓階內植入術后1周,在聽覺測試后每次各取2只豚鼠,麻醉后斷頭,立即取出顳骨,打開聽泡,放置4%多聚甲醛固定液中,12 h后,放入10%乙二胺四乙酸鈣鈉鹽(EDTA)中脫鈣5~7 d,修剪后流水沖洗1~2 h,常規脫水、透明、浸蠟、定向包埋。耳蝸中軸切片,片厚5 μm,漂片、撈片、粘片,常規 HE染色,封片,光鏡觀察和照相。
1.8.4 免疫組織化學試驗 (1)內耳石蠟包埋和切片制備:各組于鼓階內植入術后1周,聽覺測試后,將剩余豚鼠麻醉、斷頭,迅速取顳骨,打開聽泡,放置4%多聚甲醛固定液中,用針挑開圓窗,在蝸尖鉆一小孔,快速灌注數次,固定12 h,采用EDTA脫鈣1周,修剪后流水沖洗1~2 h,常規脫水、透明、浸蠟、定向包埋。(2)免疫熒光化學試驗:每組4只(8耳)的蠟塊行耳蝸中軸切片,片厚4 μm,漂片、撈片、粘片后常規脫蠟至水,在熒光顯微鏡下行熒光自顯影觀察和照相。(3)酶免疫組織化學試驗:每組3只(6耳)按上述方法獲得耳蝸石蠟切片,用胰酶(0.2%)修復抗原,余具體步驟:正常山羊血清封閉10 min,加PBS稀釋的第一抗體(兔抗鼠IL-4單克隆抗體),4℃過夜,PBS洗5 min×3次,加入HRP標記的羊抗兔單克隆抗體作為二抗,37℃孵育30 min,PBS洗5 min×3次,DAB(3,3'-diaminobenzidine)染色,樹脂封片劑封片,光鏡觀察照相。
2 結 果
2. 1 BMSCS 培養情況
見圖2。
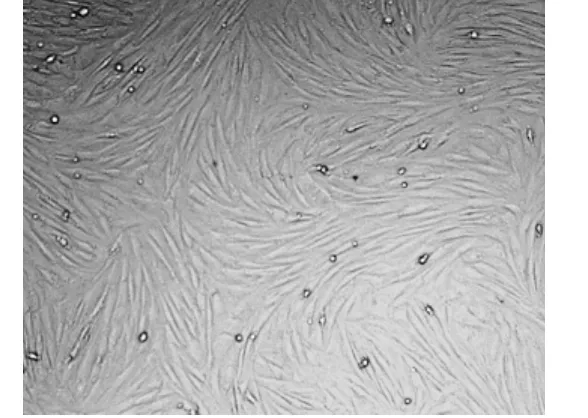
圖2 倒置顯微鏡下的第三代BMSCS ×100 細胞呈均勻一致的紡錘形,融合成旋渦狀Fig 2 The spectation of BMSCS in third generation under the inverted microscope
倒置顯微鏡觀察到BMSCs原代細胞剛接種時呈圓形,傳代3次后,獲得了純度較高的BMSCs,備慢病毒感染使用。
2. 2 重組慢病毒pll 3.7-IL-4鑒定
見圖3、4。
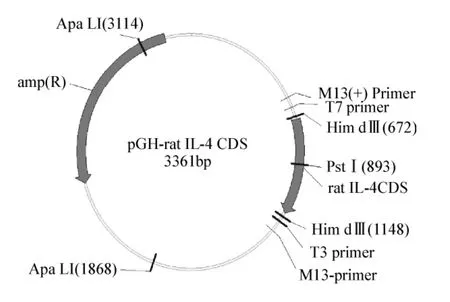
圖3 重組慢病毒pll 3.7-IL-4結構圖Fig 3 The structure of recombinant lent-ivirus pll 3.7-IL-4
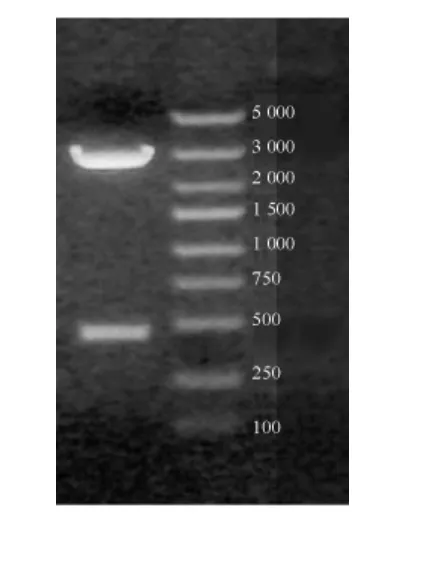
圖4 重組慢病毒pll 3.7-IL-4溶液的電泳圖 左側條帶為重組慢病毒pll 3.7-IL-4鑒定結果,右側條帶為markerFig 4 Electorphoretogram of IL-4 recombinant lentivirus pll 3.7-solution.The left band is the identified result of recombinant lentivirus pll 3.7-IL-4,right band is the marker
2. 3 重組慢病毒pll 3.7-IL-4感染細胞能力鑒定
見圖5。

圖5 慢病毒感染BMSCs 48 h 熒光顯微鏡 ×200Fig 5 The fluorescence picture of BMSCs 48 h after the lentiviras infection ×200
2. 4 病毒載體質粒基因RT-PCR分析
見圖6。
以慢病毒濃縮液以及慢病毒感染骨髓MSCs的DNA和cDNA為模板進行PCR檢測慢病毒載體基因,均可見目的條帶,條帶大小為412 bp。
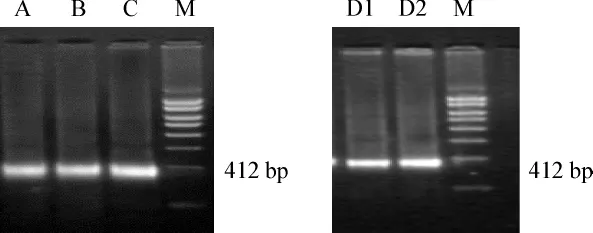
圖6 病毒載體質粒基因RT-PCR(a、b)Fig 6 The RT-PCR of lentiviral vector plasmid gene(a、b)
2. 5 特異性免疫反應試驗結果
見表1。
由表1可見,與免疫前相比,各實驗組和對照組免疫后抗體水平均明顯升高(配對t檢驗,P<0.05)。免疫前和免疫后的各組間抗體水平比較差異無統計學意義(配對t檢驗,P>0.05)。內耳注射后與免疫后結果相比差異無統計學意義(配對t檢驗,P>0.05)。
2. 6 聽覺功能
以ABRⅢ波反應閾作為評定聽力水平的指標,結果見表2。
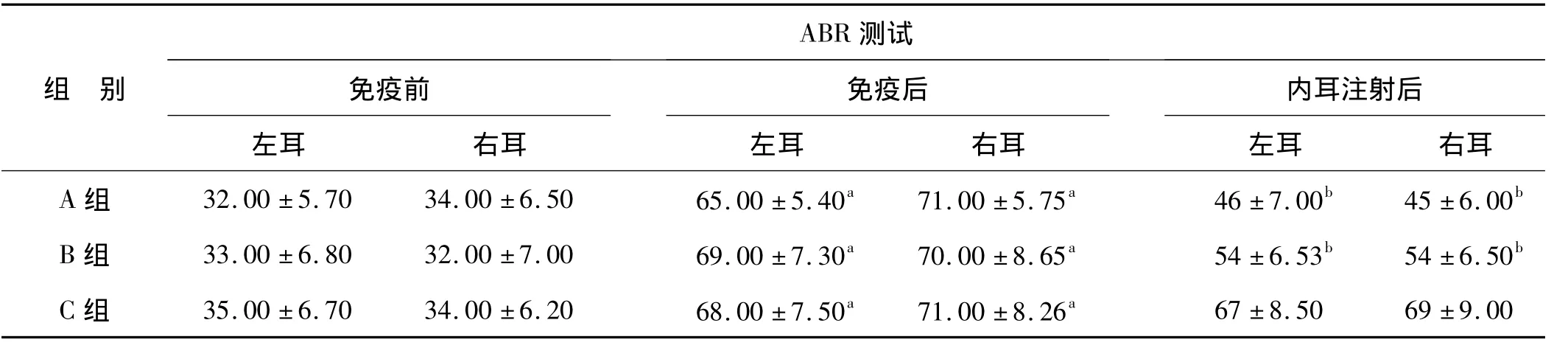
表2 免疫前后和內耳注射后各組ABR測試結果(dB,SPL)(x±s)Tab 2 Result of the auditory brainstem response(ABR)from each group before and after the immunization(dB,SPL)(x±s)
與免疫前相比,免疫后各組ABRⅢ波平均閾值升高,差異均有統計學意義(配對t檢驗,P<0.05)。與免疫后相比,內耳注射后A組和B組ABR平均閾值降低,差異均有統計學意義(配對t檢驗,P<0.05);A組平均閾值降低更為明顯。C組內耳局部注射前后比較,差異無統計學意義。各組組內同期左右耳比較差異均無統計學意義(配對t檢驗,P>0.05)。A組和B組分別以其免疫后的ABR平均閾值減2倍標準差作為判斷內耳局部注射后聽覺功能改善標準,A組有7只(12耳)、B組有5只(9耳)聽覺功能明顯提高,治療有效率分別為66.67%(12耳/18耳)和50.00%(9耳/18耳)。同樣以C組免疫后的ABR平均閾值減2倍標準差作為其判斷內耳局部注射后聽覺功能改善標準,則未發現有明顯聽力功能提高耳。
2. 7 內耳光鏡觀察結果
見圖7~9。免疫后各組內耳均出現較為顯著的炎癥反應,主要表現包括:Rosenthal's管中和螺旋神經節內出現炎癥細胞(以單個核細胞為主)浸潤,螺旋神經節細胞變性(主要表現為胞體腫脹)和螺旋神經節細胞數減少;蝸管及鼓階或前庭階可見絮狀物,鼓階內積(出)血,蝸管內出現“漂浮細胞”。Corti器及毛細胞形態未見明顯異常。內耳局部細胞植入后,A組和B組的炎癥反應明顯較C組為輕,尤其是聽覺功能改善耳,僅在蝸軸血管周圍有部分單個核細胞浸潤,但螺旋神經節細胞形態和數目基本正常,Corti器和血管紋未見明顯異常。鼓階內見部分絮狀物,但未見“漂浮細胞”。
2. 8 免疫熒光組織化學試驗結果
見圖8。鼓階內局部注射后,A組(圖8a)和B組(圖8b)可見鼓階內和前庭階內有顯著熒光反應的細
胞團塊,并在血管紋、前庭膜下、骨螺旋板唇部、Corti器等部位亦有熒光顯示,C組(圖8c)則未見有明顯熒光顯色。

圖7 內耳光鏡觀察 40×10
a.A組1只動物內耳局部細胞植入后耳蝸縱軸切片,見螺旋神經節結構基本正常;b.C組1只動物的免疫后耳蝸縱軸切片,見螺旋神經節內出現明顯炎癥細胞浸潤;c.B組1只動物的內耳細胞植入后耳蝸縱軸切片,可見鼓階內有絮狀物;d.C組1只動物的免疫后耳蝸縱軸切片,見鼓階內出現積(出)血
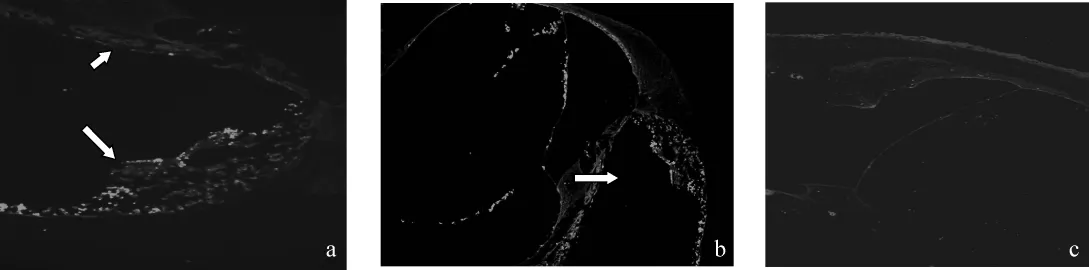
圖8 各組內耳免疫熒光組織化學染色結果
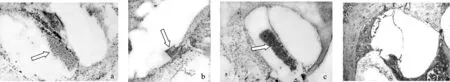
圖9 各組酶免疫組織化學染色結果
2. 9 酶免疫組織化學試驗結果
見圖9。鼓階內BMSCs植入內耳后,A組(圖9a、b)可見鼓階內干細胞團塊和骨螺旋板的唇部有明顯的褐色酶反應陽性顯色,另外Corti器、螺旋神經節等部位亦有弱陽性酶反應陽性顯色。B組(圖9c)可見鼓階內有干細胞團塊,但無明顯陽性顯色反應,其他組織部位亦未見明顯的陽性酶反應顯色。C組(圖9d)內耳各部位均未見有明顯酶反應陽性顯色。
3 討 論
1979年McCabe首次報道了自身免疫性感音神經性聾(autoimmune sensorineural hearing loss,ASNHL)[8],此后,一類由免疫介導的內耳損害所致的疾病或癥狀群陸續被報道,統稱為免疫介導的內耳病(immune-mediated inner ear disease,IMIED),包括自身免疫性內耳病(autoimmune inner ear disease,AIED)、特發性快速進展性雙側感音神經性聾、免疫介導的雙側梅尼埃病、以及系統性自身免疫病(非器官特異性,如韋格納肉芽腫病、Cogan綜合征、多發性結節性動脈炎、系統性紅斑狼瘡等)引起的內耳病。由于目前尚缺乏有效的、特異性和準確性較高的檢測手段來確認免疫性相關內耳病,同時也不可能直接在人體上獲取標本進行病理組織學觀察和研究,因此,通過免疫動物建立模型便成為研究的主要手段。與免疫損傷相關的內耳病的病因和發病機制尚不十分清楚,臨床缺乏特異性診斷方法,治療方面目前主要是采用皮質激素或免疫抑制劑治療,雖然在早期有肯定的療效,但該類藥物毒副作用多,而且還存在停藥后易復發等問題。內耳存在腔隙可以局部注入藥物,與全身給藥相比,理論上有4大優點[9-11]:(1)目的性強,藥物靶向性好;(2)可避開血-迷路屏障,直接進入內耳;(3)內耳的內、外淋巴液中藥物濃度高;(4)可避免全身性的藥物毒、副作用。
本項目組在先前的實驗研究中已采用了內耳局部注射給藥,并證實未造成明顯的內耳生理功能障礙。直接將腺病毒及慢病毒攜帶治療基因導入內耳治療自身免疫性感音神經性耳聾,雖然在一定的程度上顯示出了治療效果,但其病毒轉染量無法有效地控制,且關于腺病毒及慢病毒載體是否對內耳有損傷,以及其以后在臨床上是否被接受,還存在一定的風險及爭議。近年來已有報道基因轉染細胞的移植是一種傳遞基因到內耳的有效治療策略[12],另有研究觀察發現,當BMSCs移植入病理損傷的內耳后,免疫組織化學顯示,BMSCs源性細胞向有損傷部位遷移的現象,表明BMSCs不僅可以作為種子細胞發揮相應的治療作用,我們還可以利用其具有載體功能和遷移能力,把擬導入的目的基因攜帶到病理損傷部位,進而起到治療作用。
BMSC是一種具有多向分化潛能的干細胞,它具有低免疫原性免疫抑制功能。已有實驗研究結果顯示,BMSCs有助于內耳炎性損傷的修復,Sharifa等[13]通過觀察BMSCs移植入正常C57BL/6小鼠耳蝸的分布特點和形態,來評估BMSCs作為在耳蝸細胞移植替代治療的潛能。將攜帶增強型綠色熒光(EGFP)的BMSCs在注入耳蝸內后,免疫組織化學觀察發現其遷移入耳蝸,主要分布在外淋巴隙,并在螺旋韌帶和螺旋唇部位亦有熒光顯色,這與本實驗所觀察到的熒光分布結果基本一致。鑒于其中一些移植細胞表達耳蝸連接蛋白 connexin 26,Sharifa等[13]認為,BMSCS 具有傳遞治療分子以及修復耳蝸細胞的潛能,特別是在螺旋韌帶(SL)和螺旋唇部附近(SLB)。
許多免疫相關性疾病(包括自身免疫性疾病)以B淋巴細胞的過度激活和產生大量自身抗體為主要特征。T細胞包括Th1和Th2,Th2細胞主要分泌IL-4、IL-6、IL-10等。IL-4既可刺激T細胞又可刺激B細胞增殖,即可循環不斷地分泌IL-4而發揮其作用。研究表明[14],IL-4能誘導人單核細胞產生IL-1受體拮抗劑(IL-1Ra),抑制巨噬細胞克隆形成及巨噬細胞游走,在控制和消除炎癥中起著非常重要的作用。作者采用深海軟體動物提取的純化KLH抗原加弗氏佐劑免疫和致敏豚鼠,再在其圓窗龕局部免疫,造成部分實驗動物出現感音神經性耳聾和血清特異性抗體水平升高,即成功地制備了免疫原性內耳病動物模型。構建整合了IL-4基因的重組慢病毒載體,將該重組載體感染從豚鼠股骨干提取并培養的BMSCs,再將通過綠色熒光染色證實成功表達治療基因IL-4的BMSCs采用鼓階注射的方法植入豚鼠內耳。結果顯示,重組IL-4基因的慢病毒載體可在體外成功轉染BMSCs,并能產生IL-4基因產物。經鼓階途徑植入內耳后,BMSCs在內耳(主要是鼓階和前庭階腔隙,少量遷移至Corti器、血管紋、骨螺旋板的蝸管內唇部、螺旋神經節及耳蝸骨壁等部位)存活,提示BMSCs因具有低免疫原性,可有效地避免免疫排斥。B組和C組酶免疫組織化學結果證實:免疫炎癥反應所造成的內耳局部產生IL-4(本底)極少;而A組顯示鼓階和前庭階內有褐色酶反應陽性細胞(干細胞)團塊,另外在骨螺旋板的唇部亦有明顯的褐色酶反應陽性反應,Corti器、螺旋神經節等部位亦有弱陽性酶反應陽性顯色。證明植入的IL-4基因修飾BMSCs可產生過量的基因產物(IL-4)。這些內耳免疫組織化學觀察結果和病理形態學觀察結果,結合聽覺電生理測試結果(即與KLH抗原免疫后相比,內耳局部細胞植入后A組和B組ABRⅢ波平均閾值降低,A組平均閾值降低更為明顯)證實,BMSCs可作為一種載體將重組IL-4基因遷移至組織病變部位,即有向病變部位遷移、聚集的作用,進而對IMIED所造成的免疫炎性損傷產生一定程度的免疫調節和治療作用,A組導入內耳BMSCs產生的IL-4基因產物可增強這一作用。
本研究采用鼓階內的一點注射,結果顯示導入的BMSCs在內耳分布較為廣泛,依據內耳解剖學和組織學特點,我們推測除了BMSCs有向病變部位遷移的可能外,可能還有3個途徑使植入細胞從鼓階分布到蝸管:(1)通過骨螺旋板下層中的小孔與鼓階的外淋巴液相交通;(2)通過蝸神經纖維穿過的細孔與鼓階的外淋巴液相交通;(3)鼓階和前庭階在頂回以蝸孔相交通,蝸管中的內淋巴液通過前庭膜與外淋巴液相交通。具體情況尚有待進一步研究探明。
[1]McDONOUGH A K,CURTIS J R,SAAG K G.The epidemiology of glucocorticoid-associated adverse events[J].Curr Opin Rheumatol,2008,20(2):131-137.
[2]SCHERER H U,van PEL M,TOES R E.Mesenchymal stem cells in autoimmune diseases:hype or hope?[J].Arthritis Res Ther,2010,12(3):126.
[3]HO S H,HAHN W,LEE H J,et al.Protection against collagen-induced arthritis by electrotransfer of an expression plasmid for the interleukin-4[J].Biechem Biophys Res Commun,2004,321(4):759-766.
[4]NAKAMURA K,AMAKAWA R,TAKEBAYASHI M,et al.IL-4 producing CD8(+)T cells may be an immunological hallmark of chronic GVHD[J].Bone Marrow Transplant,2005,36(7):639-647.
[5]張靖華,吳皓.免疫性內耳病模型的建立及地塞米松圓窗和全身給藥的療效[J].上海交通大學學報:醫學版,2007,27(1):26-28.
[6]FRIEDENSTEIN A J,CHAILALDYAN R K,GERASIMOV U V.Bone marrow osteogenic stem cell:in vitro cultivation and transplantation in diffusion chambers[J].Cell Tissue Kinet,1987,20(3):263-272.
[7] LISIGNOLI G,REMIDDI G,CATTINI L,et al.An elevated number of differentiated osteoblast colonies can be obtained from rat bone marrow stromal cells using a gradient isolation procedure[J].Connect Tissue Res,2001,42(2):49-58.
[8]MCCABE B F.Autoimmune sensorineural hearing loss[J].Ann Otol Rhinol Laryngol,1979,88(5 Pt 1):585-589.
[9]XENELLIS J,PAPADIMITRIOU N,NIKOLOPOULOS T,et al.Intratympanie steroid treatment in idiopathic sudden sensorineural hearing loss:a control study[J].Otolaryngol Head Neck Surg,2006,134(6):940-945.
[10]陳文博,譚長強.IL-10基因重組慢病毒載體不同途徑導入內耳局部治療自身免疫性感音神經性聾的實驗研究[J].東南大學學報:醫學版,2010,29(3):262-267.
[11]蔡文君,譚長強.自身免疫性感音神經性聾基因治療的實驗研究[J].東南大學學報:醫學版,2009,28(2):79-84.
[12]OKANO T,NAKAGAWA T,KITA T,et al.Cell-gene delivery of brain-derived neurotrophic factor to the mouse inner ear[J].Mol Ther,2006,14(6):866-871.
[13]SHARIFA S,NAKAGAWA T,OHNO T,et al.The potential use of bone marrow stromal cells for cochlear cell therapy[J].Neuroreport,2007,18(4):351-354.
[14]HO S H,HAHN W,LEE H J,et al.Protection against collagen-induced arthritis by eleetrotransfer of an expression plasmid for the interleukin-4[J].Biechem Biophys Res Commun,2004,321(4):759-766.

