ERCC1和GST-pi在肺癌中的表達及預后意義
許崇安 馮丹 李琳 于萍 胡雪君 劉云鵬
肺癌的發病率及死亡率不僅在歐美國家位居首位[1],在我國也已成為城市居民惡性腫瘤死亡率的第一位[2],其中非小細胞肺癌(non-small cell lung cancer,NSCLC)約占全部肺癌的80%[3],由于肺癌起病隱匿,目前仍缺乏有效的篩查和早期診斷方法,患者出現癥狀時多為晚期,預后較差,總的5年生存率不超過15%,有癥狀者≤10%[4]。很多病人在接受根治性手術后仍會復發和轉移,單憑臨床病理分期已不能對預后做出準確評估,因此,有必要研究不同的分子標志物在肺癌發生發展及預后中的作用。
DNA損傷修復系統在維持基因組功能完整性、修復致癌因素所致的損傷以及抗癌過程中起到極為重要的作用[5],切除修復交叉互補基因 1(excision repair cross complementing 1, ERCC1)是DNA修復系統中的一個關鍵基因,在多種DNA損傷中發揮修復作用,與惡性腫瘤的發生、預后及治療反應等密切相關。谷胱甘肽S-轉移酶-Pi(glutathione S-transferase Pi, GST-pi) 是谷胱甘肽S-轉移酶家族成員之一,是體內生物轉化最重要的II相代謝酶,是細胞抗損傷抗癌變的重要解毒系統[6]。為了進一步研究與肺癌相關的分子標志物特點,我們應用組織芯片和免疫組化方法,檢測148例肺癌標本中ERCC1和GST-pi的表達情況,并分析其表達與臨床病理特征和預后的關系。
1 材料和方法
1.1 材料 收集中國醫科大學附屬第一醫院和中國醫科大學附屬第四醫院1997年1月-2004年12月外科手術切除并有完整臨床資料的肺癌石蠟包埋標本148例,男性104例,女性44例,年齡34歲-76歲,中位年齡58.52歲,有吸煙史93例,無吸煙史55例;病理類型為小細胞肺癌(small cell lung cancer, SCLC)22例,NSCLC 126例,NSCLC中鱗癌50例,腺癌61例,腺鱗癌1例,類癌1例,大細胞癌6例,多形性癌7例;分化程度為高分化20例,中分化 59例,低分化 41例,未分化28例;根據UICC1997年新的修訂標準進行TNM分期:I期56例,II期25例,III期67例;淋巴結轉移陽性者83例,淋巴結轉移陰性者65例;所有患者術前均未接受過化療、放療或免疫治療。對照組標本選取7例遠離腫瘤組織(>5 cm)的正常肺組織。
1.2 方法
1.2.1 組織芯片制作 將NSCLC和正常對照標本制作成組織芯片(技術由上海芯超生物科技有限公司提供),簡要制作步驟如下:存檔切片經病理專家復診,并進行組織學定位后,再選取對應的蠟塊,以備制作組織芯片使用。應用組織陣列儀打孔取材(直徑1.0 mm),每塊取兩點,制作成陣列塊;應用切片機連續切片,厚度為4 μm;撈片,烤片及染色后再次復診,制作成可供免疫組化染色使用的組織芯片數張。
1.2.2 免疫組織化學染色 采用免疫組化S-P方法檢測ERCC1和GST-pi的表達,實驗步驟按試劑盒說明書進行。ERCC1鼠抗人單克隆抗體濃縮型購自美國Neomarkers公司,工作濃度為1:100,GST-pi鼠抗人多克隆抗體即用型及SP免疫組化試劑盒購自福建邁新生物技術開發有限公司,選用提供的陽性切片在同一條件下染色作為陽性對照,用PBS代替一抗作為陰性對照。
1.3 結果判定 染色結果由兩名有相關經驗的研究者應用HPIAS-1000高清晰彩色病理圖文分析系統獨立進行判定,隨機選取5個高倍視野(×400)計數100個腫瘤細胞中陽性細胞數,意見不同時協商解決。ERCC1以胞核中出現明顯的棕黃色顆粒為陽性細胞,陽性細胞數≥10%記作陽性(+),無陽性細胞或陽性細胞<10%記為陰性(-)。GST-pi以胞質和(或)胞核出現棕黃色顆粒為陽性細胞,陽性細胞數≥20%記作陽性(+),無陽性細胞或陽性細胞<20%記為陰性(-)。
1.4 統計學分析 采用SPSS 13.0軟件進行數據分析,率的比較采用χ2檢驗,ERCC1和GST-pi之間表達的相關性采用Spearman秩和相關分析;生存數據分析采用Kaplan-Meier法,組間比較采用Log-rank檢驗;對影響生存預后的聯合效應采用Cox比例風險模型進行多因素分析,納入的變量為年齡、性別、吸煙、病理類型、分化程度、腫瘤大小、淋巴結轉移、ERCC1和GST-pi的表達;Ρ<0.05為有統計學差異,所有檢驗和Ρ值均為雙側。
2 結果
2.1 ERCC1和GST-pi在肺癌和正常肺組織中的表達 148例肺癌中(圖1A,圖1C),ERCC1陽性(圖1B,圖2A)56例(37.8%),GST-pi陽性(圖1D,圖2B)109例(73.6%),而7例正常肺組織中二者表達均為陰性。肺癌標本中ERCC1(Ρ=0.042)和GST-pi(Ρ<0.001)的表達明顯高于正常肺組織。
2.2 ERCC1和GST-pi的表達與肺癌臨床病理特征的關系ERCC1陽性表達在NSCLC、中高分化和吸煙指數<400的患者中明顯升高(Ρ值分別為0.039、0.016和0.049),GST-pi陽性表達在無吸煙者(Ρ=0.034)及NSCLC患者(Ρ<0.001)中明顯升高,二者表達與患者年齡、性別、腫瘤大小、淋巴結轉移及TNM分期均無關(Ρ值均大于0.05)(表1)

表 1 ERCC1和GST-pi的表達與肺癌患者臨床病理特征的關系Tab 1 the relationship between ERCC1 expression , GST-pi expression and clinical pathophysicological characteristics of lung cancer patients
2.3 ERCC1和GST-pi表達的相關性 Spearman秩和相關分析結果顯示,ERCC1和GST-pi的表達呈正相關(r=0.214,Ρ=0.009)。
2.4 ERCC1和GST-pi的表達與肺癌患者預后的關系 148例肺癌病人的5年總生存率為37.4%,Kaplan-Meier生存分析顯示,ERCC1陽性表達者5年總生存率優于陰性患者(Ρ=0.037)(圖3A),分層分析發現,NSCLC患者中ERCC1陽性患者的5年生存率明顯高于ERCC1陰性患者(χ2=4.058, Ρ=0.044)(圖3B),而SCLC患者中ERCC1的表達對生存無明顯影響(χ2=0.225, Ρ=0.635)。進一步分析顯示,I 期和II期患者的5年生存率顯著優于III期患者(χ2=17.427, Ρ<0.001)(圖3C),并且I期和II期患者ERCC1陽性的的5年生存率亦顯著優于III期ERCC1陽性患者(χ2=17.849, Ρ<0.001)(圖3D)。GST-pi表達陽性與否對5年生存率無明顯影響(Ρ=0.614),分層分析顯示無論NSCLC還是SCLC患者GST-pi的表達對生存均無明顯影響(Ρ均>0.05)。分析ERCC1和GST-pi都表達或都不表達或只有一種表達之間5年生存率的差異,結果顯示無統計學差異(χ2=1.303, Ρ=0.254)
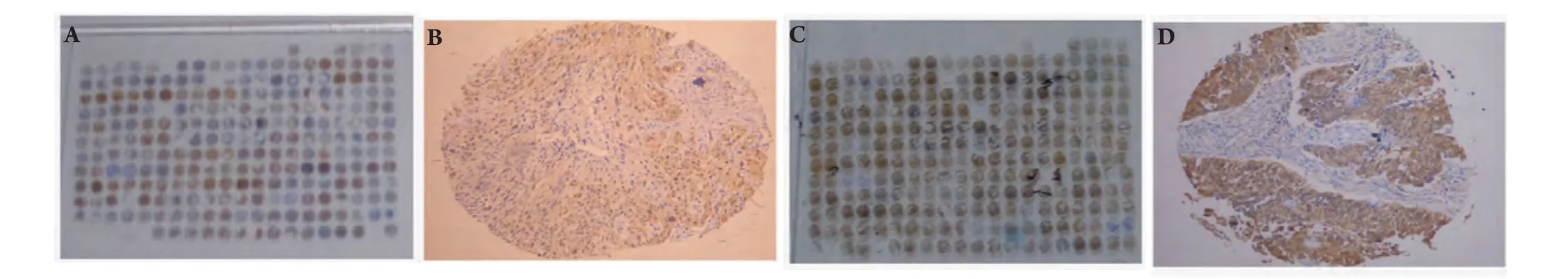
圖 1 肺癌組織芯片及一個點的ERCC1和GST-pi的陽性表達A:ERCC1肺癌組織芯片;B:一個點的ERCC1陽性表達(SP,×100);C:GST-pi肺癌組織芯片;D:一個點的GST-pi陽性表達(SP,×100)。Fig 1 the tissue microarray of lung cancer and the positive expressions of ERCC1 and GST-pi in one site of lung cancer tissueA, C: the tissue microarray of lung cancer; B: the positive expressions of ERCC1 in one site of lung cancer tissue (SP, ×100); D: the positive expressions of GST-pi in one site of lung cancer tissue (SP, ×100).

圖 2 ERCC1和GST-pi在非小細胞肺癌組織中的表達(SP,×400)Fig 2 the expressions of ERCC1 and GST-pi in NSCLC tissue (SP, ×400)

圖 3 患者的生存曲線A:ERCC1陽性和陰性表達患者的生存曲線(Ρ=0.037);B:ERCC1陽性和陰性表達的NSCLC患者生存曲線(Ρ=0.044);C:I/ II 期和III期患者的生存曲線(Ρ=0.037);D:I/ II期ERCC1陽性和III期ERCC1陽性患者的生存曲線(Ρ<0.001)。Fig 3 the Kaplan-Meier survival curves of lung cancer patientsA: the Kaplan-Meier survival curves of lung cancer patients with positive and negative ERCC1 expression (Ρ=0.037);B: the Kaplan-Meier survival curves of NSCLC patients with positive and negative ERCC1 expression (Ρ=0.044);C: the Kaplan-Meier survival curves of lung cancer patients with stage I/II and stage III (Ρ=0.037);D: the Kaplan-Meier survival curves of lung cancer patients with stage I/ II ERCC1 positive and stage III ERCC1 positive (Ρ<0.001).
Cox多因素分析結果顯示,NSCLC患者中腫瘤大小(Ρ=0.028, 95%CI: 1.087-4.378, RR=2.181)和臨床分期(Ρ=0.019, 95%CI: 1.076-2.279, RR=1.566)是影響預后的獨立危險因素;ERCC1和GST-pi的表達不是影響預后的獨立危險因素。在SCLC患者中,腫瘤大小、臨床分期、淋巴結轉移及ERCC1和GST-pi的表達等均不是影響預后的獨立危險因素。
3 討論
ERCC1是DNA修復基因,定位于19號染色體上,是核苷酸剪切修復家族中的一個重要成員,編碼297個氨基酸,與XPF形成異源二聚體,在DNA單鏈受損處的5'端進行剪切而發揮功能。研究證實DNA修復基因的修復能力與肺癌的發病和耐藥有關,DNA修復基因修復力低者肺癌發生的風險較正常人明顯增加,而修復能力高者常對化療藥物耐藥,使化療失敗[7-9]。
我們[10]曾檢測了ERCC1在116例NSCLC和12例癌旁肺組織中的表達,陽性率分別為40.5%和16.7%,差異無統計學意義,同時發現ERCC1的表達與肺癌分化程度、腫瘤大小和TNM分期密切相關,ERCC1陽性表達組5年生存率高于陰性表達組。Simon等[8]檢測了51例NSCLC患者術后癌組織中的ERCCI表達,發現ERCC1的表達與吸煙情況無關。本文的研究發現ERCC1在肺癌中的表達高于正常肺組織(Ρ=0.042),并且ERCC1表達在吸煙指數小于400的患者中明顯升高(Ρ=0.049),上述研究結果的差異分析與樣本來源不同有關。目前有關ERCC1在肺鱗癌及腺癌中的表達情況研究尚有爭議,Simon等[8]的研究結果顯示ERCC1在腺癌中的表達高于鱗癌,而Wachters等[11]報道肺鱗癌中的ERCC1表達顯著高于肺腺癌。我們以前的研究[10]結果顯示ERCC1在肺鱗癌及腺癌中的表達無顯著差異,本文的研究結果進一步顯示ERCC1在NSCLC中的陽性表達明顯高于小細胞肺癌患者(Ρ=0.039)。Olaussen等[12]研究顯示,ERCC1表達與腫瘤大小、臨床分期無關,與我們的研究結果相一致。ERCC1的表達與肺癌患者預后的關系目前尚未明確,多數研究顯示在早期術后患者中ERCC1高表達者生存時間顯著延長,可作為指導預后的獨立預測指標[8],但也有相反的結果,Azuma等[13]研究顯示ERCC1陰性的早期肺癌患者比陽性者有更長的無進展生存期。與早期肺癌相反,在接受鉑類化療的晚期NSCLC患者中,ERCC1陽性表達者預示著對鉑類化療耐藥,常常導致化療失敗,因此,晚期NSCLC患者ERCC1陽性表達者反較陰性表達者預后差[12]。這是因為ERCC1在腫瘤不同的階段具有不同的作用,通過預防突變,ERCC1可減少癌癥的發生或者阻止已經存在的腫瘤進展。因此,對于未進行化療的早期NSCLC患者,ERCC1是預后良好的標志;而對于晚期NSCLC,若進行化療則可能導致耐藥。因此,ERCC1對于NSCLC患者治療的選擇存在2種情況:早期患者,ERCC1高表達則可以不進行輔助化療;晚期患者,ERCC1高表達,則不適合應用含鉑類為基礎的方案化療,可使用非鉑類方案化療,也可根據EGFR基因檢測結果選用EGFR通路的TKI抑制劑。我們的研究結果表明ERCC1陽性的肺癌患者預后優于陰性患者,并與生存顯著相關(Ρ=0.037),這可能是因為我們的病例大多數是接受可能治愈性手術的早期肺癌患者有關。雖然ERCC1表達總體上并非是預后的獨立因素,但分層分析發現,ERCC1的表達是影響I期和II期患者預后的獨立危險因素(Ρ=0.003),而III期患者ERCC1的表達不是影響預后的獨立危險因素。另外,I期和II期ERCC1陽性患者的5年生存率亦顯著優于III期ERCC1陽性患者。分層分析發現,NSCLC患者中ERCC1陽性患者的5年生存率明顯高于ERCC1陰性患者,SCLC患者中ERCC1的表達對生存無顯著影響。
GST-pi是人體內一種II相代謝酶。其對腫瘤的耐藥作用主要由其解毒功能引起,作用機制為:①催化谷胱苷肽(GSH)與親電子藥物如各種烷化劑結合,增加其水溶性,加速其排泄而使藥效減低;②清除葸環類藥物等產生的自由基,減輕藥物自由基對細胞的損傷;③通過直接與藥物結合的形式降低藥物活性;④GST-pi還具有GSH過氧化物酶活性,可將有毒的過氧化物轉變為低毒的醇類物質,即有阻斷脂質過氧化物的作用。
NSCLC對化療的敏感性不如SCLC,其中一個重要的差異就是GST-pi表達的差異。GST-pi在不同肺癌組織類型中的表達目前報道不一。我們以前的研究[14]發現GST-pi在肺腺癌中的表達明顯高于鱗癌,不同分化程度的NSCLC中GST-pi的表達無明顯差異,吸煙者GST-pi的表達低于不吸煙者;Allen等[15]的研究也有相似的結論。而王笑新等[16]研究發現GST-pi在鱗癌中的表達高于腺癌。我們的研究結果顯示GST-pi在肺鱗癌及腺癌中的表達高于SCLC,分層分析顯示GST-pi在鱗癌和腺癌中的表達差異無統計學意義(Ρ=0.477);GST-pi在非吸煙患者中的表達明顯高于吸煙患者。GST-pi的表達與患者年齡、性別、腫瘤大小、分化程度、淋巴結轉移及TNM分期等無關。Hirano等[17]的研究顯示NSCLC患者接受鉑類為基礎的化療療效與GST-pi的表達有關,GST-pi陰性表達組5年生存率優于陽性組。我們以前的研究[14]顯示GST-pi的表達與生存無相關,本次研究結果進一步顯示無論NSCLC還是SCLC患者GST-pi的表達對生存均無影響(Ρ均>0.05)。
DNA修復基因的修復能力與肺癌的發病和耐藥有關,谷胱甘肽S-轉移酶是細胞抗損傷抗癌變的重要解毒系統,我們的研究結果顯示ERCC1和GST-pi在NSCLC中表達明顯增高并且相關,提示二者在腫瘤形成及鉑類耐藥過程中可能有一定聯系,但是否存在相互調節作用目前尚不清楚,有待進一步研究加以證實。
致謝:對參與本文病理結果判定的中國醫科大學附屬第一醫院病理專家邱雪杉教授和中國醫科大學附屬第二醫院(盛京醫院)病理專家楊向紅教授表示由衷的謝意!

