Th1/Th2細胞因子的平衡與實驗性肺間質纖維化
谷 秀,劉宏博,張曉曄,李勝岐,佐久間勉
(1中國醫科大學附屬盛京醫院,沈陽 110004;2日本金澤醫科大學)
目前,特發性肺間質纖維化發病機制不清,也無有效的治療方法。許多研究證實該病過程中存在細胞因子平衡失調,而且細胞因子在該病的發病過程中起重要作用。2007年 2月 ~2008年 4月,我們通過探討特發性肺纖維化過程中細胞因子與核因子-κB(NF-κB)的關系,為闡明肺纖維化的發病機制提供理論依據。
1 材料與方法
1.1 實驗動物 選用 C57BL/6CrSlc小鼠 75只,8周齡,雌性,體質量 17~20 g,購自北京維通利華實驗動物技術有限公司。實驗藥品:鹽酸博萊霉素 A5(平陽霉素)(天津市太和制藥有限公司),甲基強地松龍(美國普強藥廠比利時分廠),P65的反義寡核苷酸(上海生物工程公司),SABC試劑盒(武漢博士德公司),雙抗夾心 ELISA試劑盒(深圳晶美公司),羥脯氨酸試劑盒(南京建成生物技術研究所)。
1.2 小鼠肺纖維化模型制備和實驗動物分組 實驗組小鼠氣管內滴入博萊霉素 A 55 mg/kg(B組)建立肺纖維化模型,對照組(A組)小鼠氣管內滴入等量的生理鹽水。在氣管內滴入博萊霉素前 6 h和滴入后 5 d分別經尾靜脈注射 P65反義寡核苷酸 900μg/只(C組),在氣管內注入博萊霉素后 1 d和5 d分別經尾靜脈給予P65反義寡核苷酸 900μg/只(D組),P65反義寡核苷酸溶于生理鹽水 200μl中,P65反義寡核苷酸的序列為 5′-GAAACAGATCGTCCATGGT-3′[1]。對照組和模型組在上述相同的時間經尾靜脈注射等量的生理鹽水。E組為甲基強地松龍組,分別于氣管內注入博萊霉素前和注入后的第 1、2天經尾靜脈注射甲基強地松龍 150 mg/kg(溶于 200μl生理鹽水中)。A、B、C、D、E組每組各 24只小鼠,分別于 3、7、14、28 d各處死 6只。
1.3 標本采集及檢測 腹腔注射 1%戊巴比妥鈉(40 mg/kg)麻醉小鼠后,眼眶靜脈放血處死動物,開胸,結扎右主支氣管后取出右肺,稱量肺濕重,-70℃保存,待測羥脯氨酸含量(制成 10%勻漿,3 000 g/min離心 10 min,取上清測定)。向左肺灌注 10%甲醛,直至肺表面平滑,結扎左支氣管,取出左肺,放入 10%甲醛中固定,常規石蠟包埋,切片,染色,病理檢查。根據 Szapiel等[2]提供的方法確定肺泡炎及肺纖維化的程度。免疫組化方法檢測肺組織 NF-κB的表達,用 SABC法試劑盒進行檢測,操作步驟按試劑盒說明書進行。
1.4 肺泡灌洗液 IFN-γ及 IL-4的檢測 氣管插管,用預熱至 37℃的 PBS液灌洗支氣管肺泡,并收集肺泡灌洗液。每次注入 2.5~5.0 ml,反復沖洗 2次后吸出,共 3次,回收率達 90%以上。回收的灌洗液于4℃、1 500 r/min離心 10 min,留取上清液,-70℃凍存。ELISA法測定 IFN-γ及IL-4的蛋白含量。
1.5 統計學方法 采用采用SPSS10.0軟件進行統計分析,結果以±s表示,以 P≤0.05為有統計學差異。
2 結果
2.1 肺組織病理形態學 B組 3 d后即可見少量炎癥細胞滲出,7 d時達到高峰,可見彌漫性肺泡炎改變;14 d可見肺泡間隔明顯增厚,28 d肺纖維化達到高峰,肺泡結構消失,形成廣泛明顯的肺纖維化。E組的病理改變與B組基本相同。C、D組14 d時未見明顯的肺組織異常,無明顯的肺纖維化形成,28 d時有極少量的纖維化形成。
2.2 NF-κB免疫組化結果 見表1。
表1 各組 NF-κB免疫組化核染色陽性百分比(%,±s)
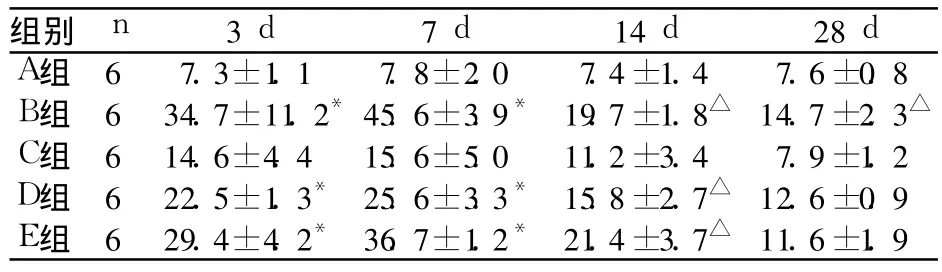
表1 各組 NF-κB免疫組化核染色陽性百分比(%,±s)
注:與 A組比較,*P<0.01,△P<0.05
組別n 3 d 7 d 14 d 28 d A組 6 7.3±1.1 7.8±2.0 7.4±1.4 7.6±0.8 B組 6 34.7±11.2*45.6±3.9* 19.7±1.8△ 14.7±2.3△C組 6 14.6±4.4 15.6±5.0 11.2±3.4 7.9±1.2 D組 6 22.5±1.3*25.6±3.3*15.8±2.7△ 12.6±0.9 E組 6 29.4±4.2*36.7±1.2*21.4±3.7△ 11.6±1.9
2.3 肺泡灌洗液中細胞因子檢測結果 見表2。
表2 各組肺泡灌洗液中 IL-4、IFN-γ水平比較(pg/ml,±s)
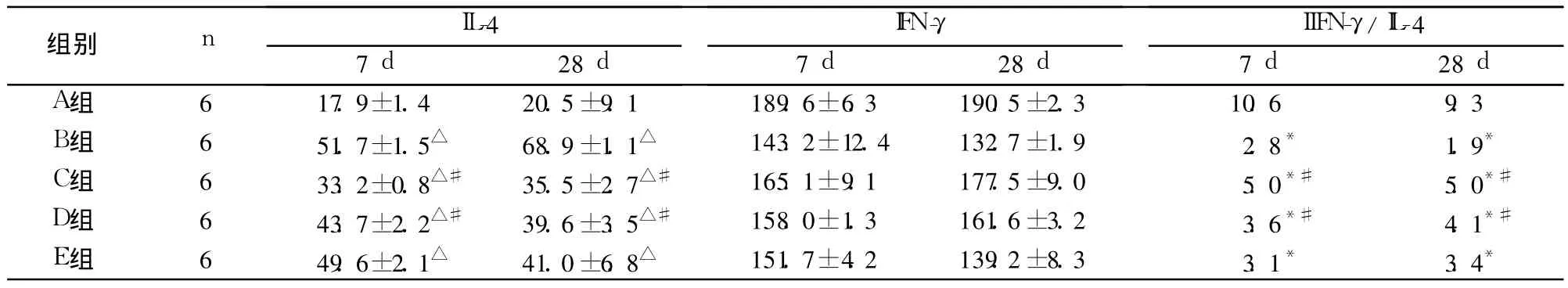
表2 各組肺泡灌洗液中 IL-4、IFN-γ水平比較(pg/ml,±s)
注:與 A組比較,*P<0.05,△P<0.01;與 B組比較,#P<0.05
組別 n IL-4IFN-γIIFN-γ/IL-4 7 d 28 d 7 d 28 d 7 d 28 d A組 6 17.9±1.4 20.5±9.1 189.6±6.3 190.5±2.3 10.6 9.3 B組 6 51.7±1.5△ 68.9±1.1△ 143.2±12.4 132.7±1.9 2.8* 1.9*C組 6 33.2±0.8△# 35.5±2.7△# 165.1±9.1 177.5±9.0 5.0*# 5.0*#D組 6 43.7±2.2△# 39.6±3.5△# 158.0±1.3 161.6±3.2 3.6*# 4.1*#E組 6 49.6±2.1△ 41.0±6.8△ 151.7±4.2 139.2±8.3 3.1* 3.4*
2.4 肺組織羥脯氨酸測定結果 見表3。
表3 肺組織羥脯氨酸的測定(mg/g,±s)
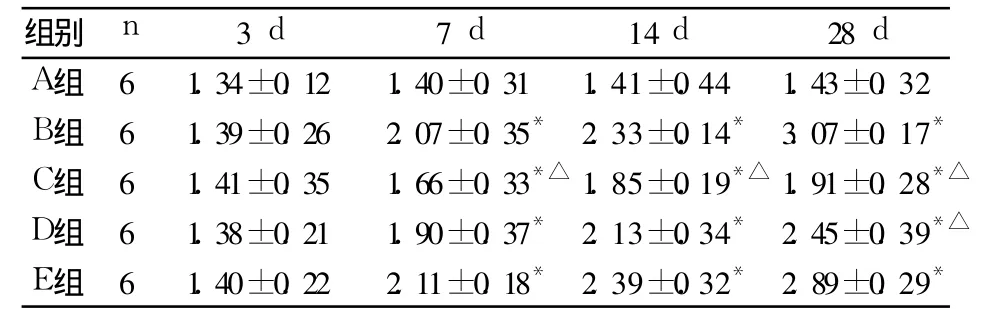
表3 肺組織羥脯氨酸的測定(mg/g,±s)
注:與 A組比較,*P<0.05;與 B組比較,△P<0.05
A組 6 1.3 4±0.1 2 1.4 0±0.3 1 1.4 1±0.4 4 1.4 3±0.3 2 B組 6 1.3 9±0.2 6 2.0 7±0.3 5* 2.3 3±0.1 4* 3.0 7±0.1 7*C組 6 1.4 1±0.3 5 1.6 6±0.3 3*△ 1.8 5±0.1 9*△ 1.9 1±0.2 8*△D組 6 1.3 8±0.2 1 1.9 0±0.3 7* 2.1 3±0.3 4* 2.4 5±0.3 9*△E組 6 1.4 0±0.2 2 2.1 1±0.1 8* 2.3 9±0.3 2* 2.8 9±0.2 9*
3 討論
經氣管注入博萊霉素建立肺纖維化的動物模型已被廣泛應用。本研究病理學改變早期肺泡炎明顯,第 7天開始出現肺纖維化,至第 28天纖維化已成為主要的病理改變。NF-κB是一種多功能的核轉錄因子,具有廣泛的生物學活性,激活后可促進細胞因子、黏附分子、趨化因子等的轉錄。NF-κB與呼吸系統多種疾病密切相關[3]。IFN-γ是典型的 Th1類細胞因子,具有抑制成纖維細胞增生及膠原聚集等作用,并且可以拮抗 Th2類細胞因子 IL-4、TGF-β的作用。所以 IFN-γ的相對缺乏可能與纖維母細胞激活、膠原沉積和瘢痕形成有關。而 Th2細胞來源的因子如 IL-4可擴大炎癥反應,引起肺結構的重塑,刺激肺成纖維細胞增生,伴有膠原和纖維素沉積增多,引起肺泡壁基底膜增厚和彌漫性上皮下纖維化[4,5]。以 IFN-γ/IL-4來衡量特發性肺纖維化中 Th1/Th2之間的平衡,其細胞因子的表達呈現出 Th2方向的偏移狀態,Th2類的強勢表達在特發性肺纖維化的過程中具有重要意義。這些變化與 NF-κB的活化密切相關,NF-κB的活化使 IL-4表達增強,可能是肺纖維化早期肺泡炎發生的關鍵環節,因此提前干預 NF-κB可能明顯減輕博萊霉素引起的急性毒性反應。
根據 Th1和 Th2細胞在免疫調節中的中心作用,通過調節 Th1/Th2平衡阻斷某些疾病的惡性循環,可以為某些疾病的治療提供新的治療策略[6]。應用 NF-κB的反義寡核苷酸可以抑制 NF-κB的活性,尤其在給予博萊霉素前應用,可以更明顯抑制早期肺泡炎的出現或防止肺泡炎的持續發展,從而預防或減輕肺纖維化的產生。但應用 NF-κB的反義寡核苷酸組的 NF-κB的活性仍然比對照組高,推測還可能與存在其他轉化因子有關。
綜上所述,NF-κB活化是 Th1/Th2細胞因子失衡的主要原因,干預 NF-κB活化可以使 Th1/Th2細胞因子失衡得到一定程度的逆轉,并可以一定程度上減輕肺纖維化的程度。
[1]Zhang XY,Shimura S,Masuda T,et al.Antisense oligonucleotides to NF-kappaB improve survival in bleomycin-induced pneumopathy of the mouse[J].Am JRespir Crit Care Med,2000,162(4 Pt 1):1561-1568.
[2]Szapiel SV,Elson NA,Fulmer JR,et al.Bleomycin-induced interstitial pulmonary disease in the nude,athymic mouse[J].Am Rev Respir Dis,1979,120(4):893-899.
[3]Wright JG,Christman JW.The role of nuclear factor kappa B in the pathogenesis of pulmonary diseases:implications for therapy[J].Am J Respir Med,2003,2(3):211-219.
[4]Sharma R,Guleria R,Pande JN.Idiopathic pulmonary fibrosis:newer conceptsand management strategies[J].Indian JChest Dis Allied Sci,2003,45(1):31-49.
[5]Costabel U,Guzman J.Bronchoalveolar lavage in interstitial lung disease[J].Curr Opin Pulm Med,2001,7(5):255-261.
[6]Chung MP,Monick MM,Hamzeh NY,et al.Role of repeated lung injury and genetic background in bleomycin-induced fibrosis[J].Am J Respir Cell Mol Biol,2003,29(3 Pt 1):375-380.

