下頜牽張成骨中應用神經生長因子對神經損傷修復的作用
杜兆杰,雷德林,王 磊,曹 健,張雅博,張 圃,馬 秦,程曉兵
(第四軍醫大學口腔醫學院口腔頜面外科,陜西西安 710032)
牽張成骨技術(distraction osteogenesis,DO)又稱為“自體性骨組織工程”,是 20世紀 50年代由前蘇聯學者 Ilizarov[1]發展和完善并用于矯治各類四肢長骨畸形的一種方法,90年代后開始應用于口腔頜面外科域[2],且發展迅速,已成為這一領域的研究熱點之一。下頜骨有特殊的解剖結構:下齒槽神經(inferior alveolar nerve,IAN)位于骨性下頜管中,在牽張器植入、下頜骨牽引延長的過程中受到創傷和牽拉,這在一定程度上造成了 IAN的損傷[3-5]。神經生長因子(nerve growth factor,NGF)是 1952年Levi.Montalcini最先在研究雞胚的神經發育過程中發現的。NGF對神經元的存活、生長發育、分化、再生和功能維持起調控作用。現已證實 NGF是參與損傷神經再生和功能修復的重要因素,是兼有神經營養因子與促神經突起生長因子雙重作用的蛋白質[6],全身應用 NGF在治療中樞及外周神經損傷中取得了明顯的效果,且已應用于臨床[7-9]。很多研究證實,NGF及其受體在牽張成骨的過程中出現高表達,而且與牽張應力有著密切關系。隨著牽張應力的消失,NGF及其受體的表達很快降低并恢復到正常水平[10-12],這提示神經損傷在固定期的自我修復過程中,應用外源性 NGF很可能會加快神經修復。本研究組的既往研究發現,DO中牽張區局部應用 NGF能明顯促進 IAN的恢復[13],但全身注射NGF這種更安全的應用方式,是否能促進下齒槽神經的修復仍未明確。因此在本實驗中,我們在牽張器植入后當天給予全身注射 NGF,檢測兔 IAN的感覺神經動作電位(sensory nerve action potential,SNAP),監測牽張成骨術前及術后不同時期 IAN功能的變化,研究全身注射 NGF對下頜骨牽張成骨術中 IAN功能的影響。
材料與方法
1 實驗動物及分組
成年新西蘭白兔 52只,由本校實驗動物中心提供,雄性,口頜系統無異常,體重 2.8~3.2 kg,實驗前分籠適應性飼養 1周,普通飲食。將兔隨機分為9組 ,Ⅰ組(空白組,4只)和 A組(肌注 NGF,牽張結束即刻組),B組(肌注 NGF,固定期 1周組),C組(肌注 NGF,固定期 2周組),D組(肌注 NGF,固定期 4周組),E組(肌注生理鹽水,牽張結束即刻組),F組(肌注生理鹽水,固定期 1周組),G組(肌注生理鹽水,固定期 2周組),H組(肌注生理鹽水,固定期 4周組),每組6只。除Ⅰ組未進行任何干預外,其他 8組均行骨牽張術。
2 牽張器
所用的內置式雙側下頜鈦牽張器由西安中邦鈦生物材料公司與本課題組共同研制(圖 1)。所應用的因子是人胚胎提取的 NGF,由第四軍醫大學生化中心提供。
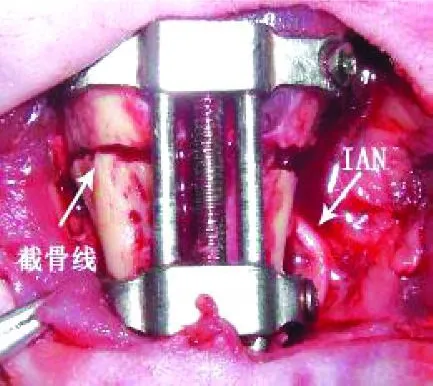
圖1 下齒槽神經及牽張器
3 手術過程
兔術前 30分鐘肌注青霉素 30萬 U,給予肌注氯胺酮 50mg/kg,靜脈注入苯巴比妥鈉 40mg/kg,全麻成功后,頜下三角區備皮。取仰臥位固定四肢并常規消毒鋪巾后,向頜下三角區局部注射含有 1:200 000腎上腺素的 1%利多卡因 2.5ml。沿頜下三角正中切開皮膚和皮下約 3cm,顯露雙側下頜下緣,切開骨膜并沿其深面向頰側翻瓣,暴露并保護好頦神經,行牽張器植入。在截骨過程中,一直高度注意保護好下齒槽神經血管束,而且完全固定牽張器后的骨斷端未見明顯移位,避免了下牙槽管斷端對IAN的刺激。創口反復沖洗后將骨膜復位縫合,分層嚴密縫合皮下和皮膚。將上前牙磨短至原牙冠的一半長,以減少將來下頜前徙時上切牙對下頜牙齦的刺激,以后每周調磨上前牙 1次。
4 術后處理
兔完全蘇醒后送回籠中,嚴密觀察并記錄其精神、飲食和體重情況。術后傷口每日清潔消毒并涂紅霉素軟膏 2次。術后 4天內肌注青霉素,30萬U/12h。術后即分別給予肌注 NGF 0.6μg/d×20天和相當量生理鹽水。經過 4天的延遲期后,各組均按照 0.5mm/12h的速度連續牽張,總距離 10mm。
5 神經電生理檢查
分別在牽張完成時,固定期 1、2、4周行 IAN和SNAP檢測。兔麻醉后取仰臥位,存在角膜反射,安靜不動,室溫 20~22℃,頜下三角區刮毛備皮。沿頜下三角正中切開皮膚和皮下約 3cm,顯露雙側下頜下緣,向頰側翻瓣,暴露并保護好頦神經。取出牽張器,在下頜骨頰側頦孔區至下頜骨下緣沿 IAN的走行兩側,渦輪機鉆頭開辟 2條平行溝槽,咬骨鉗輕輕去除頰側骨板,玻璃分針小心游離 IAN,期間持續滴石蠟油保持 IAN濕潤。用一直徑約為 3cm鋼圈與皮膚兩側切緣縫合形成油槽,以容納石蠟油,使IAN處于石蠟油環境中。頦孔端 IAN置雙極電極作刺激電極,下頜孔端置另一雙極電極作記錄電極并固定之。在刺激和記錄電極間置一針電極接地(圖2)。以細電壓單刺激的模式,刺激波形為方波,波寬0.5ms,延時 5.00ms,無疊加,起始刺激電壓為 1V,逐漸增加刺激強度直到引出最大穩定動作電位。刺激偽跡到動作電位第 1個波峰為潛伏期,峰-基線值為波幅。每只兔的雙側 IAN測量結果取平均值后進行記錄。
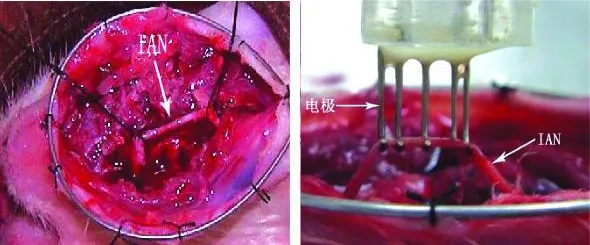
圖2 油槽及電極的放置
結 果
在 48只接受手術的實驗兔中,有 3只(B、C、F組各 1只)在牽張期發生頜下區膿腫,后消瘦死亡,故被排除后續研究。其余 45只均耐受手術并保持健康狀態。在整個實驗過程中,健康兔的體重損失量都 <12%。實驗兔在手術后的前 2天內僅對軟食感興趣,精神欠佳。而到第 3天,開始習慣牽張器,精神基本恢復到術前狀態并開始進食普通干草飼料。牽張結束時,所有兔的下頜均明顯前凸。
SNAP檢測結果顯示,正常未進行干預組(Ⅰ組)IAN波幅為 0.45mv,延遲期為 1.49ms。牽張結束時、固定期 1、2、4周時 NGF組的波幅均高于對照組;牽張結束時、固定期 1、2、4周時 NGF組的潛伏期均低于對照組(表 1,圖 3、4)。
應用 SPSS10.0軟件包進行 student t檢驗,分析NGF組與對照組之間波幅和潛伏期的差異。P<0.05為有統計學差異。在牽張結束時、固定期 1周兩組之間的波幅和潛伏期無統計學差異,而固定期2、4周 NGF組的波幅和潛伏期均顯著高于對照組(P<0.05)。表明,牽張成骨中下齒槽神經在固定期 2、4周的神經功能好于對照組。
表1 兩組波幅及潛伏期(±s)
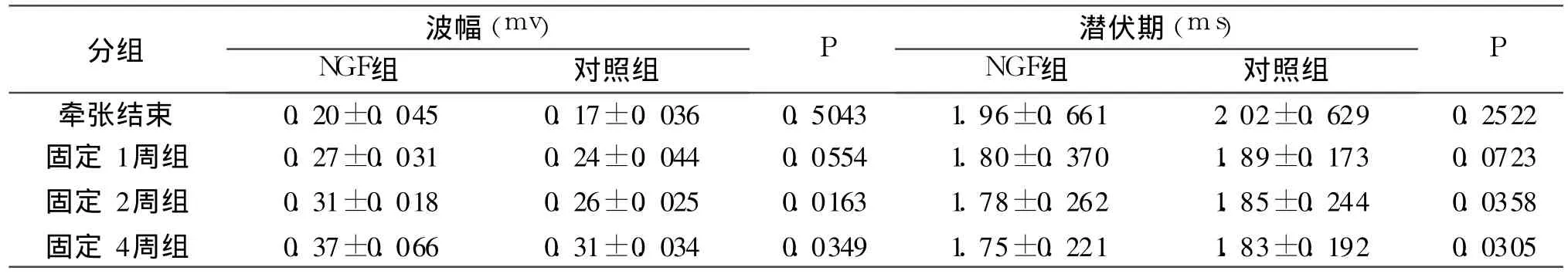
表1 兩組波幅及潛伏期(±s)
分組 波幅(mv)NGF組 對照組P 潛伏期(ms)NGF組 對照組P牽張結束 0.20±0.045 0.17±0.036 0.5043 1.96±0.661 2.02±0.629 0.2522固定 1周組 0.27±0.031 0.24±0.044 0.0554 1.80±0.370 1.89±0.173 0.0723固定 2周組 0.31±0.018 0.26±0.025 0.0163 1.78±0.262 1.85±0.244 0.0358固定 4周組 0.37±0.066 0.31±0.034 0.0349 1.75±0.221 1.83±0.192 0.0305

圖3 NGF組 SNAP波形(橫箭頭為延遲期,縱箭頭為波幅)
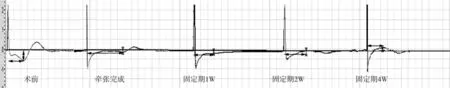
圖4 對照組 SNAP波形(橫箭頭為延遲期,縱箭頭為波幅)
討 論
牽張成骨技術已經成為一種治療下頜骨畸形或缺損的重要方法。NGF是 20世紀 50年初由 Levi.Montalcini在小鼠肉瘤細胞內發現的第 1個神經營養因子,通常稱為 7sNGF。NGF對中樞和外周神經系統的生物效應是維持和促進交感神經及來自神經嵴的感覺神經細胞的存活、分化、成熟以及發揮功能,是參與損傷神經再生和功能修復的重要因素。有研究認為未成熟的感覺神經含有大量的 NGF受體,有 NGF依賴性,直接影響到它的發育和成熟。無論是局部注射或全身注射外源性的 NGF都能起到防止神經切斷術后感覺神經細胞的死亡。盡管成熟的感覺神經已經不及未成熟神經依賴于 NGF,但仍然具有 NGF受體,而且能夠作為靶原型逆向營養因子影響上一級神經元,表明 NGF在成熟的感覺神經中依然起到很大的作用[14]。
很多研究已經證實了局部應用 NGF修復外周神經(包括 IAN)的良好效果。同時 Eppley等[15]在應用 NGF修復兔下牙槽神經缺損時還發現再生的神經軸突周圍有新生骨質生成。研究表明,NGF可能通過如下 3種途徑促進成骨:(1)誘導感覺和交感神經纖維長入骨痂,感覺和交感神經纖維在正常骨代謝和骨折愈合中發揮重要的作用,喪失這兩種神經纖維支配的骨組織會表現為鈣化不良或骨質疏松,而 NGF正是促進這兩種神經纖維發育和再生的主要因子之一[16];(2)直接促進成骨細胞的分化并抑制其凋亡[15];(3)促進局部組織血管生成[17]。但是局部注射存在以下不足之處:局部注射勢必要對牽張區造成二次創傷,可能造成局部的物理損傷、炎癥、疼痛甚至引起感染等潛在的并發癥;局部注射的生長因子代謝快,能暫時形成有效的濃度,但是持續時間不長,雖然緩釋載體的應用一定程度上維持了局部注射生長因子的作用時間,但是也存在材料的降解產物反應等諸多問題。全身注射 NGF不僅能夠避免上述醫源性損傷的出現,而且除了直接作用于牽張區外,還可能通過作用于中樞促進外周神經的恢復,在體內維持有效的作用時間。另外,全身注射 NGF還有方法簡便、不良反應小的優點,而且從心理上更容易被患者接受,可作為一種輔助治療手段,有廣泛的臨床應用前景。近幾十年來國內外對全身注射 NGF的作用機制和臨床應用進行了頗多研究,陳燕濤等[18]在對 48例周圍神經損傷患者的治療中發現,全身應用 NGF對周圍神經損傷的恢復有顯著的促進作用,同時患者疼痛和乏力癥狀的改善要明顯優于對照組。韓汝政等[19]用NGF治療顱神經損傷 70例(肌內注射 NGF)與對照組(常規支持療法)相比,痊愈率、有效率均高于對照組,并能顯著縮短病程,早期應用更佳。張素愛等[20]全身應用 NGF對 98例面神經炎的患者進行治療,結果顯示 NGF對面神經功能的恢復在早期即具有促進作用,且隨療程延長,療效進一步增加,NGF配合常規治療明顯縮短面神經炎病程,改善預后,并具有不良反應少等優點。Santos等[21]在全身應用 NGF對大鼠燒傷的研究中,證實 NGF不僅能防止外周神經元的死亡而且還能降低血管通透性和血液黏稠度。綜上所述,全身應用 NGF對中樞神經、外周神經、運動神經或是感覺神經損傷的修復都有顯著的促進作用,而且能不同程度減輕患者的痛苦。
下齒槽神經走行于狹窄的骨性下頜管,下頜骨截骨、牽張器安裝、骨斷端的移位以及對神經的拉伸都有可能對 IAN產生直接的損傷[4]。牽張成骨中,由于截骨術后組織滲出、組織的低氧、牽張過程中對周圍軟組織的延長勢必導致牽張區壓力的大大增加,動靜脈回流受阻,從而對 IAN造成間接的損傷,類似于正中神經的“腕管綜合征”[22]。然而下頜骨的牽張是造成 IAN損傷的最主要因素,牽張中不僅要延長下頜骨及其周圍肌肉等軟組織,重要的是在牽張的同時對 IAN也進行了延長,雖然 IAN有一定的可塑性,但是依然會造成 IAN的損傷甚至是不可逆的損傷。Rostcam等[23]認為牽張成骨是造成 IAN損傷的機械因素,即使以 0.5mm/12h的速度牽張仍然會導致 IAN的損傷。為了能促進 IAN的修復及下頜骨的成骨并縮短 DO周期,NGF作為經典的促神經修復因子,其固有的修復 IAN和促進成骨作用愈加受到重視。
牽張過程中對 IAN的延長導致的髓鞘崩解和巨噬細胞的入侵,牽張區的各種內源性因子表達明顯增高,隨著牽張結束這些因子逐漸恢復到正常水平[11]。因此,外源性因子的最佳干預時機應該選在牽張成骨的固定期。但是同時參考臨床上治療外周神經損傷的時機、方法、劑量及療程[18-20],為了充分的發揮 NGF的作用,我們在牽張器植入術后立即給予肌注 NGF,每日 1次,直到固定期 1周結束。
近兩個世紀,神經電生理的方法檢測下牙槽神經的功能,在臨床和實驗中已經得到了廣泛的應用,神經電生理的方法無論在敏感性還是特異性上有著獨到的優勢[4,24]。近年來大量文獻證實,用誘發神經動作電位的方法能很好的檢測在牽張成骨中各個時期神經的受損情況[4]。本實驗采用 BL-420F生物功能實驗系統及檢測設備誘發并記錄 IAN的SNAP,波形穩定,重復性好,結果可靠。在 SNAP檢測中,波幅降低說明有一定數量的神經纖維斷裂、軸突缺失;潛伏期延長則說明有節段性軸突脫髓鞘變,神經纖維傳導速度降低,由此可反映神經的功能。實驗中我們采取完全解剖游離 IAN的方法,排除了周圍組織對檢測結果的影響,能充分反映 IAN的功能。我們發現,在牽張結束時、固定期 1周,雖然全身注射 NGF組 IAN的 SNAP波幅高于對照組,延遲期低于對照組,但沒有統計學差異。而固定期2、4周全身注射 NGF組 IAN的 SNAP波幅明顯高于對照組,延遲期明顯低于對照組(P<0.05),在統計學上有顯著差異,與王曉霞等[3]、Makarov等[4,5]的研究相符。數據表明,在牽張結束時及固定期 1周,可能由于牽張應力等因素誘發的內源性 NGF及其受體明顯表達增高,雖然牽張完成應力消失,但是牽張區的內源性因子還會保持一定的水平,因此此期間外源性 NGF對 IAN損傷的修復作用并不明顯。而到固定期 2周后隨著刺激因素消失和代謝作用,內源性的 NGF表達顯著降低,全身注射 NGF能維持外源性 NGF在體內的濃度,持續發揮修復 IAN損傷的作用。
總之,全身注射神經生長因子有利于牽張成骨中下齒槽神經功能的恢復,這有望為臨床上減少DO治療的神經并發癥提供一種有效的方法。
[1]Ilizarov GA.The tension-stress effect on the genesis and growth of tissues:PartⅡ.The influence of the rate and frequency of distraction[J].Clin Orthop Relat Res,1989,(239):263-285.
[2]McCarthy JG,Schreiber J,Karp N,et al.Lengthening the humanmandible by gradual distraction[J].Plast Reconstr Surg,1992,89(1):1-10.
[3]王曉霞,王興,李自力,等.下頜骨牽引成骨術對下牙槽神經功能影響的實驗研究[J].中華口腔醫學雜志,2002,37(1):50-53.
[4]Makarov MR,Harper RP,Cope JB,et al.Evaluation of inferior alveolar nerve function during distraction osteogenesis in the dog[J].JOral Maxillofac Surg,1998,56(12):1417-1423.
[5]Marina R,MakarovMR,Samchukov ML,et al.The effectof gradual traction on peripheral nerve[M].Craniofacial Distraction Osteogenesis,2001.89-101.
[6]SniderWD,Johnson EM.Neurotrophic molecules[J].Ann Neurol,1989,26(4):489-506.
[7]Barinaga M.Neurotrophic factors enter the clinic[J].Science,1994,264(5160):772-774.
[8]Hayashida K,Clayton BA,Johnson JE,et al.Brain derived nerve growth factor induces spinal noradrenergic fiber sprouting and enhances clonidine analgesia following nerve injury in rats[J].Pain,2008,136(3):348-355.
[9]Shao Y,Ma H,Wu Y,etal.Effectof nervegrowth factoron changes ofmyelin basic protein and functional repair of peripheral nerve following sciatic nerve injury in rats[J].Chinese Journal of Traumatology(English Edition),2002,5(4):237-240.
[10]Byun JH,Lee JH,Choi YJ,et al.Co-expression of nerve growth factor and p75NGFR in the inferior alveolar nerve after mandibular distraction osteogenesis[J].Int J Oral Maxillofac Surg,2008,37(5):467-472.
[11]Aiga A,Asaumi K,Lee YJ,et al.Expression of neurotrophins and their receptors tropomyosin-related kinases(Trk)under tension-stress during distraction osteogenesis[J].Acta Med Okayama,2006,60(5):267-277.
[12]Park BW,Kim JR,Lee JH,et al.Expression of nerve growth factor and vascular endothelialgrowth factor in the inferior alveolar nerve after distraction osteogenesis Int[J].JOral Maxillofac Surg,2006,35(7):624-630.
[13]Wang L,Zhao Y,Cheng X,et al.Effects of locally applied nerve growth factor to the inferior alveolar nerve histology in a rabbitmodel of mandibular distraction osteogenesis[J].Int JOral Maxillofac Surg,2009,38(1):64-69.
[14]Barry L,Epp ley MD,Robert V,et al.Efficacy of nerve growth factor in regeneration of the mandibu lar nerve:a preliminary report[J].JOral Maxillofac Surg,1991,49(1):61-68.
[15]Epp ley BL,Snyders RV,Winkelmann TM,et al.Efficacy of nerve growth factor in regeneration of the mandibular nerve:a preliminary report[J].JOral Maxillofac Surg,1991,49(1):61-68.
[16]Wang L,Sun MY,Jiang YG,et al.Nerve growth factor and tyrosine kinase A in human salivary adenoid cystic carcinoma:expression patterns and effects on in vitro invasive behavior[J].JOralMaxillofac Surg,2006,64(4):636-641.
[17]Grills BL,Schuijers JA,Ward AR,et al.Topical application of nerve growth factor improves fracture healing in rats[J].JOrthop Res,1997,15(2):235-242.
[18]陳燕濤,何清,劉尚禮,等.神經生長因子治療周圍神經損傷的前瞻性研究[J].中華創傷骨科雜志,2006,8(8):744-746.
[19]韓汝政,李化偉,耿正順,等.神經生長因子治療顱神經損傷的臨床研究[J].中華實用中西醫雜志,2005,18(10):1457-1458.
[20]張素愛,陸素琴,儲旭華,等.神經生長因子治療面神經炎 45例的療效觀察[J].臨床神經病學雜志,2006,19(5):392.
[21]Santos FX,Escudero M,Perez L,et al.Comparison of the effects of nerve growth factor and superoxide dismutase on vascular extravasation in experimental burns[J].Burns,1995,21(6):445-448.
[22]Yoshii Y,Zhao C,James D,et al.The effects of hypertonic dextrose injection on connective tissue and nerve conduction through the rabbit carpal tunnel[J].Arch Phys Med Rehabil,2009,90(2):333-339.
[23]Rostcam D,Farhadieh.The roleof nerve growth factor and brain-derived neurotrophic factor in inferior alveolar nerve regeneration in distraction osteogenesis[J].JCraniofacial Surg,2003,14(6):859-865.
[24]ColinWB.Conduction velocity of the human inferior alveolar nerve[J].Arch Otolaryngol Head Neck Surg,1997,123(2):185-189.

