?花生根瘤菌的分離鑒定及對重金屬的抗性研究?
摘要:為篩選對多種重金屬具有較強抗性的根瘤菌,通過從重金屬污染農田采集的花生根瘤中分離純化,得到34株根瘤菌,對其進行系統進化分析并構建16S rRNA基因系統發育樹,以及對重金屬(Cu2+、Ni2+、Cr6+、Zn2+)的抗性分析。結果顯示,34株根瘤菌中有33株屬于根瘤菌屬(Rhizobium),1株屬于中華根瘤菌屬(Ensifer);對Cu2+具有較強抗性的菌株為HG6、HG13、HM13、HM23、HM52,對Ni2+具有較強抗性的菌株為HM13、HW23、HW45,對Cr6+具有較強抗性的菌株為HM14、HM21、HM23、HW2,對Zn2+的抗性較強的菌株為HG6、HM1、HM52、HW20;HG13對4種重金屬均具有較好抗性。
關鍵詞:花生;根瘤菌;重金屬;抗性
中圖分類號:S565.2; Q939.11+4 文獻標識碼:A 文章編號:1006-060X(2024)10-0017-06
Peanut Rhizobia: Isolation, Identification, and Characterization of Resistance to Heavy Metals
SONG Dan-ping1,WU Hang-yu2,WANG Ya-ting1,DU Yan-ling1,HU Ji3,CHEN Jing-lin4,
YU Xiu-mei4,ZHANG Yu-ting3,CUI Yong-liang2
(1. Chengdu Academy of Environmental Sciences, Chengdu 610072, PRC; 2. Sichuan Provincial Academy of Natural Resources Science, Chengdu 610015, PRC; 3. Chengdu Branch of Sichuan Provincial Academy of Natural Resources Science, Chengdu 610213, PRC; 4. College of Resources, Sichuan Agricultural University, Chengdu 611130, PRC)
Abstract: To screen out the rhizobia with strong resistance to heavy metals, we isolated 34 strains of rhizobia from peanut nodules in the heavy metal-contaminated farmland. A phylogenetic tree was built for these strains based on the 16S rRNA gene sequences. Furthermore, the resistance of these strains to heavy metals (Cu2+, Ni2+, Cr6+, and Zn2+) was evaluated. The results showed that 33 out of the 34 strains belonged to Rhizobium and 1 strain belonged to Ensifer. Strains HG6, HG13, HM13, HM23, and HM52 demonstrated strong resistance to Cu2+. Strains HM13, HW23, and HW45 showed strong resistance to Ni2+. Strains HM14, HM21, HM23, and HW2 had strong resistance to Cr6+. Strains HG6, HM1, HM52, and HW20 showcased strong resistance to Zn2+. Strain HG13 had strong resistance to all the four heavy metals.
Key words: peanut; rhizobia; heavy metal; resistance
土地污染影響植物生長,最終可能對人類健康造成威脅[1],且對土壤的組成、結構和功能產生嚴重的負面影響[2]。農田重金屬污染對土壤質量、作物生長發育、農產品品質以及人類健康造成不同程度的影響[3],每年因重金屬污染而導致的糧食損失達到1 200萬t,造成極大的經濟損失[4]。目前,土壤重金屬污染的修復主要通過利用物理學(客土、換土、深耕翻土,等)、化學(添加改良劑)、生物學(植物、動物、微生物)等方面的技術降低或除去環境中的重金屬污染物[5],其中,生物學修復是一種沒有二次污染風險的修復方法[6]。
土壤重金屬污染的地方,土壤貧瘠是除重金屬脅迫外影響植物生長的最大障礙[7],通過利用微生物與植物的共生關系,可幫助植物吸收土壤養分,促進植物生長,增強植物對土壤重金屬的富集作用[8],
大大提高了土壤重金屬污染的凈化效率,具有很高的利用和研究價值。利用植物與微生物特殊的生態系統地位[9],使用“豆科植物-根瘤菌”共生體系修復土壤重金屬污染是近年來土壤修復領域關注熱點之一[10-11]。張志權等[12]發現尾礦上的銀合歡根瘤菌的共生體系在吸收土壤中的重金屬Pb時具有明顯優越性,80%的重金屬Pb都積累在銀合歡的根系和莖里;樊妙春[13]通過在鉛鋅礦上種植刺槐對當地重金屬污染土壤進行修復,發現刺槐根系存在的根瘤菌對Cu、Zn和Cd有抗性,有利于刺槐對重金屬污染土壤進行修復;宋修勇[14]發現,天藍苜蓿同時接種根瘤菌和促生菌時,生物量顯著提高,促進其對Cu和Zn的吸收。李蕾等[15]通過研究篩選出了對Pb、Cr具有較強抗性的花生品種濰花八號;葛一陳[16]發現花生的根莖葉對Cd有較強的富集能力,且花生粕餅中的重金屬含量能通過萃取降到國家飼料衛生標準以下。但目前對花生根瘤菌的重金屬抗性研究較少,花生根瘤菌在重金屬污染土壤修復方面的應用潛力有待發掘。
本研究通過從重金屬污染土壤中的花生根瘤中分離純化出花生根瘤菌,研究重金屬污染農田土壤中花生根瘤菌的多樣性,測定花生根瘤菌的重金屬抗性,篩選出具有重金屬抗性的花生根瘤菌,為實現重金屬污染農田土壤修復提供可利用的菌株資源。
1 材料與方法
1.1 試驗材料
1.1.1 重金屬標準液 稱取CuCl2·2H2O 5.37 g,
NiSO4·6H2O 8.96 g,K2Cr2O7 5.66 g,ZnSO4·7 H2O
8.85 g。將上述藥品分別溶解在200 mL蒸餾水中,得到Cu2+、Ni2+、Cr6+、Zn2+含量分別為10 000 mg/L的重金屬標準液。
1.1.2 YMA培養基 甘露醇1.0 g/L,酵母粉1.5 g/L,K2HPO4·3H2O 0.5 g/L,MgSO4·7H2O 0.2 g/L,NaCl 0.1 g/L,pH值7.0~7.2,121~126 ℃濕熱滅菌30 min[17]。
1.1.3 主要儀器 恒溫培養箱,恒溫震蕩搖床,酒精燈,離心機,分光光度計,高壓滅菌鍋,超凈工作臺,接種環等。
1.2 試驗方法
1.2.1 花生根瘤的采集 2021年8月在位于廣漢、綿竹、溫江的典型重金屬污染農田(土壤Cd背景值為0.35 mg/L以上)種植的花生中以五點取樣法采集圓潤飽滿的花生根瘤,共采集17個樣點,將采集的根瘤密封在無菌自封袋中,回到實驗室分離花生根瘤菌。
1.2.2 花生根瘤菌的分離與純化 (1)在收集到的花生根瘤中挑選出大小合適且圓潤飽滿的根瘤,用清水洗去根瘤表面泥土后浸入95%的酒精,用無菌水沖洗5次。
(2)將表面滅菌后的根瘤放入離心管,用玻璃棒將根瘤搗碎,將同一采樣點的樣品混合,接種環沾取汁液用平板劃線法接種在含有剛果紅的YMA平板培養基上,在28 ℃下倒置培養1 d,將上述操作得到的菌種重復接種培養3~5次,得到形態單一的菌落。
(3)用接種環將單個菌落轉移到鏡片上,用《微生物分類學》[18]中對細菌的鑒定方法對其進行革蘭氏染色后鏡檢,觀察并記錄,將從廣漢樣點采集的根瘤中分離得到的根瘤菌種編為HG序號,綿竹的編為HM序號,溫江的編為HW序號。將純化完成的形態單一的菌種保種于YMA斜面培養基上,放入恒溫培養箱培養2 d后冷藏;同時接種到液體YMA培養基中獲得新鮮的菌懸液,將0.9 mL菌懸液與0.9 mL60%的甘油混勻冷凍保存。
1.2.3 花生根瘤菌的分子鑒定與系統進化分析 (1)根瘤菌DNA提取。將根瘤菌菌株接種于YMA液體培養基中,放于28 ℃恒溫搖床培養得到菌懸液;在4 ℃、12 000 r/min條件下離心5 min得到菌體;用500 μL 1xTE緩沖液洗滌3次;加入800 μL GUTC緩沖液,混勻后室溫靜置30 min,加入50~60 μL硅藻土,混勻后室溫吸附15 min,12 000 r/min離心5 min,棄上清液;再加入500 μL GUTC緩沖液,混勻,室溫放置10 min,12 000 r/min離心5 min,棄上清液;加入500 μL1xTE緩沖液洗滌,12 000 r/min離心1 min,棄上清液,重復3次;再用600 μL 70%乙醇洗滌一次,12 000 r/min離心1 min,棄上清液;最后用600 μL 70%乙醇洗滌一次,12 000 r/min離心1 min,棄上清液;在37 ℃下真空干燥沉淀物讓乙醇揮發完全;用超純水懸浮沉淀物,并于55~60 ℃下保溫10 min,離心提取上清液,放置-20 ℃冰箱內備用。
(2)16S rRNA基因的檢測和分析。以總DNA為模板擴增16S rRNA基因,PCR擴增引物是27F:5'-AGAGTTTGATCCTGGCTCAG-3',1492R:5'-GGTTACCTTGTTACGACTT-3'。在95 ℃下預變性5 min,溫度不變再變性1 min,溫度降至56 ℃退火30 s,72 ℃下延伸1 min,循環30次,最后在72 ℃下延伸10 min。PCR擴增產物用瓊脂糖凝膠電泳檢測,然后送往生工生物工程(成都)有限公司測序,基因序列在GenBank數據庫中進行BLAST序列比對相似性分析,并用MEGA7.0鄰接法構建16S rRNA基因的系統發育樹,確定花生根瘤菌的進化地位。
1.2.4 根瘤菌的重金屬抗性測定 配置相同的YMA液體培養基,在5 mL培養基試管中分別加入不同濃度梯度直到菌株死亡的Cr6+、Cu2+、Ni2+、Zn2+重金屬溶液,其中Cu2+、Ni2+濃度梯度設置為從0 mg/L開始以10 mg/L為梯度遞增,Cr6+濃度梯度設置成從0 mg/L開始以4 mg/L為梯度遞增,Zn2+濃度梯度設置為從0 mg/L開始以20 mg/L為梯度遞增;將篩選的菌株液以1∶100的比例接種到培養基中,28 ℃、150 r/min培養2 d后用分光光度計測定OD600,與加重金屬但不加菌的培養基進行對照,以此確定菌株的生長狀況(OD600≥0.1視為可生長),分析獲得重金屬對菌株的最低抑制濃度(菌株生長受到明顯抑制時的最低重金屬濃度)和最低致死濃度(導致菌株死亡時的最低重金屬濃度),并根據結果篩選出對重金屬抗性較強的優勢菌株。
1.3 數據處理
實驗數據的處理采用Excel office 2010對數據進行統計,SPSS17.0對數據進行顯著性差異的分析,用軟件?MEGA作圖。
2 結果與分析
2.1 花生根瘤菌的分離純化
從17個樣點采集的根瘤中共獲得34個根瘤菌菌株,其中來自廣漢的有9個菌株(HG1~HG9)、綿竹12個菌株(HM1~HM12)、溫江13個菌株(HW1~HW13)。分離得到菌株經培養所形成的菌落均為乳白色不透明圓形,邊緣整齊,微微有凸起,表面濕潤有光澤,為革蘭氏陰性菌,桿狀且無芽孢。
2.2 花生根瘤菌的系統進化分析
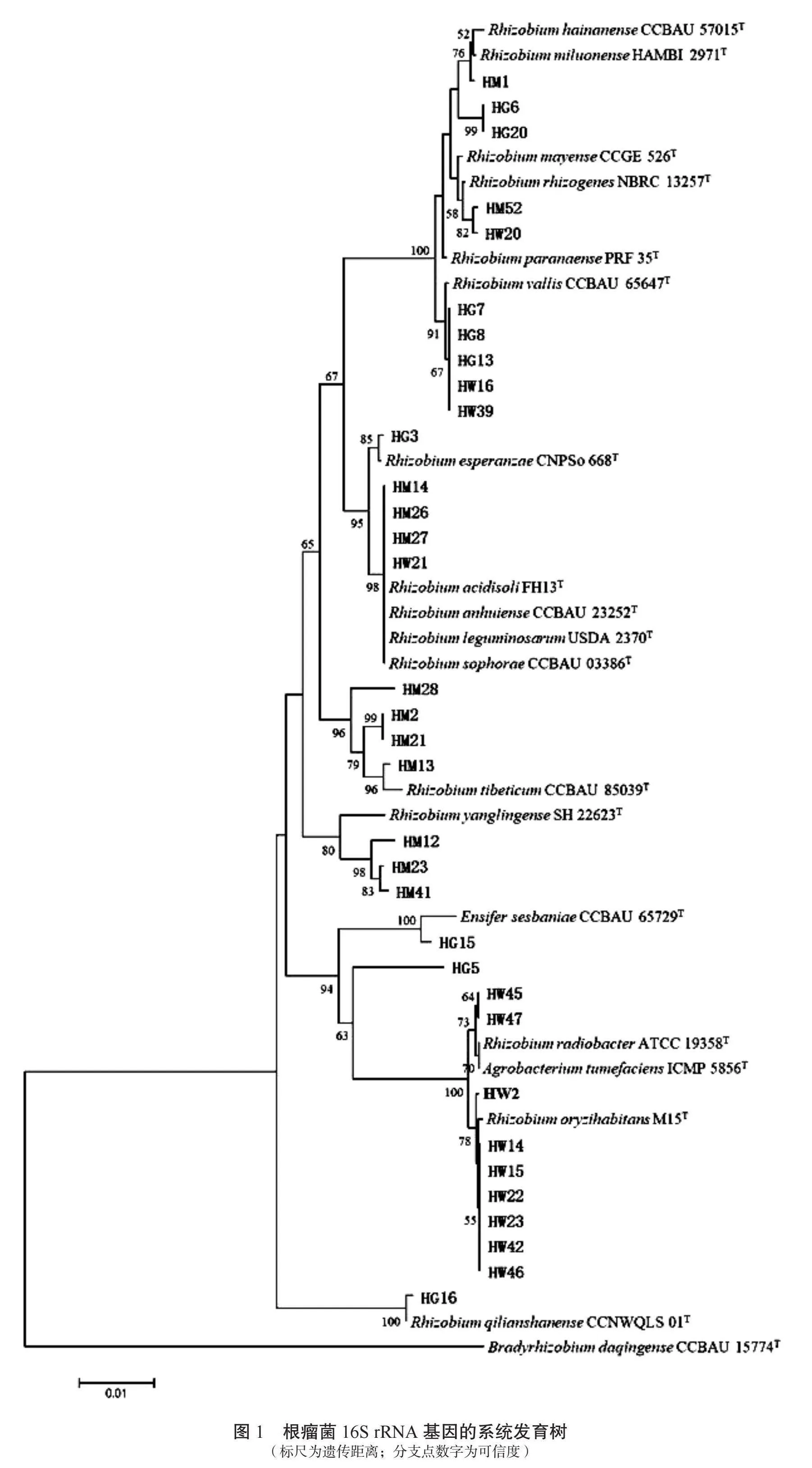
對分離純化所得34株初步判斷為根瘤菌的菌株進行系統進化分析,構建系統發育樹(圖1)。結果顯示,其中33個菌株靠近根瘤菌屬(Rhizobium),1個菌株(HG16)靠近中華根瘤菌屬(Ensifer),均屬于根瘤菌目根瘤菌科。
2.3 花生根瘤菌對重金屬的抗性分析
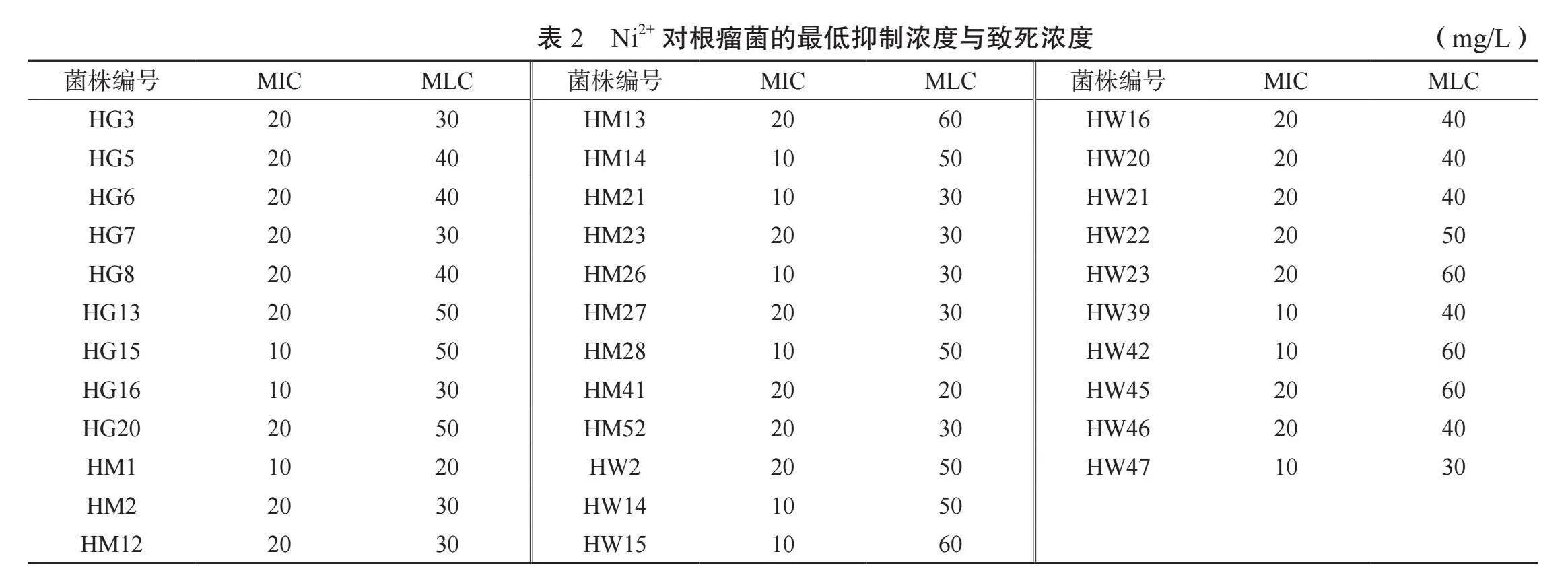
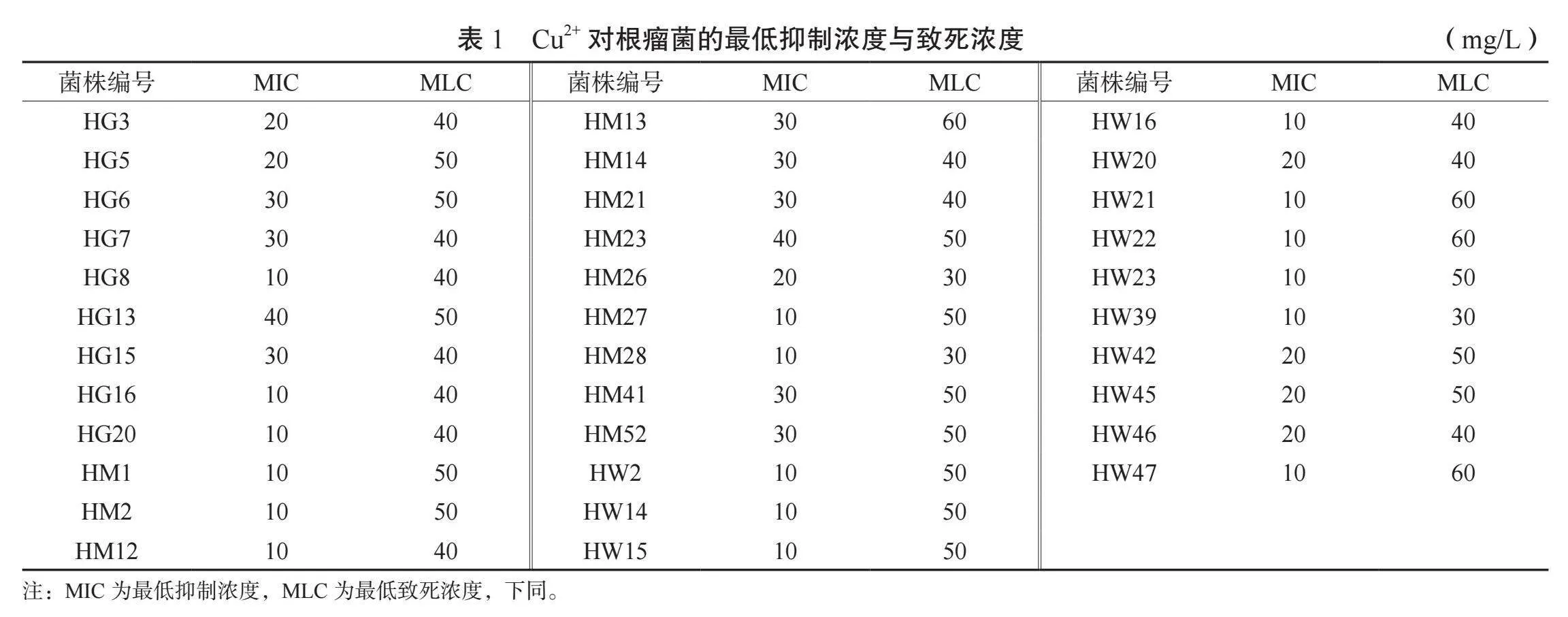
2.3.1 花生根瘤菌種對Cu2+的抗性分析 由表1可知,Cu2+對不同菌株的最低抑制濃度在10 mg/L到40 mg/L之間,其中10 mg/L的根瘤菌菌株有17個、20 mg/L的7個、30 mg/L的8個、HG13和HM23為40 mg/L;最低致死濃度在30~60 mg/L,其中30 mg/L的有3個菌株,40~50 mg/L的菌株有27個,HM13、HW21、HW22、HW47為60 mg/L。結果表明,對Cu2+具有較強抗性(MIC≥30 mg/L,MLC≥50 mg/L)的根瘤菌菌株有HG6、HG13、HM13、HM23、HM52。
2.3.2 花生根瘤菌對Ni2+的抗性分析 表2顯示,Ni2+對絕大多數菌株的最低致死濃度處于30 ~50 mg/L之間,HM13、HW15、HW23、HW42、HW45對Ni2+抗性相對較高,達到60 mg/L;最低抑制濃度處于10 ~20 mg/L之間,其中64.7%的菌株最低抑制濃度為20 mg/L,而HM41的最低抑制濃度即為其最低致死濃度。結果表明,對Ni2+具有較強抗性(MIC=20 mg/L,MLC=60 mg/L)的菌株為HM13、HW23和HW45
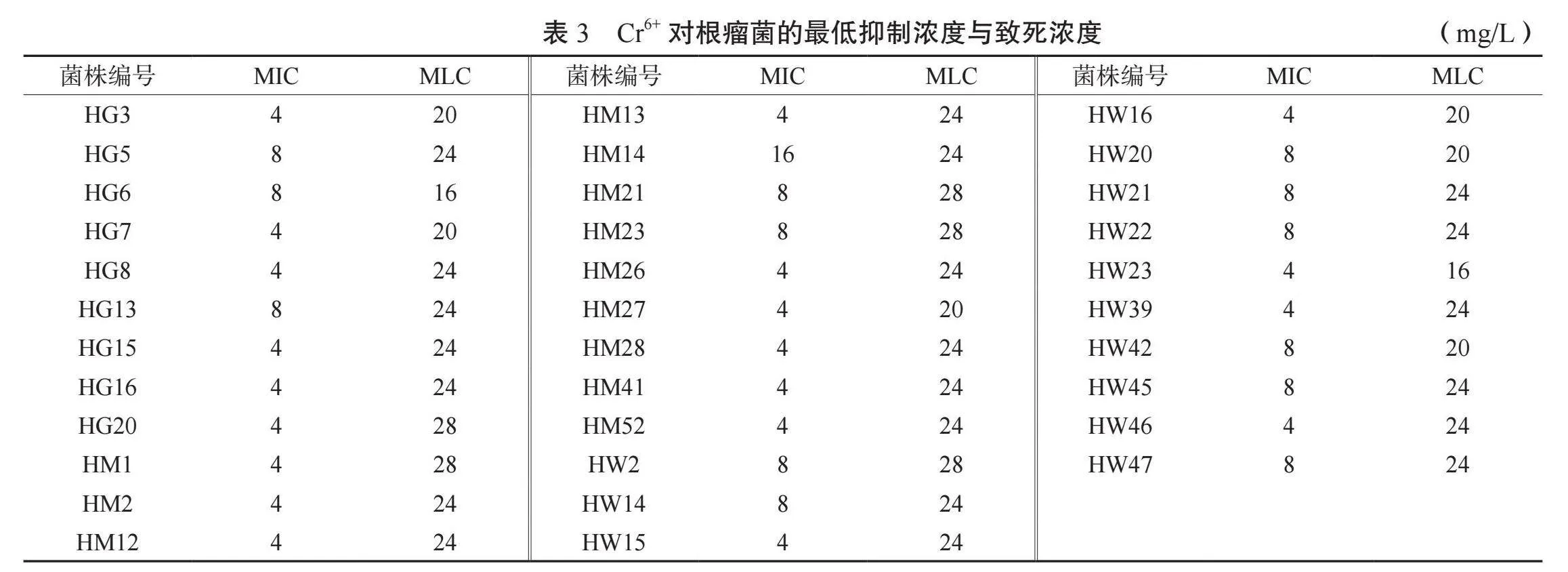
2.3.3 花生根瘤菌對Cr6+的抗性分析 由表3可知,HM14在Cr6+濃度達到16 mg/L時受到明顯抑制作用,其余33個菌株的最低抑制濃度均處于4~8 mg/L之間,其中有20個菌株的最低抑制濃度為4 mg/L,占總數的59%;HG16、HW23的最低致死濃度為16 mg/L,HG20、HM1、HM21、HM23、HW2為28 mg/L,其余的27個菌株處于20~24 mg/L之間。結果表明,對Cr6+具有較強抗性(MIC≥16 mg/L,MLC≥24 mg/L;或MIC≥8 mg/L,MLC≥24 mg/L)的菌種有HM14、HM21、HM23和HW2。
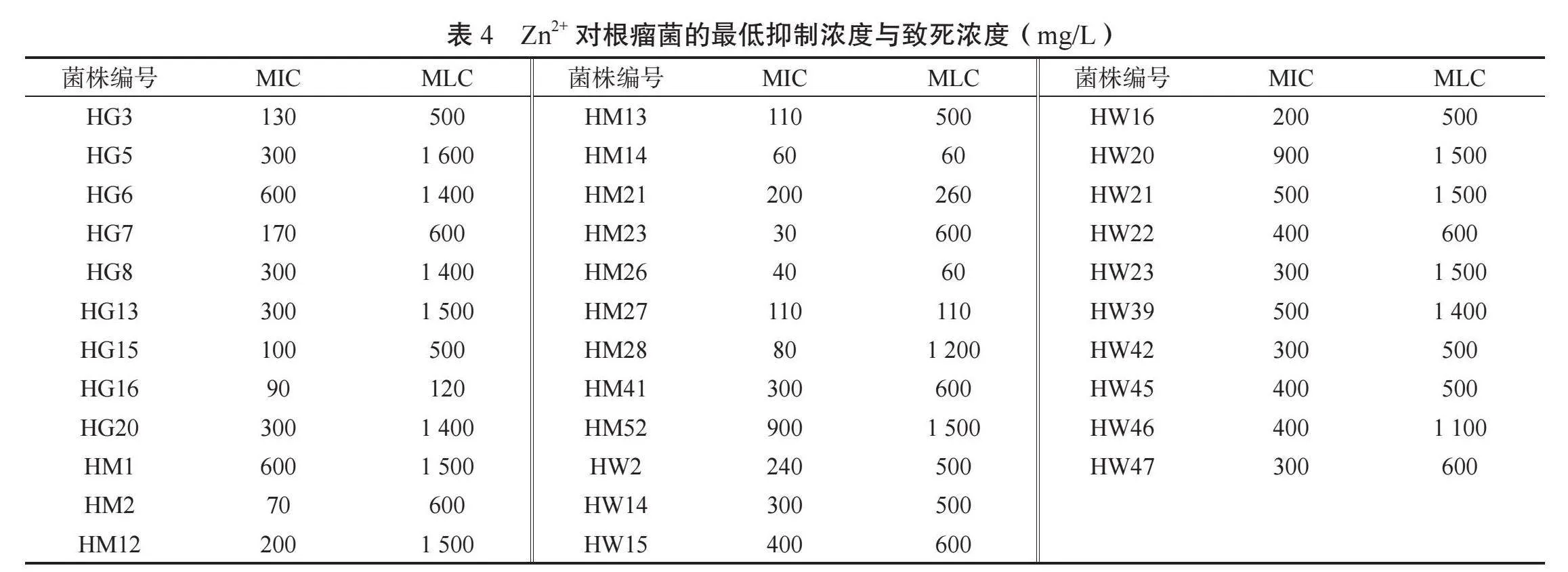
2.3.4 花生根瘤菌對Zn2+的抗性分析 由表4可知,Zn2+對34個根瘤菌菌株的最低抑制濃度存在較大差異,HG15、HG16、HM2、HM14、HM23、HM26、HM28在100 mg/L及以下,HM52、HW20為900 mg/L,其余25種在110 ~600 mg/L之間;53.0%根瘤菌菌株在Zn2+脅迫下的最低致死濃度在100~1000 mg/L之間,HM14、HM26小于100 mg/L,其中HM14的最低致死濃度等于其最低抑制濃度;14個菌株的最低致死濃度大于1000 mg/L,HG5達到1600 mg/L。
結果顯示,對Zn2+的抗性較強(MIC≥600 mg/L、MLC≥1400mg/L)的根瘤菌為HG6、HM1、HM52和HW20。
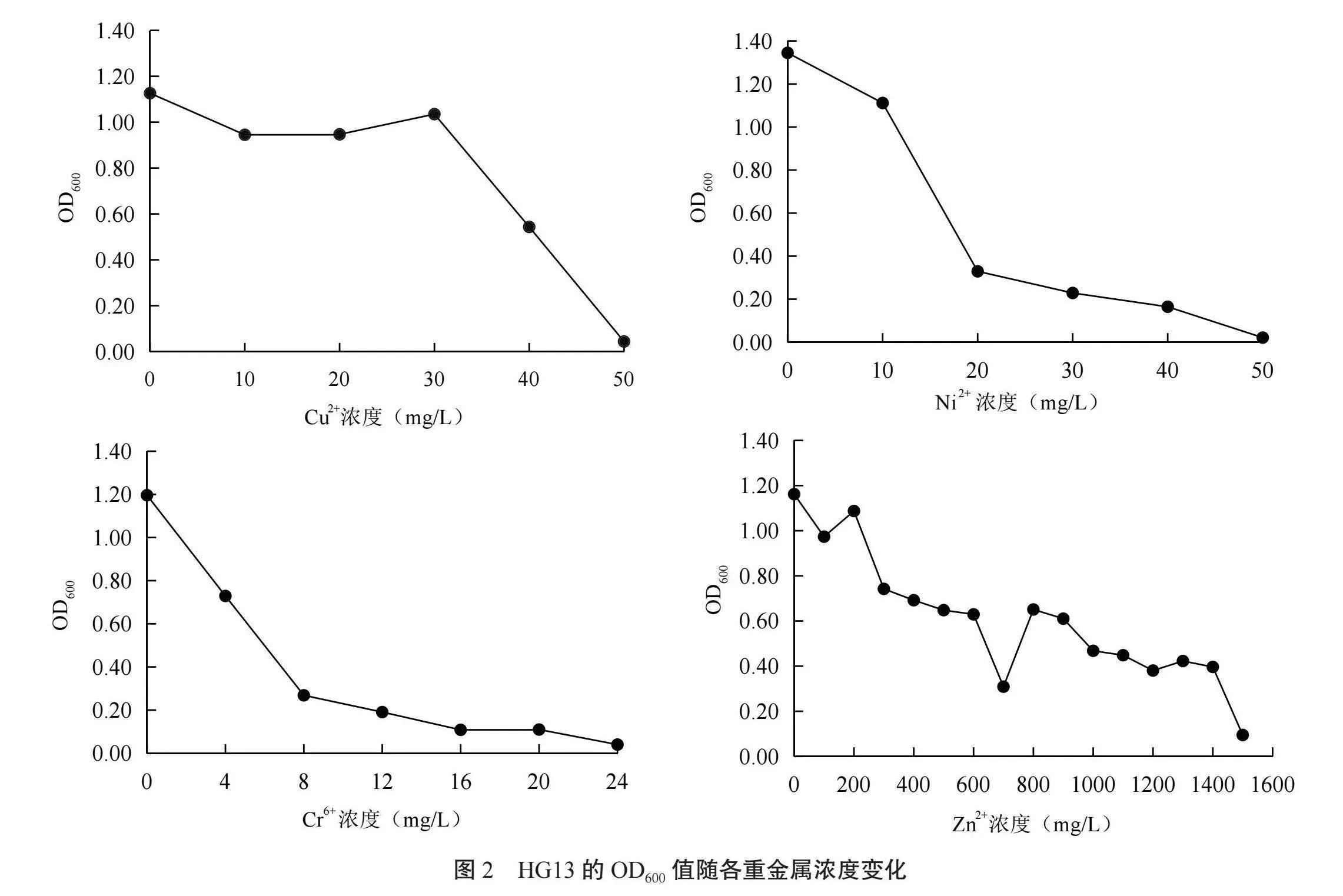
2.3.5 對4種重金屬均具有較好抗性的菌株篩選 綜合34個菌株對4種重金屬抗性結果,HG13對4種重金屬都具有較好抗性。根據HG13在各種重金屬脅迫下的OD600值做出OD600隨重金屬濃度變化曲線如圖2所示,在Cu2+濃度為0~30 mg/L時,OD600變化幅度較小,菌株生長較為良好,在40 mg/L時生長受到抑制,在50 mg/L時到達最低致死濃度;在Ni2+脅迫下的菌株生長曲線總體下降趨勢明顯,當Ni2+濃度到達20 mg/L時OD600數值快速降低,此時為HG13在Ni2+脅迫下的最低抑制濃度,當Ni2+濃度為50 mg/L時HG13才無法生長,說明HG13具有較高的最低致死濃度;跟大部分根瘤菌相同,HG13在Cr6+濃度為4 mg/L時生長便遭受明顯抑制,但HG13最低致死濃度最高,達到24 mg/L,4 mg/L到20 mg/L之間OD600下降較為平緩,菌株具有較好的生長狀況和較高的對Cr6+的抗性;從曲線可以看出,HG13對Zn2+具有較強的抗性,OD600在Zn2+濃度到達300 mg/L和700 mg/L時分別有一次明顯的下降,其余濃度均變化較為平滑,在1 500 mg/L時達到最低致死濃度,這表明HG13在較為廣泛的Zn污染值范圍內都能保持較好的生長。
3 討論
試驗選用Cu2+、Cr6+、Ni2+、Zn2+4種重金屬離子對從重金屬污染土壤中分離得到的34個花生根瘤菌菌株進行重金屬抗性試驗,得到不同重金屬濃度下根瘤菌生長情況的相關數據,結果表明,根瘤菌對Zn2+的抗性在4種重金屬中是最強的,與梁建強等[19]
所做的重金屬脅迫下根瘤菌存活率的試驗結果一致;通過設置34個根瘤菌菌株對4種重金屬的抗性進行試驗,得到了每個菌株在不同重金屬脅迫下的最低抑制濃度和最低死亡濃度數據,篩選出對4種重金屬都存在較好抗性的菌株HG13。說明HG13更易在遭受多種重金屬污染的土壤中與花生根系形成共生體,更有利于多種重金屬污染土壤的修復工作[20]。同時試驗發現,一些根瘤菌在部分重金屬的高濃度環境下反而比低濃度環境中生長更加旺盛,可能是在特定的濃度下,部分重金屬對這些根瘤菌的生長有促進作用。
4 結論
從重金屬污染農田中分離純化得到34個花生根瘤菌菌株,研究結果表明花生根瘤菌主要為Rhizobium和Ensifer。通過重金屬(Cu2+、Ni2+、Cr6+、
Zn2+)抗性試驗,篩選出對重金屬具有較強抗性的菌株:對Cu2+具有較強抗性的菌株為HG6、HG13、HM13、HM23、HM52;對Ni2+具有較強抗性的菌株為HM13、HW23、HW45;對Cr6+具有較強抗性的菌株有HM14、HM21、HM23和HW2;對Zn2+的抗性較強的菌株為HG6、HM1、HM52、HW20;HG13對4種重金屬均具有較強的抗性,為最優抗性菌株。
參考文獻:
[1] 張彩鳳. 土壤改良劑蒙脫土對污染土壤理化性質的影響[J]. 現代園藝,2019(3):10-11.
[2] 何振嘉. 淺析土壤污染類型與修復技術應用[J]. 農業研究與應用,2020,33(4):55-58.
[3] 李涵,郭歡樂,柳瑜,等. 農田土壤重金屬污染及調控措施[J]. 湖南農業科學,2018(1):40-44.
[4] 陳世寶,王萌,李杉杉,等. 中國農田土壤重金屬污染防治現狀與問題思考[J]. 地學前緣, 2019,26(6):35-41.
[5] 蔣喜艷,張述習,尹西翔,等. 土壤-作物系統重金屬污染及防治研究進展[J]. 生態毒理學報, 2021,16(6):150-160.
[6] RAJKUMAR M,SANDHYA S,PRASAD M N V,et al. Perspectives of plant-associated microbes in heavy metal phytoremediation[J].Biotechnology Advances,2012,30(6):1562-1574.
[7] WILLIAMSON. N. A. Mine wastes reclamation: the establishment of vegetation on metal mine wastes[M]. London,Eng-land: Mining Journal Books,1982.
[8] 陳楠. 微生物在重金屬污染土壤修復中的作用研究[J]. 環境科學與管理,2016,41(2):86-90.
[9] 李婷,吳明輝,楊馨婷,等. 植物與微生物對重金屬的抗性機制及聯合修復研究進展[J]. 應用與環境生物學報,2021,27(5):1405-1414.
[10] 黑澤文,向慧敏,章家恩,等. 豆科植物修復土壤重金屬污染研究進展[J]. 生態科學, 2019,38(3):218-224.
[11] 韋革宏,馬占強. 根瘤菌-豆科植物共生體系在重金屬污染環境修復中的地位、應用及潛力[J]. 微生物學報,2010,50(11):1421-1430.
[12] 張志權,束文圣,藍崇鈺,等. 土壤種子庫與礦業廢棄地植被恢復研究:定居植物對重金屬的吸收和再分配[J]. 植物生態學報,2001,25(3):306-311.
[13] 樊妙春. 刺槐—根瘤菌共生體系在重金屬污染土壤修復過程中對土壤微生物的影響[D]. 楊凌:西北農林科技大學,2017.
[14] 宋修勇. 天藍苜蓿雙接S.meliloti和A.tumefaciens后對Cu、Zn脅迫的響應[D]. 楊凌:西北農林科技大學,2018.
[15] 李蕾,張小樂,孫世中,等. 不同花生品種對土壤鉛、鎘污染的抗性研究[J]. 云南大學學報(自然科學版),2022,44(1):179-187.
[16] 葛一陳. 幾種植物對土壤重金屬的吸收及后續處理資源化的研
究[D]. 長沙:湖南農業大學,2017.
[17] 沈萍,陳向東. 微生物學實驗[M]. 4版. 北京:高等教育出版社,2007.
[18] 張紀忠主編;黃靜娟等編寫. 微生物分類學[M]. 上海:復旦大學出版社,1990.
[19] 梁建強. 西北地區金屬尾礦地根瘤菌的重金屬抗性及其系統發育研究[D]. 楊凌:西北農林科技大學,2009.
[20] FAGORZI C,CHECCUCCI A,DICENZO G C,et al. Harnessing rhizobia to improve heavy-metal phytoremediation by legumes[J]. Genes,2018,9(11):542.
(責任編輯:謝培庚)

