抑制miRNA-376c-3p對腎透明細胞癌生長的影響
鐔云輝 趙蓉 劉志明 卓奧 劉唐興
腎癌是常見的泌尿系統癌癥之一,腎透明細胞癌(clear cell renal cell carcinoma,ccRCC)是最常見的腎癌類型,約占所有原發病例的60%~80%,世界范圍內每年有大量人死于該疾病,是威脅人類生命安全的全球性惡性疾病[1-3]。微小RNA(microRNA,miRNA)表達失調是ccRCC的重要致病因素,可通過干擾細胞周期來介導ccRCC的進展[4],miR-376c-3p是一種具有抑癌作用的微小RNA,在胃癌組織中顯著表達不足并可作為其有效的生物標記物[5]。研究顯示miR-376c-3p在乳腺癌組織、乳腺癌干細胞和乳腺癌細胞系中均下調,能阻礙乳腺癌干細胞的自我更新、增殖和侵襲,降低乳腺癌細胞增殖及遷移能力并抑制其在異種移植瘤小鼠體內生長[6-7];miR-376c-3p的異位表達可通過降低細胞周期蛋白D1表達而導致神經母細胞瘤細胞周期阻滯及其細胞活力抑制[8],miR-376c-3p在口腔癌中下調并具有診斷和預測預后的潛力[9],因此推測miR-376c-3p可能成為ccRCC的診療靶點。本文通過體外培養人ccRCC細胞786-O并建立其裸鼠移植瘤模型,探究miRNA-376c-3對ccRCC的腫瘤細胞生長的影響。
1 材料與方法
1.1 材料
1.1.1 實驗動物及細胞株:①SPF級BALB/c裸鼠購于湖北貝恩特生物科技有限公司[SCXK(鄂)2021-0027],雌性,7~8周,體重18~21 g,適應飼養在濕度55%~60%、溫度22~25℃的屏障環境動物房內,1周后用于后續實驗,所有操作符合3R原則。②人ccRCC細胞系786-O、Caki-1、SN12-PM6、ACHN及正常人近段腎小管上皮細胞系HKC均購于國家實驗細胞資源共享平臺。
1.1.2 主要試劑與儀器:①miR-376c-3p inhibitor、miR-376c-3p mimics、miR-376c-3p陰性對照、miR-376c-3p與U6引物購于江蘇賽索飛生物科技有限公司;TRI試劑、一步法實時熒光定量PCR(real time quantitative PCR,RT-PCR)試劑盒購于西格瑪奧德里奇(上海)貿易有限公司;TUNEL檢測試劑盒、兔抗人Bax及Ki67一抗、吉姆薩染液、小鼠抗人Bcl-2一抗、Alexa Fluor?680偶聯驢抗兔二抗、Alexa Fluor?594偶聯驢抗小鼠二抗購于美國Abcam公司等。②ABI7500實時熒光定量PCR儀購于美國Applied Biosystems公司;CFM-200落射熒光顯微鏡購于成都市蘇凈科學器材有限公司;QP-04全自動冷凍切片機購于湖北泉林醫療設備有限公司等。
1.2 方法
1.2.1 以RT-PCR檢測HKC細胞與786-O、Caki-1、SN12-PM6、ACHN細胞系miRNA-376c-3p表達:HKC細胞與786-O、Caki-1、SN12-PM6、ACHN細胞系均以39.7℃水浴快速解凍復蘇,用含10%胎牛血清的 PRMI-1640(786-O、Caki-1、SN12-PM6細胞)或DMEM培養基(ACHN、HKC細胞)分別進行培養,傳代后收集其細胞沉淀,置于TRI試劑內混勻,遵照其試劑說明書中方法提取各細胞總RNA,以一步法RT-PCR試劑盒內預混液、引物及PCR級水制備反應體系,遵照試劑盒說明書中方法進行RT-PCR反應,得到各細胞miRNA-376c-3p及U6 循環閾值后,采用2-ΔΔCt方法分析其相對表達,確定miRNA-376c-3p及U6引物序列。見表1。

表1 基因引物序列
1.2.2 分組轉染786-O細胞:于24孔板中傳代培養786-O細胞至對數生長期,隨機分為對照組、miR-376c-3p inhibitor組、miR-376c-3p mimics組、陰性對照組,采用脂質體2000進行分組轉染:miR-376c-3p inhibitor組轉染miR-376c-3p inhibitor,miR-376c-3p mimics組轉染miR-376c-3p mimics,陰性對照組轉染miR-376c-3p陰性對照,轉染劑量及步驟均參照各自說明書中指導,對照組以等劑量脂質體2000處理,均于處理24 h后對4組細胞進行檢測。
1.2.3 以RT-PCR檢測4組786-O細胞miRNA-376c-3p表達:1.2.2中轉染后的4組細胞使用TRI試劑提取其中總RNA,進行RT-PCR反應檢測4組miRNA-376c-3p相對表達,具體方法見1.2.1。
1.2.4 以Ki67免疫熒光染色、集落生成實驗檢測4組786-O細胞增殖
1.2.4.1 Ki67免疫熒光染色:1.2.2中轉染后的4組細胞經PBS漂洗、10%甲醛固定、抗原修復、5%山羊血清封閉后,孵育兔抗人Ki67一抗(以5%山羊血清稀釋100倍)、漂洗、避光孵育Alexa Fluor?680偶聯驢抗兔二抗(以5%山羊血清稀釋200倍)、避光漂洗后使用熒光顯微鏡觀察4組細胞,拍攝其圖像后運用Image J軟件定量各組細胞總數與Ki67陽性數,根據公式:增殖率=Ki67陽性數/總數×100%算出各組細胞增殖率。
1.2.4.2 集落生成實驗:收集1.2.2中轉染后的4組細胞,經PBS漂洗后計數,每組取約60個細胞接種在12孔板中乘相應培養基中培養3周,以PBS漂洗、10%甲醛固定4組形成的細胞集落,孵育吉姆薩染液后漂洗,使用顯微鏡觀察4組細胞,拍攝其圖像后運用Image J軟件定量4組集落總數,根據公式:集落形成率=轉染組集落總數/對照組集落總數×100%算出4組細胞集落形成率。
1.2.5 以TUNEL染色檢測4組786-O細胞凋亡:1.2.2中轉染后的4組細胞經PBS漂洗、10%甲醛固定后,孵育TUNEL染液、漂洗后用顯微鏡觀察各組細胞,拍攝其圖像后運用Image J軟件定量各組細胞總數與凋亡數,根據公式:凋亡率=凋亡數/總數×100%計算4組細胞凋亡率。
1.2.6 以免疫熒光染色檢測4組786-O細胞凋亡相關蛋白Bax、Bcl-2表達并比較其Bax/Bcl-2:1.2.2中轉染后的各組細胞經PBS漂洗、10%甲醛固定、抗原修復、5%山羊血清封閉后,孵育兔抗人Bax一抗及小鼠抗人Bcl-2一抗(均以5%山羊血清稀釋100倍)、漂洗、避光孵育Alexa Fluor?680偶聯驢抗兔二抗及Alexa Fluor?594偶聯驢抗小鼠二抗(均以5%山羊血清稀釋200倍)、避光漂洗后使用熒光顯微鏡觀察4組細胞,拍攝其圖像后運用Image J軟件定量4組細胞Bax、Bcl-2陽性表達的平均熒光強度,根據公式:Bax/Bcl-2=Bax陽性表達的平均熒光強度/Bcl-2陽性表達的平均熒光強度算出各組細胞Bax/Bcl-2。
1.2.7 建立786-O裸鼠移植瘤模型并測定其腫瘤體積與質量:參考文獻[10]建立786-O裸鼠移植瘤模型:取1.2.2中轉染后的4組細胞,經PBS漂洗后計數,以PBS制成密度為1×107個/mL的細胞懸液,每組取200 μL與基質膠以5∶1的體積比混勻后接種在裸鼠右腋窩皮下,1周后觀察到裸鼠皮下有米粒大小硬塊產生表明造模成功,每組成功造模6只,繼續飼養2周后頸椎脫臼處死,剪開右腋皮膚取出腫瘤塊,使用游標卡尺測量各組腫瘤塊最長和最短徑,分別作為腫瘤長度和寬度,根據公式:體積=長度×短度2/2計算4組裸鼠腫瘤體積,然后以電子天平測量各組裸鼠腫瘤質量。
1.2.8 以Ki67免疫熒光染色及TUNEL染色分別檢測各組裸鼠腫瘤細胞增殖、凋亡。
1.2.8.1 Ki67免疫熒光染色:1.2.7中的腫瘤塊以蒸餾水清洗、10%甲醛固定后液氮內速凍,修剪為方塊后置于全自動冷凍切片機內切為5 μm厚的切片,以預冷甲醇固定后進行抗原修復,然后按照1.2.4中方法進行Ki67免疫熒光染色后用熒光顯微鏡觀察、拍攝各組細胞,用Image J軟件定量4組圖像中細胞總數與Ki67陽性數,根據公式:Ki67陽性比=Ki67陽性數/總數×100%算出4組細胞Ki67陽性比。
1.2.8.2 TUNEL染色:上述腫瘤組織冷凍切片以預冷甲醇固定后按照1.2.5中方法進行TUNEL染色,用熒光顯微鏡觀察、拍攝各組細胞后以Image J軟件定量各組圖像中細胞總數與TUNEL陽性數,根據公式:TUNEL陽性比=TUNEL陽性數/總數×100%算出4組細胞TUNEL陽性比。
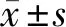
2 結果
2.1 ccRCC細胞系786-O、Caki-1、SN12-PM6、ACHN及HKC細胞miR-376c-3p表達 與HKC細胞比較,ccRCC細胞系786-O、Caki-1、SN12-PM6、ACHN中miR-376c-3p表達降低(P<0.05)。見表2。
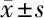
表2 5細胞miR-376c-3p相對表達 n=6,
2.2 4組786-O細胞miR-376c-3p表達 與對照組比較,miR-376c-3p inhibitor組細胞miR-376c-3p相對表達降低(P<0.05);miR-376c-3p mimics組細胞miR-376c-3p相對表達升高(P<0.05),陰性對照組細胞miR-376c-3p相對表達無明顯變化(P>0.05)。見表3。
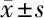
表3 4組786-O細胞miR-376c-3p相對表達 n=6,
2.3 miR-376c-3p對786-O細胞凋亡相關蛋白表達的影響 與對照組比較,miR-376c-3p inhibitor組細胞Bax/Bcl-2降低(P<0.05);miR-376c-3p mimics組細胞Bax/Bcl-2升高(P<0.05);陰性對照組細胞Bax/Bcl-2無明顯變化(P>0.05)。見表4,圖1。

圖1 免疫熒光染色檢測4組786-O細胞凋亡相關蛋白Bax、Bcl-2表達(×1 000)
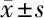
表4 4組786-O細胞Bax/Bcl-2 n=6,
2.4 miR-376c-3p對786-O細胞增殖凋亡的影響 與對照組比較,miR-376c-3p inhibitor組細胞增殖率、集落形成率升高(P<0.05),凋亡率降低(P<0.05);miR-376c-3p mimics組細胞增殖率、集落形成率降低(P<0.05),凋亡率升高(P<0.05);陰性對照組細胞增殖率、集落形成率、凋亡率無明顯變化(P>0.05)。見圖2~4,表5。

圖2 4組786-O細胞增殖(Ki67免疫熒光染色×200)

圖3 4組786-O細胞集落生成(吉姆薩染色×200)

圖4 4組786-O細胞凋亡(TUNEL染色×200)
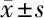
表5 4組786-O細胞增殖率、集落形成率、凋亡率 n=6,%,
2.5 miR-376c-3p對786-O裸鼠腫瘤生長的影響 與對照組比較,miR-376c-3p inhibitor組裸鼠腫瘤體積與質量升高(P<0.05);miR-376c-3p mimics組裸鼠腫瘤體積與質量降低(P<0.05);陰性對照組裸鼠腫瘤體積與質量無明顯變化(P>0.05)。見表6。
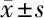
表6 4組裸鼠腫瘤體積與質量 n=6,
2.6 miR-376c-3p對786-O裸鼠腫瘤細胞增殖及凋亡的影響 與對照組比較,miR-376c-3p inhibitor組裸鼠腫瘤組織Ki67陽性比升高(P<0.05),TUNEL陽性比降低(P<0.05);miR-376c-3p mimics組裸鼠腫瘤組織Ki67陽性比降低(P<0.05),TUNEL陽性比升高(P<0.05);陰性對照組裸鼠腫瘤組織Ki67陽性比、TUNEL陽性比無明顯變化(P>0.05)。見圖5、6,表7。

圖5 4組裸鼠腫瘤細胞增殖(Ki67免疫熒光染色×200)

圖6 4組裸鼠腫瘤細胞凋亡(TUNEL染色×200)

表7 4組裸鼠腫瘤細胞Ki67與TUNEL陽性比
3 討論
ccRCC的發病率每年都在增加,手術切除腫瘤后輔助化療、放療、靶向治療和免疫檢查點抑制劑治療等是目前臨床中主流治療手段,對著ccRCC分子生物學和遺傳學研究的廣泛深入,ccRCC的治療取得了突破和巨大進展,但很多患者因進展到晚期且發生了轉移,其預后的提升仍然非常有限,因此還需深入探究ccRCC發生發展機制來改進其診療技術[11-13]。
miRNA是一種內源性表達的非編碼RNA,可通過調控抑癌或致癌基因表達而參與癌細胞增殖、生長、轉移等各種惡性生物學行為,在許多不同類型的惡性腫瘤發生發展中起著重要作用[14-15],miR-376c-3p作為一種腫瘤調控miRNA在甲狀腺癌、胃癌等多種癌癥中明顯低表達,上調其表達可抑制乳頭狀甲狀腺癌癌細胞增殖、遷移和侵襲并減弱胃癌細胞的體內外惡性行為[16-17],miR-376c-3p可對甲狀腺髓樣癌細胞的生存、遷移和侵襲起到抑制作用[18],降低miR-376c-3p表達能逆轉hsa_circ_0014130下調對胃癌惡性進展的抑制作用[19],由此預測miR-376c-3p可能是ccRCC的新型治療靶點。
本文結果顯示,人ccRCC細胞系786-O、Caki-1、SN12-PM6、ACHN中miRNA-376c-3p表達相比正常人近段腎小管上皮細胞系HKC降低,表明miR-376c-3p參與ccRCC的發生過程;以miR-376c-3p模擬物miR-376c-3p mimics上調786-O細胞miR-376c-3p表達,可降低其增殖率、集落形成率,并升高其凋亡率,其抑制劑miRNA-376c-3 inhibitorp轉染786-O細胞起到相反作用,表明過表達miR-376c-3p可抑制ccRCC細胞增殖、集落生成,并促進其凋亡,而抑制miR-376c-3p表達對ccRCC細胞發揮促增殖及抗凋亡作用;Bax、Bcl-2是重要的凋亡調控蛋白,分別起到促凋亡與抗凋亡作用,在ccRCC惡性進展中發揮關鍵作用[20],本文以miR-376c-3p mimics轉染786-O細胞可降低其裸鼠移植瘤模型腫瘤組織Ki67陽性比、腫瘤體積與質量,升高其腫瘤組織TUNEL陽性比,miRNA-376c-3 inhibitor轉染786-O細胞起到相反作用,表明上調miR-376c-3p表達可抑制ccRCC裸鼠移植瘤模型體內腫瘤細胞生長并誘導其凋亡,而抑制miR-376c-3p表達能促進裸鼠移植瘤模型體內腫瘤細胞生長并減弱其凋亡,揭示miR-376c-3p能成為潛在的ccRCC新型治療靶點,在其臨床治療中具有廣大研發前景。
綜上所述,本文證實了miRNA-376c-3p可參與介導ccRCC細胞的生長過程,抑制miR-376c-3p表達可促進ccRCC細胞增殖、集落生成及在其裸鼠移植瘤內的生長,并削弱其體內外凋亡,上調miR-376c-3p表達起到與上述相反的作用并發揮明顯抗癌功效,本文為深入研討ccRCC的致病機制提供了新型作用靶點,有助于研發及改進ccRCC臨床治療技術。

