FOXC1人表皮干細胞向汗腺細胞分化的影響
趙亞平 劉坤坤 高瑋 高慧 謝淼
人體嚴重燒傷或創傷常引發皮膚的大面積缺損,而創面修復后患者常因汗腺缺失、分泌管道被瘢痕組織阻塞而無法分泌汗液,引發體溫調節障礙[1]。如何實現汗腺修復和皮膚重建是目前醫學界關注的重點內容。表皮干細胞與汗腺均來源于外胚層,已有研究顯示表皮干細胞能在特定環境及關鍵因子的誘導下轉化為毛囊或皮脂腺,對改善創傷后皮膚重建和排汗功能具有重要意義[2]。叉頭框C1(FOXC1)蛋白是轉錄因子FOX家族重要成員,其可參與調控毛囊干細胞和造血干細胞干性[3,4],但其在表皮干細胞中作用尚不明確。本次研究通過設計合成FOXC1模擬物,通過轉染導入表皮干細胞,探究其對表皮干細胞向汗腺細胞分化的影響。
1 資料與方法
1.1 一般資料 收集2021年1月至2022年6月于我院泌尿外科行包皮環切術7例患者的正常包皮組織,年齡18~41歲,本研究取得患者知情同意和醫院倫理委員會批準。將包皮組織修剪成約1 cm×1 cm大小,加入0.25%胰酶+EDTA消化分離表皮和真皮層,Ⅳ型膠原黏附法分離表皮干細胞,然后在含人重組表皮生長因子(EGF)、K-SFM的培養基中進行培養,定期換液,觀察細胞生長情況,待生長至90%融合時消化下來,取二代表皮干細胞進行后續實驗,并根據細胞形態學特征及免疫組化檢測細胞表型結果以鑒定表皮干細胞,免疫組化檢測角蛋白(CK)19、CK18、癌胚抗原(CEA)、β1整合素(ITGB1),以CK19、ITGB1棕黃陽性表達,CK18、CEA陰性表達作為符合表皮干細胞。取處于生長對數期的表皮干細胞,按照Lipofectamine 2000轉染試劑盒說明書將FOXC1 shRNA干擾質粒、pCMV-FOXC1過表達質粒轉染至細胞中,并采用嘌呤霉素篩選穩定干擾FOXC1 表達和穩定過表達FOXC1 的細胞,分別作為過表達組和干擾組,另取一組細胞不做處理作為對照組,
1.2 試劑與儀器 胰酶-EDTA、人重組表皮生長因子(EGF)、膠質細胞無血清培養基(K-SFM)、Ⅳ型膠原(均購自美國Gibco公司),FOXC1 shRNA干擾質粒、pCMV-FOXC1過表達質粒(購自美國Origene公司),Lipofectamine 2000轉染試劑盒、Trizol試劑(美國賽默飛公司),TTBS液(上海欽誠生物科技有限公司),兔抗人CK19、CK18、CEA、ITGB1、β-actin一抗及IgG-HRP標記的羊抗兔二抗(購自美國Abgent公司),MTT試劑盒(上海超研生物科技有限公司),吉姆薩染液(上海鈺博生物科技有限公司);酶標儀(美國賽默飛公司Multiskan FC型),激光共聚焦顯微鏡(德國徠卡M525 F40型),電泳儀(上海譜振生物科技有限公司JY-1000C型),PCR儀(美國ABI公司9700型)。
1.3 RT-PCR檢測細胞FOXC1 mRNA表達 取轉染72 h后細胞采用Trizol試劑提取總RNA,并進行純化和定量。每個樣本取2 μg逆轉錄成cDNA,設計FOXC1及內參β-actin引物,隨后進行RT-PCR,反應條件:95℃ 10 min,95℃ 15 s,60℃ 1 min,40 cycles。每個樣本重復測定2次,并以2-ΔΔCt法計算FOXC1 mRNA相對表達量。
1.4 Western blot檢測細胞目的蛋白表達 取3組轉染72 h后細胞中總蛋白,并進行定量。每個樣本取50 μg進行SDS-PAGE凝膠電泳,隨后轉膜、封閉,分別加入一抗(兔抗人CK19、CK18、CEA、ITGB1、β-actin,稀釋比例均為1∶200)并4℃孵育過夜,次日用TTBS將其沖洗后加入IgG-HRP標記的羊抗兔二抗(1∶5 000)37℃孵育2 h,TTBS沖洗后曝光,系統掃描呈現,采用Image Pro-plus 6.0軟件分析灰度值,并以β-actin對比計算目的蛋白的相對表達量。
1.5 MTT實驗檢測細胞增殖水平 將細胞接種在96孔板中,每隔3天取3孔進行MTT實驗,實驗前換成新鮮培養液,并加入10% MTT,25℃孵育4 h,用移液槍移去培養基,用PBS洗滌2次,隨后加入150 μL二甲基亞砜,震蕩5 min,最后用酶標儀測定570 nm處的OD值。
1.6 吉姆薩染色檢測細胞克隆形成 轉染72h后將細胞消化下來并計數,將細胞接種到6孔板中(每孔約200個),每組設置3個重復孔,在37℃ 5%CO2中培養14 d,然后移液槍移去培養基,甲醇固定10 min后PBS沖洗2次,隨后進行吉姆薩染色10 min,將染液沖洗干凈后晾干,在顯微鏡下隨機選擇10個視野,并計算克隆形成率。
1.7 激光共聚焦顯微鏡檢測Ca2+濃度 采用激光共聚焦顯微鏡檢測細胞中Ca2+濃度,分別于轉染前、轉染72 h將孔板上細胞制備成細胞懸液,采用Ca2+探針STDIn負載表皮干細胞后在顯微鏡下觀察,每孔隨機選擇5個視野,每個視野中取10個細胞,測定細胞Ca2+平均熒光像素值。
1.8 ELISA檢測培養基上清液中MMP-2、MMP-9表達 收集各組細胞上清液,按照ELISA試劑盒說明書檢測培養基上清液中MMP-2、MMP-9濃度,并在450 nm處測得OD值,得到標準曲線及方程(MMP-2:Y=3898.4X-299.6,MMP-7:Y=2010.4X-217.5),并據此計算MMP-2、MMP-9濃度。
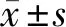
2 結果
2.1 3組RT-PCR、Western blot檢測FOXC1 mRNA及蛋白表達比較 RT-PCR、Western blot檢測顯示,與對照組比較,過表達組細胞中FOXC1 mRNA及蛋白相對表達量升高,干擾組中FOXC1 mRNA及蛋白相對表達量降低(P<0.05)。見表1。
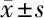
表1 3組細胞FOXC1 mRNA及蛋白表達
2.2 3組MTT實驗及吉姆薩染色檢測細胞增殖、克隆形成率比較 通過觀察細胞增殖情況可見,表皮干細胞在接種后第3天進入快速生長期,約第6天到達穩定期,故選擇轉染時及第3、6、9 天時測定細胞增殖情況。MTT實驗及吉姆薩染色結果顯示,與對照組比較,過表達組細胞增殖水平、克隆形成率升高,干擾組細胞增殖水平、克隆形成率降低,差異有統計學意義(P<0.05)。見表2。
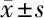
表2 3組細胞增殖及克隆形成率比較
2.3 3組ELISA檢測培養基中MMP-2、MMP-9表達比較 ELISA檢測結果顯示,與對照組比較,過表達組細胞MMP-2、MMP-9表達量升高(P<0.05),干擾組中MMP-2、MMP-9表達量降低(P<0.05)。見表3。
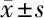
表3 3組細胞MMP-2、MMP-9表達
2.4 3組激光共聚焦檢測細胞內Ca2+濃度比較 激光共聚焦顯微鏡檢測顯示,與對照組比較,過表達組細胞中Ca2+熒光強度升高,干擾組中Ca2+熒光強度降低(P<0.05)。見表3。
2.5 3組Western blot檢測表皮干細胞分化相關標記蛋白表達比較 Western blot檢測結果顯示,與對照組比較,過表達組CK18、CEA蛋白表達量升高,ITGB1、CK19蛋白表達量降低(P<0.05),干擾組CK18、CEA蛋白表達量降低,ITGB1、CK19蛋白表達量升高(P<0.05)。見表4。
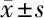
表4 3組Western blot檢測表皮干細胞分化相關標記蛋白表達
3 討論
大面積燒傷患者創面愈合后其皮膚功能重建問題依然是醫學界關注的重點問題,而干細胞移植以誘發汗腺再生是臨床皮膚修復重建的新方向[5]。從胚胎發育角度來看,外胚層上皮細胞是表皮干細胞與汗腺細胞的共同起源,能通過不斷分裂在表皮嵴形成上皮細胞索,而該細胞索逐漸發育為導管和分泌部,構成汗腺[6]。相關研究顯示,汗腺細胞可由表皮干細胞在特定環境下分化而來[7],提示可通過表皮干細胞向汗腺細胞分化來實現汗腺再生。
FOXC1位于人6號染色體上,其結構擁有一個與DNA結合的叉頭區域,是一種對器官發育具有重要作用的轉錄因子[8]。隨著近年來分子生物學的進展,通過全基因組大范圍篩查轉錄因子作用規律,已經證實了部分轉錄因子在調控細胞分化中的作用[8]。此外,對細胞分化起決定性作用的DNA甲基化、組蛋白修飾等表觀遺傳學修飾,也受到轉錄因子與DNA結合影響,故認為轉錄因子在細胞重編中具有重要作用[9]。目前已經發現FOXC1能通過上調細胞周期蛋白表達來增強腫瘤干細胞活性,還能抑制單核細胞向巨噬細胞分化,同時促進腫瘤干細胞的克隆形成[10]。有研究顯示,FOXC1在汗腺細胞中表達明顯高于表皮干細胞[11],但關于FOXC1在表皮干細胞中作用及對維持腫瘤干細胞異常增殖的作用機制仍未確定。本次根據FOXC1序列設計模擬物,通過脂質體轉染將FOXC1到離體的表皮干細胞中,通過RT-PCR及Western blot測定各組FOXC1表達,且提示轉染成功。本次研究發現,轉染后過表達組細胞增殖水平、克隆形成率高于對照組,干擾組增殖水平、克隆形成率低于對照組,提示FOXC1可提高表皮干細胞的增殖能力和細胞干性,這對于細胞分化具有重要意義。此外,汗腺的產生除細胞外基質重建和細胞運動兩個部分,腺體胚芽細胞下陷生長的同時還能分泌MMP-2、MMP-9等金屬基質蛋白酶,從而介導細胞外基質降解,促進下陷生長細胞向表皮層深入生長,最終形成腺體[12,13]。本次研究中過表達組轉染后MMP-2、MMP-9水平明顯高于對照組,而干擾組MMP-2、MMP-9低于對照組,提示FOXC1可能在促進表皮干細胞細胞外基質降解和下陷生長中起作用。表皮干細胞在個體生長發育的各個階段廣泛存在,具有一定的定向分化能力,而Ca2+濃度升高提示細胞活化,這對細胞生長及分化過程也起到重要作用[14]。轉染后過表達組Ca2+熒光強度的提高,提示在FOXC1作用下,表皮干細胞具備了發生部分功能轉化的分子基礎[15]。ITGB1、CK19是主要在表皮干細胞表達的標記物,而CK18、CEA僅在汗腺中表達[16],本次研究結果顯示,過表達組表皮干細胞標記物CK18、CEA蛋白表達量明顯高于對照組,在汗腺表達的ITGB1、CK19表達量低于對照組,而干擾組反之,提示FOXC1可在體外促進表皮干細胞向汗腺細胞表型變化。此外,還有研究顯示ITGB1、CK19表達上調提示細胞克隆形成及增殖能力的提高[17],這與MTT實驗及吉姆薩染色結果一致。相關動物實驗顯示,在小鼠汗腺發育后期,FOX家族多種蛋白(FOXC a1~a3)能通過Shh通路和EDA通路促進汗腺分泌部的發育和汗液分泌[18],提示FOXC1可能也通過上述通路參與表皮干細胞向汗腺細胞的定向分化,但具體情況有待進一步研究和論證。

