宮腔鏡下冷刀分離術聯合雌激素輔助ERAS對宮腔粘連患者炎性因子的影響
李海燕 王曉靜 史麗娟 梁漢波 張娜娜
宮腔粘連指由于各種原因造成子宮內膜基底層的損傷[1]。宮腔鏡手術治療是最為有效的方式[2]。宮腔鏡下冷刀分離術是近年來的新興術式,但研究發現,術后患者宮腔易再次出現粘連,且與雌激素受體的表達有關[3-5]。而加速康復外科(enhanced recovery aftersurgery,ERAS)為當前臨床應用極為廣泛的外科手術圍手術期管理措施,故觀察組輔助ERAS治療。通過干預前后記錄2組受試者療效、宮腔形態恢復和炎性因子等,探討宮腔鏡下冷刀分離術聯合雌激素輔助ERAS對宮腔粘連及患者炎癥因子的影響。報道如下。
1 資料與方法
1.1 一般資料 本研究經我院醫學倫理委員會批準,選擇2019年10月至2022年10月我院收治的宮腔粘連患者100例,隨機2組,每組50例。患者及其家屬均自愿簽署知情同意書。
1.2 納入與排除標準
1.2.1 納入標準:①診斷參考《宮腔粘連臨床診療中國專家共識》;②經宮腔鏡等檢查確診。
1.2.2 排除標準:①凝血功能障礙;②手術禁忌者;③合并嚴重感染性疾病者;④合并其他生殖系統疾病;⑤生殖系統畸形;⑥精神疾病者。
1.3 方法
1.3.1 對照組:宮腔鏡下冷刀分離術聯合雌激素治療,陰道放置米索前列醇于術前3 h,采用3 mm微型手術剪刀進行致密粘連組織的處理。手術后第1天開始給予雌孕激素序貫治療,即患者連續口服復方戊酸雌二醇片21 d,后6 d加服黃體酮膠囊100 mg,口服,2次/d。
1.3.2 觀察組:在對照組基礎上輔助ERAS,包括飲食、腸道準備、麻醉、輸液、引流、營養等 ,術前進行常規心理輔導,術中保溫(提高室溫、使用保溫毯以防止機體熱量散失,靜脈輸液應加溫處理,腹腔沖洗液采用接近體溫的液體)。術后無痛處理,鼓勵患者盡早下床活動,建議手術當天離床活動2 h,之后應≥6 h/d,直至患者出院。術后在患者可耐受的情況下早期經口飲食。
1.4 評價指標
1.4.1 臨床療效:比較2組術后1、3個月的臨床療效。以治療后的宮腔粘連癥狀體征消失,宮腔形態均恢復正常為治愈;以上述情況明顯改善為有效;以上述情況未見明顯改善為無效。總有效=治愈+有效。
1.4.2 炎性因子水平:分別在術前、術后3 d抽取2組患者5 mL空腹靜脈血,采用酶聯免疫吸附法(Enzyme-Linked ImmunoSorbent Assay,ELISA),試劑盒測定C-反應蛋白(C-reactive protein,CRP)水平、白介素-6(interleukin 6,IL-6)水平、白介素-8(interleukin 8,IL-8)水平、腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)水平,檢測遵循無菌操作原則,相關步驟嚴格按照說明書進行。
1.4.3 術后并發癥發生率:包括腹痛、出血、再粘連。
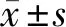
2 結果
2.1 一般資料 2組患者年齡、病程、體重指數、疾病嚴重程度比較差異無統計學意義(P>0.05),具有可比性。見表1。
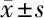
表1 2組患者一般資料比較 n=50,
2.2 臨床療效 2組有效率比較,術后1個月,對照組治愈11例,有效20例,觀察組治愈23例,有效19例,觀察組臨床療效高于對照組(P<0.05)。術后3個月,對照組治愈26例,有效16例,觀察組治愈37例,有效12例,觀察組臨床療效高于對照組(P<0.05)。見表2、3。

表2 2組患者1個月臨床療效比較 n=50,例(%)

表3 2組患者3個月臨床療效比較 n=50,例(%)
2.3 炎性因子水平 術前2組患者CRP水平、IL-6水平、IL-8水平、TNF-α水平比較(P>0.05)。術后3 d,2組患者CRP水平、TNF-α水平均低于術前,IL-6水平、IL-8水平均高于術前(P<0.05)。而觀察組CRP水平、TNF-α水平均低于對照組,IL-6水平、IL-8水平均高于對照組(P<0.05)。見表4。
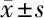
表4 2組患者炎性因子水平比較 n=50,
2.4 術后并發癥發生率 對照組術后發生腹痛4例、出血2例、再粘連3例,觀察組術后發生1腹痛、1例再粘連,術后并發癥發生率比較,觀察組低于對照組(P<0.05)。見表5。

表5 2組患者術后并發癥發生率比較 n=50,例(%)
3 討論
宮腔粘連近年來發病率呈上升趨勢,宮腔粘連是由于反復進行人工流產、藥物流產及產后出血、胎盤滯留等損傷子宮內膜,導致子宮內膜修復速度減慢引起的,有的患者因經期同房、引產后過早同房等導致宮腔感染引起[6],患者臨床表現不同,大多表現為月經紊亂、繼發性閉經、不孕、復發性流、突發性下腹痙攣性疼痛,有的患者表現為疼痛劇烈、坐臥不安、行動困難,甚至連排氣、排便都很痛苦,有的甚至長夜難眠,給女性的生活和工作帶來很大的影響,嚴重影響到患者的生殖健康[7]。近年來研究發現,發生宮腔粘連的原因可能是由于手術宮腔操作而破壞了患者的子宮內膜基底層,從而發生宮腔粘連[8],宮腔鏡下宮腔粘連電切分離術是傳統術式,具有較高的準確性,但實際使用時因電切技術對子宮內膜電熱的作用導致術后近遠期再粘連形成,增加了疾病復發的風險,但是宮腔電切術后存在高達 62.5%的復發率[9],如何達到滿意的臨床療效、又能保護子宮內膜的不受損傷,是臨床研究熱點。行宮腔粘連手術會對患者的子宮內膜厚度造成影響,而子宮內膜厚度與其性激素水平具有一定關聯,從而再行宮腔粘連手術后患者子宮內膜厚度降低,造成雌激素水平的紊亂。而宮腔鏡下冷刀治療可避免熱輻射對病灶部位基底膜的損傷[10],宮腔鏡冷刀手術系統主要是通過機械的方式將宮腔內的病損去除,主要優點在于可以減少對子宮內膜的損傷,繼而對女性以后的月經和生育影響相對較小,不會引起患者月經方面的紊亂[11]。加速康復外科(ERAS)理念為當前臨床應用極為廣泛的外科手術圍手術期管理措施,以患者為核心、以疾病為目標,通過轉變傳統的康復理念,降低手術風險 ,盡量緩解手術導致的應激反應,從而促進患者康復,其主要是參照循證醫學證據對患者圍手術期疼痛管理、活動、飲食等相關措施實施優化,以此減輕手術對心理及生理產生的創傷應激反應程度,降低并發癥等發生風險,促使機體功能及早康復[12]。大量的研究發現,宮腔鏡下冷刀分離術、雌激素是治療的有效措施[13-14],但有關宮腔鏡下冷刀分離術聯合雌激素輔助ERAS與宮腔粘連關系筆者未見有文獻報道。
炎癥反應是身體對于感染、病原微生物、創傷,還有變態反應等組織細胞的反應,也是機體的防御反應。當機體出現病原體感染,包括細菌、病毒進入體內后,身體會有一系列的反應。首先出現免疫細胞,如吞噬性細胞把病毒、細菌吞噬后,組織細胞會釋放一系列的炎性因子,包括腫瘤壞死因子、白介素等。炎性反應在宮腔粘連中占據重要地位,CRP、IL-6、IL-8、TNF-α水平均可有效反映機體內炎性反應嚴重程度[15-16]。手術屬于創傷性操作,可導致炎癥因子分泌紊亂,干擾子宮內膜的再生和修復。宮腔鏡冷刀分離術目前為國內外治療宮腔粘連最熱門、最優先的手術方式。之所以稱之為“冷刀”,是因為它實際是一種完全不帶熱損傷的器械,可以將器械對子宮內膜的電熱損傷降低為0[17-19]。此外,手術操作方便、快捷;手術器械的最大直徑僅3 mm,對子宮及宮頸創傷最低;可解決80%宮腔異常因素,并縮短手術時間;保子宮、保內膜、促生育;術后宮腔粘連發生率比傳統宮腔鏡減少90%[20-21]。
性激素的主要功能是促進人體內性器官的成熟,促進第二體征的發育以及維持性功能。女性卵巢主要分泌雌激素和孕激素。雌激素和孕激素在體內共同作用,雌激素可以使子宮內膜增厚并使子宮內膜血管增生,可直接作用于子宮內膜局部,對抗雌激素受體,促進子宮內膜的萎縮,從而進一步防止子宮內膜的增生,減少經血量,縮短月經期,促進疾病的恢復[22-23]。圍手術期的機體應激反應包括:術前焦慮和緊張、手術刺激、術中低體溫、術中過多的液體輸入、術后疼痛和滯動等,進而引起患者的胃腸功能發生障礙[24-25]。應激反應由于應激因子(stressor)對人體的有害作用所引起的非特異性的一切緊張狀態。ERAS通過循證醫學證據采取有效的圍手術期治療措施,以減少手術創傷的應激反應,減少并發癥,提高手術安全性和患者滿意度,從而實現加速康復的目標[26-27]。而本研究通過術前健康宣教緩解患者的術前焦慮癥狀,增強信心,提高患者的滿意度。通過一系列術后康復方案,一系列有效措施的組合而產生的協同結果。
本研究結果顯示,術后3 d,2組患者CRP、TNF-α水平均低于術前,IL-6、IL-8水平均高于術前,提示宮腔鏡下冷刀分離術聯合雌激素,可改善患者炎性因子水平。而觀察組CRP、TNF-α水平均低于對照組,IL-6、IL-8水平均高于對照組,提示宮腔鏡下冷刀分離術聯合雌激素輔助ERAS較宮腔鏡下冷刀分離術聯合雌激素比較,可更好地改善患者炎性因子水平。
綜上所述,宮腔鏡下冷刀分離術聯合雌激素輔助ERAS較宮腔鏡下冷刀分離術聯合雌激素比較,可提高臨床療效,改善患者炎癥因子水平,降低術后并發癥發生率。

