白蛋白/纖維蛋白原比值、核因子E2相關因子2、血紅素氧合酶1對腦缺血再灌注損傷的診斷價值
鄭娟,孔敏,宋曉宇,田升軍,李燕,于天霞
作者單位:264000 山東省煙臺市煙臺山醫院神經內科
再灌注治療是臨床上針對急性腦梗死患者的重要治療手段,其可恢復缺血腦組織血供,提高患者的生存質量[1]。但再灌注治療過程中患者可能會發生炎癥細胞浸潤、出血轉化、再灌注腦水腫等,從而加重缺血腦組織損傷,進而引發腦缺血再灌注損傷(cerebral ischemia-reperfusion injury,CIRI),增加患者死亡風險[2]。因此,有效預防CIRI對改善急性腦梗死患者預后至關重要。動物實驗證實,氧化應激是CIRI的重要發生機制[3]。研究顯示,白蛋白/纖維蛋白原比值(albumin to fibrinogen ratio,AFR)是反映炎癥狀態及營養狀況的新型綜合指標,且低水平的AFR可誘發氧化應激,進而引發CIRI[4]。核因子E2相關因子2(nuclear factor erythroid-2 related factor 2,Nrf2)是抗氧化防御系統的重要因子,可參與氧化應激、炎癥反應發生發展過程,血紅素氧合酶1(heme oxygenase 1,HO-1)具有抗氧化、改善組織微循環等作用,研究證實,Nrf2、HO-1可通過增加細胞抗氧化能力而促進細胞氧化還原狀態的恢復并增強偶聯反應,進而促進CIRI的發生、發展[5-6]。本研究旨在分析AFR、Nrf2、HO-1對CIRI的診斷價值,以期為臨床防治CIRI提供參考。
1 對象與方法
1.1 研究對象
選取2020年1月—2023年6月煙臺市煙臺山醫院收治的CIRI患者105例為觀察組。納入標準:(1)符合CIRI的診斷標準[7];(2)年齡≥18歲;(3)肝、腎功能正常者;(4)對本研究知情并簽署知情同意書。排除標準:(1)合并惡性腫瘤者;(2)有顱內出血或顱腦外傷史者;(3)存在傳染病、自身免疫性疾病或血液系統疾病者;(4)伴有精神疾病者。另選取同期于煙臺市煙臺山醫院體檢者105例為對照組。納入標準:(1)年齡≥18歲;(2)對本研究知情并簽署知情同意書。排除標準:有再灌注治療史者。本研究經煙臺市煙臺山醫院倫理委員會審核通過。
1.2 研究方法
(1)一般資料收集:收集研究對象一般資料,包括性別、年齡、體質指數(body mass index,BMI)、基礎疾病(高血壓、冠心病、糖尿病)。(2)AFR檢測:CIRI患者入院后禁食8 h,于次日清晨采集空腹外周靜脈血5 ml;對照組于體檢時采集空腹外周靜脈血5 ml;采用全自動生化分析儀及其配套試劑盒檢測血清白蛋白;采用全自動凝血分析儀及其配套試劑盒檢測血清纖維蛋白原;計算AFR,AFR=白蛋白/纖維蛋白原。(3)Nrf2、HO-1檢測:CIRI患者入院后禁食8 h,于次日清晨采集空腹外周靜脈血3 ml;對照組于體檢時采集空腹外周靜脈血3 ml;3 500 r/min離心15 min(離心半徑15 cm)后取血清,采用ELISA測定血清Nrf2、HO-1水平,ELISA試劑盒均購自上海酶聯生物科技有限公司。
1.3 統計學方法
采用SPSS 25.0軟件進行數據處理。計量資料均經方差齊性及Shapiro-Wilk正態性檢驗,符合正態分布以(±s)表示,組間比較采用兩獨立樣本t檢驗;計數資料以相對數表示,組間比較采用χ2檢驗;采用多因素Logistic回歸分析探討CIRI的影響因素;采用受試者工作特征(receiver operator characteristic,ROC)曲線分析AFR、Nrf2、HO-1及三者聯合對CIRI的診斷價值,曲線下面積(area under curve,AUC)<0.5表示無診斷價值,0.5≤AUC<0.7表示診斷價值較低,0.7≤AUC<0.9表示診斷價值中等,AUC≥0.9表示診斷價值較高。以P<0.05為差異有統計學意義。
2 結果
2.1 兩組一般資料、AFR、Nrf2、HO-1比較
兩組性別、年齡、BMI及高血壓、冠心病、糖尿病發生率比較,差異無統計學意義(P>0.05);觀察組AFR、Nrf2、HO-1低于對照組,差異有統計學意義(P<0.05),見表1。
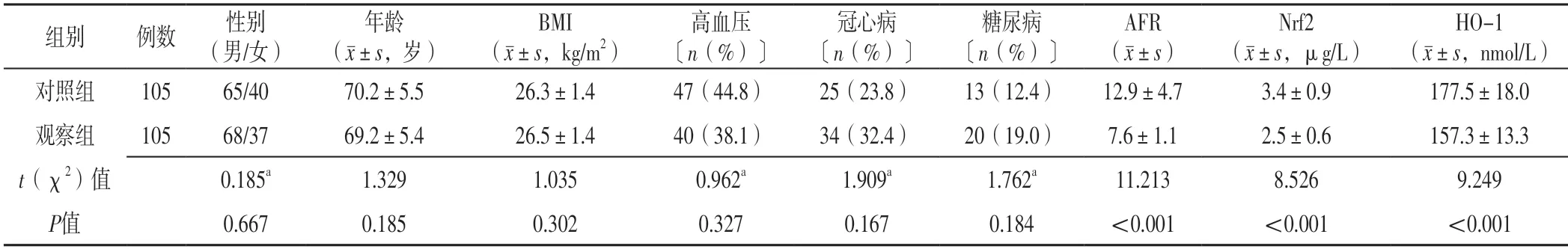
表1 兩組一般資料、AFR、Nrf2、HO-1比較Table 1 Comparison of general information,AFR,Nrf2,and HO-1 between the two groups
2.2 CIRI影響因素的多因素Logistic回歸分析
以AFR、Nrf2、HO-1為自變量(均為實測值),研究對象是否為CIRI患者為因變量(賦值:是=1,否=0),進行多因素Logistic回歸分析,結果顯示,AFR、Nrf2、HO-1是CIRI的影響因素(P<0.05),見表2。
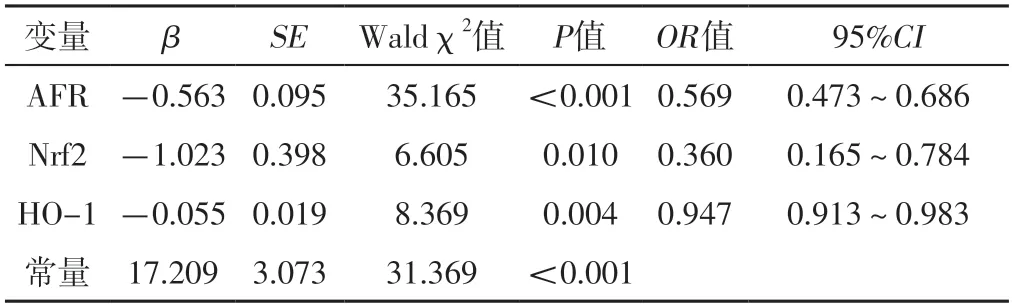
表2 CIRI影響因素的多因素Logistic回歸分析Table 2 Multivariate Logistic regression analysis of the influencing factors of CIRI
2.3 AFR、Nrf2、HO-1及三者聯合對CIRI的診斷價值
ROC曲線分析結果顯示,AFR、Nrf2、HO-1診斷CIRI的AUC分別為0.854〔95%CI(0.794~0.915)〕、0.815〔95%CI(0.756~0.873)〕、0.831〔95%CI(0.7 7 5 ~0.8 8 8)〕,最佳截斷值分別為9.7、3.2 μg/L、168.5 nmol/L,靈敏度分別為98.10%、89.50%、85.70%,特異度分別為75.20%、64.80%、71.40%;三者聯合診斷CIRI的AUC為0.926〔95%CI(0.883~0.968)〕,靈敏度為95.20%,特異度為87.60%,見圖1。
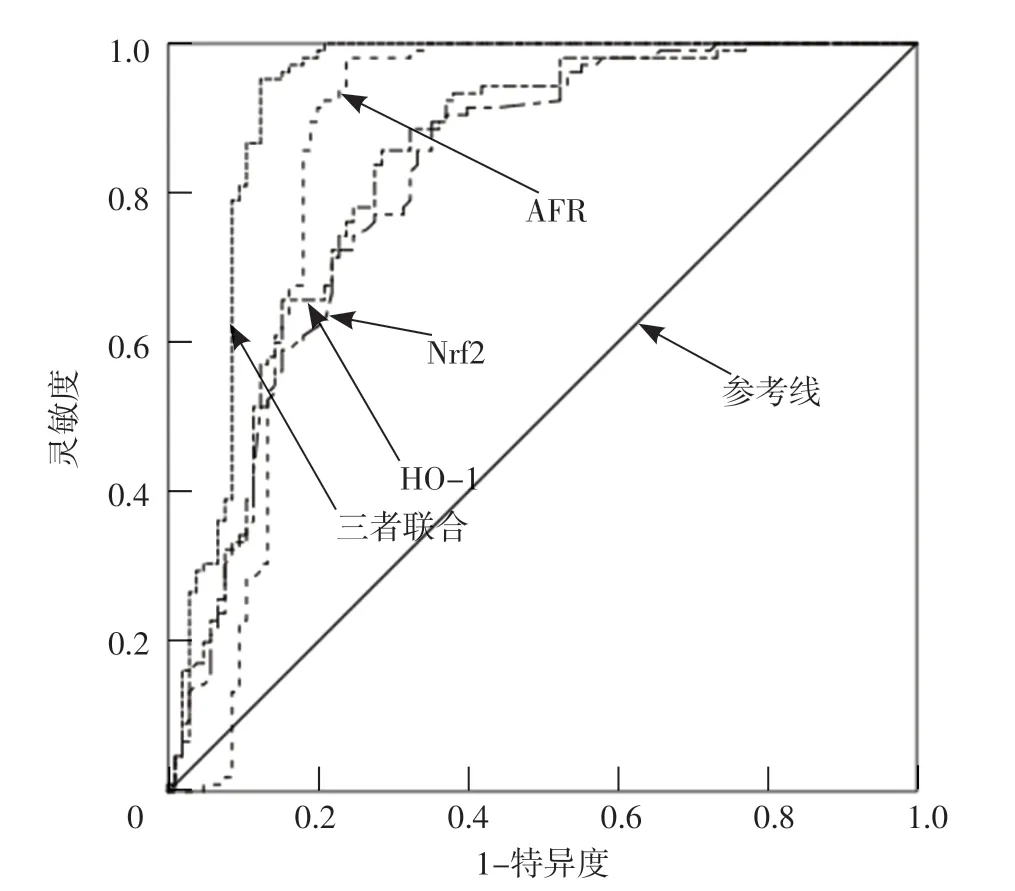
圖1 AFR、Nrf2、HO-1及三者聯合診斷CIRI的ROC曲線Figure 1 ROC curve of AFR,Nrf2,HO-1 and their combination in diagnosing CIRI
3 討論
神經元主要通過線粒體來產生三磷酸腺苷(adenosine triphosphate,ATP)以維持其功能及正常耗氧需求[8]。機體缺氧時會發生線粒體功能障礙,抑制ATP的生成并影響機體細胞能量轉運過程,從而促進活性氧的生成,進而誘發氧化應激[9-10]。而氧化應激會損傷血腦屏障膜蛋白,導致血腦屏障脂質過氧化,使血腦屏障緊密連接中的閉合蛋白的分布不均勻及表達異常,從而造成血腦屏障損傷,進而誘發CIRI[11]。
AFR是一種新型炎癥標志物,其在機體氧化應激、炎癥反應的發生發展過程中具有重要作用。本研究結果顯示,觀察組AFR低于對照組,且多因素Logistic回歸分析結果顯示,AFR是CIRI的影響因素。AFR可反映機體營養狀態及炎癥情況[12]。低水平的AFR可提示機體存在營養不良情況,而營養不良會影響免疫功能,增加機體感染風險,而機體一旦發生感染則會引發炎癥反應并導致內皮功能障礙,使組織細胞出現缺氧缺血性壞死、凋亡,在此過程中,機體會釋放活性氧,誘發氧化應激,進而引起CIRI[13-15]。此外,炎癥反應及氧化應激還會引發血小板異常活化,促進血栓形成,致使冠狀動脈管腔再次阻塞,加重腦組織缺氧缺血程度,這可能會導致患者再灌注治療時出現炎癥細胞浸潤、出血轉化等,進而誘發CIRI[16]。Nrf2/HO-1信號通路在調控CIRI中具有關鍵作用。FAN等[17]研究指出,Nrf2/HO-1信號通路可通過調節抗炎因子和抗氧化酶的表達來調控CIRI過程。其中Nrf2可調節抗氧化反應元件(antioxidant response element,ARE)/親電子反應元件(electrophile response element,EpRE)基因[18],HO-1可發揮抑制炎癥反應及抗細胞凋亡、增殖等作用[19]。當機體出現氧化應激時,Nrf2與V-Maf肌肉腱膜纖維肉瘤癌基因同源物蛋白形成異二聚體后可識別ARE序列,從而促進抗氧化基因的轉錄[20],此時Nrf2還可調控HO-1并將HO-1氧化成膽綠素、一氧化碳、游離鐵等物質,進而發揮抗氧化應激作用[21]。本研究結果顯示,觀察組Nrf2、HO-1低于對照組,且多因素Logistic回歸分析結果顯示,Nrf2、HO-1是CIRI的影響因素,與LOU等[22]研究結果一致。Nrf2、HO-1具有抗氧化能力,低水平的Nrf2、HO-1可抑制神經元中抗氧化酶、解毒酶的生成,干擾酶促反應過程,并導致機體抗氧化劑如超氧化物歧化酶、丙二醛等水平明顯升高,進而損傷腦組織,誘發或加重CIRI[23]。
本研究ROC曲線分析結果顯示,AFR、Nrf2、HO-1及三者聯合診斷CIRI的AUC分別為0.854、0.815、0.831、0.926,提示AFR、Nrf2、HO-1均對CIRI具有中等診斷價值,而三者聯合的診斷價值更高,臨床上可通過AFR、Nrf2、HO-1來預測CIRI的發生風險,并采取有效措施進行干預,以降低CIRI發生率。
4 結論
綜上所述,AFR、Nrf2、HO-1是CIRI的影響因素,且其均對CIRI具有中等診斷價值,而三者聯合的診斷價值更高。但本研究樣本量較小,且對照組為體檢健康者,并未納入接受再灌注治療后未發生CIRI的患者,這可能會造成研究偏倚,未來可對患者進一步分級,以驗證AFR、Nrf2、HO-1在CIRI發生發展中的作用機制。
作者貢獻:鄭娟負責文章的構思與設計、資料整理、論文撰寫、統計學處理,對文章整體負責、監督管理;孔敏、宋曉宇、田升軍進行研究的實施與可行性分析,資料收集;鄭娟、李燕、于天霞負責論文修訂、文章質量控制及審校。
本文無利益沖突。

