我國(guó)化學(xué)藥生產(chǎn)企業(yè)境外檢查觀察情況分析
徐長(zhǎng)波,翟鐵偉
(國(guó)家藥品監(jiān)督管理局食品藥品審核查驗(yàn)中心,北京 100044)
隨著我國(guó)科學(xué)技術(shù)的迅猛發(fā)展,以及市場(chǎng)發(fā)展及政府配套措施的扶助引導(dǎo),醫(yī)藥工業(yè)轉(zhuǎn)型升級(jí)[1],我國(guó)已形成較完善的制藥產(chǎn)業(yè)鏈和產(chǎn)業(yè)群[2]。眾多醫(yī)藥企業(yè)正在走向國(guó)際化經(jīng)營(yíng)模式[3-4],并具備了一定的全球競(jìng)爭(zhēng)力,越來(lái)越多的境外藥品監(jiān)管機(jī)構(gòu)也來(lái)華進(jìn)行藥品檢查。20世紀(jì)90年代末,我國(guó)開(kāi)始了對(duì)來(lái)華進(jìn)行藥品檢查的境外藥品監(jiān)管機(jī)構(gòu)的相應(yīng)檢查觀察工作。2010 年前后,原國(guó)家食品藥品監(jiān)督管理局藥品認(rèn)證管理中心逐漸將境外檢查觀察工作制度化,我國(guó)藥品監(jiān)管部門(mén)也開(kāi)始加速推進(jìn)藥品檢查國(guó)際化,不斷提升藥品檢查能力。隨著境外藥品監(jiān)管機(jī)構(gòu)來(lái)華檢查的日益增加,國(guó)家藥品監(jiān)督管理局(NMPA)于2019 年進(jìn)一步完善了境外檢查觀察的相應(yīng)管理。本研究中通過(guò)分析2015 年至2022 年我國(guó)化學(xué)藥生產(chǎn)企業(yè)境外檢查觀察情況及檢查發(fā)現(xiàn)缺陷分布,總結(jié)境外檢查重點(diǎn)和高頻缺陷的類別。現(xiàn)報(bào)道如下。
1 藥品境外檢查觀察
當(dāng)境外藥品監(jiān)管機(jī)構(gòu)對(duì)我國(guó)人用藥品進(jìn)行檢查時(shí),我國(guó)藥品監(jiān)督管理部門(mén)會(huì)派出具有經(jīng)驗(yàn)的藥品檢查員對(duì)境外藥品監(jiān)管機(jī)構(gòu)的檢查過(guò)程進(jìn)行見(jiàn)證和記錄。根據(jù)NMPA與境外藥品監(jiān)管機(jī)構(gòu)簽署的相關(guān)合作協(xié)議,境外藥品監(jiān)管機(jī)構(gòu)派員對(duì)我國(guó)企業(yè)開(kāi)展檢查時(shí),通常會(huì)通知NMPA 派出觀察員進(jìn)行觀摩。NMPA 食品藥品審核查驗(yàn)中心(簡(jiǎn)稱核查中心)具體負(fù)責(zé)境外檢查觀察的具體實(shí)施。當(dāng)核查中心接到NMPA境外藥品監(jiān)管機(jī)構(gòu)檢查計(jì)劃或通知后,會(huì)選派有資質(zhì)的藥品檢查員作為境外檢查的觀察員。觀察員對(duì)檢查的全過(guò)程進(jìn)行觀察并客觀記錄,包括文件記錄、現(xiàn)場(chǎng)情況、提出的問(wèn)題和建議等,并書(shū)寫(xiě)觀察檢查報(bào)告。
2 2015 年至2022 年我國(guó)化學(xué)藥接受境外檢查觀察概況
2.1 總體情況
2015年至2022年,美國(guó)食品和藥物管理局(FDA)、世界衛(wèi)生組織(WHO)、歐洲藥品質(zhì)量理事會(huì)(EDQM)、德國(guó)漢堡健康及消費(fèi)者保護(hù)部(BGV)、巴西衛(wèi)生監(jiān)督局(ANVISA)等24 個(gè)境外藥品監(jiān)管機(jī)構(gòu)檢查我國(guó)化學(xué)藥生產(chǎn)企業(yè)443家次。
2.2 檢查次數(shù)
2015 年至2019 年,境外藥品監(jiān)管機(jī)構(gòu)檢查數(shù)量逐年增加,分別為74,81,84,82,102 家次;受新型冠狀病毒感染(簡(jiǎn)稱新冠)疫情影響,2020年至2022年,境外檢查數(shù)量急劇減少,分別為6,6,8 家次,其中遠(yuǎn)程檢查分別為3,3,4家次。詳見(jiàn)圖1。
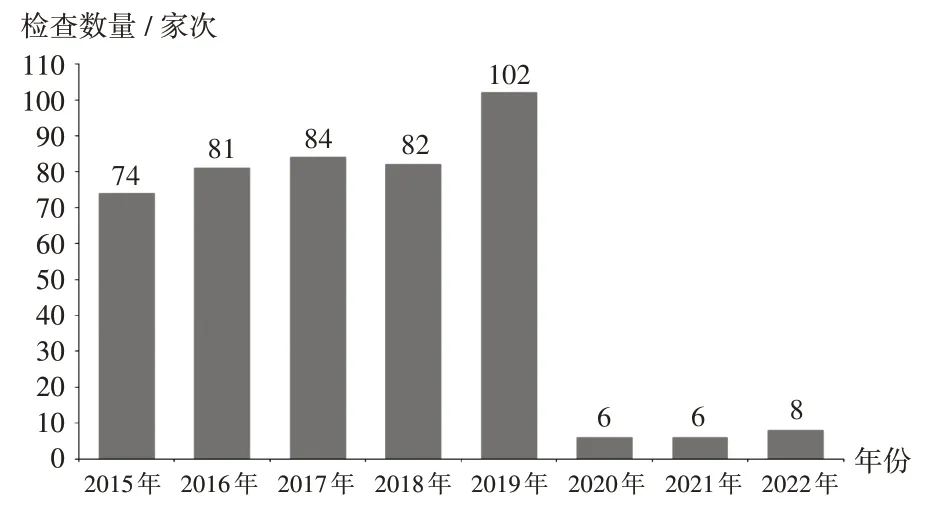
圖1 2015 年至2022 年境外檢查觀察次數(shù)Fig.1 Number of international drug inspection and observation from 2015 to 2022
2.3 檢查發(fā)現(xiàn)的缺陷
隨著《藥品生產(chǎn)質(zhì)量管理規(guī)范》(2010 年修訂,以下簡(jiǎn)稱GMP)的深入實(shí)施,我國(guó)藥品生產(chǎn)企業(yè)整體GMP水平不斷提高[5]。2015年至2022年,核查中心共進(jìn)行443家次境外檢查觀察,記錄缺陷4 854 項(xiàng);境外藥品監(jiān)管機(jī)構(gòu)檢查發(fā)現(xiàn)的次均缺陷數(shù)呈下降趨勢(shì)。詳見(jiàn)圖2。

圖2 2015 年至2022 年我國(guó)化學(xué)藥生產(chǎn)企業(yè)境外檢查觀察記錄缺陷均值Fig.2 Average values of defects recorded by international drug inspection and observation of Chinese chemical pharmaceutical production enterprises from 2015 to 2022
由于不同境外藥品監(jiān)管機(jī)構(gòu)的檢查員背景和專長(zhǎng)有差異,所發(fā)現(xiàn)缺陷數(shù)量存在差異。2015 年至2019 年,WHO 和EDQM 檢查發(fā)現(xiàn)的缺陷數(shù)量相對(duì)較多,平均每次檢查發(fā)現(xiàn)約20 項(xiàng),且所有問(wèn)題均進(jìn)行詳細(xì)描述;FDA檢查發(fā)現(xiàn)的缺陷數(shù)量相對(duì)較少,平均每次檢查發(fā)現(xiàn)約5 項(xiàng),由檢查員結(jié)合產(chǎn)品風(fēng)險(xiǎn)和發(fā)現(xiàn)缺陷進(jìn)行綜合判斷后形成最終缺陷項(xiàng)。詳見(jiàn)圖3。
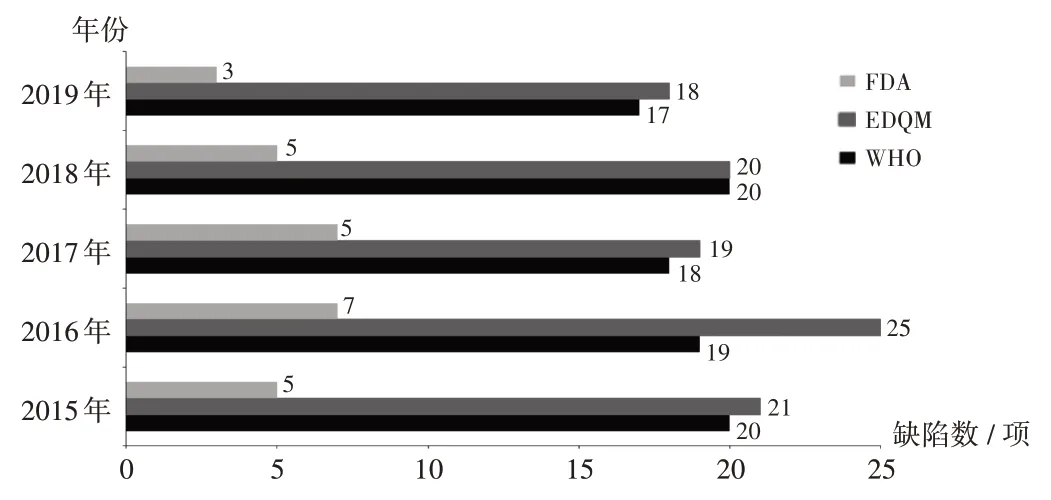
圖3 2015 年至2019 年WHO,EDQM,F(xiàn)DA 檢查觀察記錄的平均缺陷Fig.3 Average number of defects recorded by WHO,EDQM,F(xiàn)DA inspection observations from 2015 to 2019
受新冠疫情影響,2020 年至2022 年的境外檢查數(shù)量明顯減少。俄羅斯聯(lián)邦藥物與規(guī)范研究院(SID&GP)、波蘭藥品檢查局(CPI)采用遠(yuǎn)程檢查的方式進(jìn)行檢查,F(xiàn)DA 和WHO 等仍進(jìn)行現(xiàn)場(chǎng)檢查。2020 年至2022 年,現(xiàn)場(chǎng)檢查10次,發(fā)現(xiàn)缺陷87項(xiàng);遠(yuǎn)程檢查10次,發(fā)現(xiàn)缺陷44項(xiàng)。
2.4 檢查發(fā)現(xiàn)的嚴(yán)重缺陷
2015 年至2019 年,境外檢查發(fā)現(xiàn)嚴(yán)重缺陷的次數(shù)占比逐年降低,發(fā)現(xiàn)的嚴(yán)重缺陷主要由數(shù)據(jù)可靠性問(wèn)題引起;2021年至2022年,均未發(fā)現(xiàn)嚴(yán)重缺陷。詳見(jiàn)表1。

表1 2015 年至2019 年境外檢查觀察記錄我國(guó)化學(xué)藥生產(chǎn)企業(yè)的嚴(yán)重缺陷Tab.1 Critical defects found during drug international drug inspection and observation from 2015 to 2019
數(shù)據(jù)可靠性問(wèn)題可簡(jiǎn)單分為規(guī)范性因素和真實(shí)性因素兩方面[6]。2015年至2017年,嚴(yán)重缺陷主要是違背誠(chéng)實(shí)信用原則故意編造、篡改數(shù)據(jù)等導(dǎo)致的數(shù)據(jù)可靠性問(wèn)題,隨著全球主要藥品監(jiān)管機(jī)構(gòu)、國(guó)際組織和我國(guó)藥品監(jiān)管部門(mén)針對(duì)藥品數(shù)據(jù)發(fā)布的一系列指南、法規(guī),我國(guó)藥品生產(chǎn)企業(yè)質(zhì)量管理體系不斷提高,真實(shí)性因素導(dǎo)致的數(shù)據(jù)可靠性缺陷逐漸被規(guī)范性因素導(dǎo)致的數(shù)據(jù)可靠性替代[7]。2018年至2022年,境外檢查發(fā)現(xiàn)的嚴(yán)重缺陷開(kāi)始轉(zhuǎn)向了無(wú)菌保障、風(fēng)險(xiǎn)評(píng)估、變更控制、防交叉污染等多個(gè)影響產(chǎn)品質(zhì)量的關(guān)鍵因素。
3 2019 年化學(xué)藥生產(chǎn)企業(yè)接受境外檢查觀察分析
3.1 我國(guó)核查中心檢查觀察情況
3.1.1 檢查觀察次數(shù)
2019 年,核查中心組織開(kāi)展對(duì)主要包括FDA 等在內(nèi)的13 個(gè)境外藥品檢查機(jī)構(gòu)的檢查觀察102 家次,其中FDA,WHO,EDQM 3 個(gè)境外藥品檢查機(jī)構(gòu)檢查觀察82家次,約占全年檢查觀察的80.39%。詳見(jiàn)圖4。
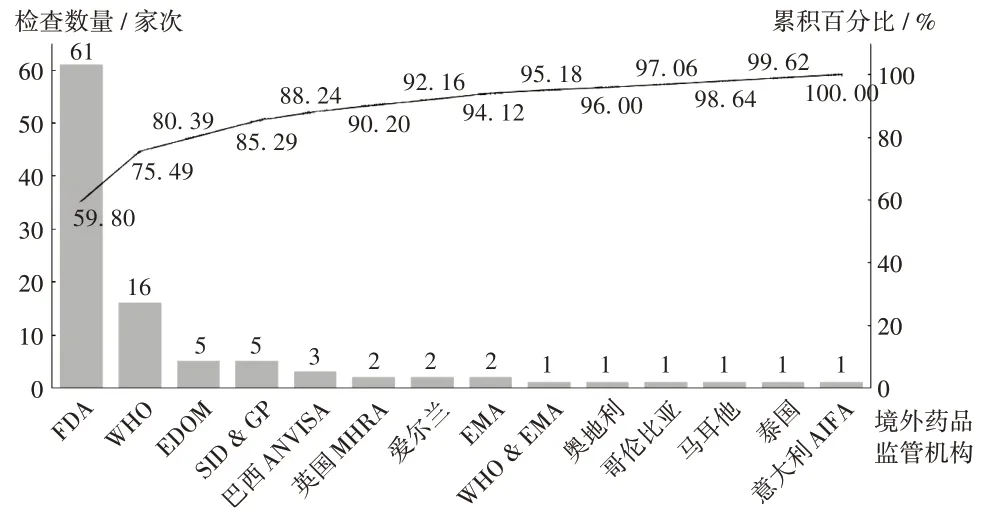
圖4 2019 年境外檢查觀察情況Fig.4 Number of international drug inspection and observation in 2019
3.1.2 檢查觀察發(fā)現(xiàn)的缺陷
2019 年,檢查觀察共記錄境外藥品檢查機(jī)構(gòu)檢查發(fā)現(xiàn)缺陷793 項(xiàng),參照GMP 正文章節(jié)對(duì)境外檢查觀察中記錄的缺陷進(jìn)行分析。其中,質(zhì)量控制與質(zhì)量保證、文件管理、確認(rèn)與驗(yàn)證、設(shè)備、生產(chǎn)管理5個(gè)類別的缺陷約占全部缺陷的77.43%。詳見(jiàn)圖5。
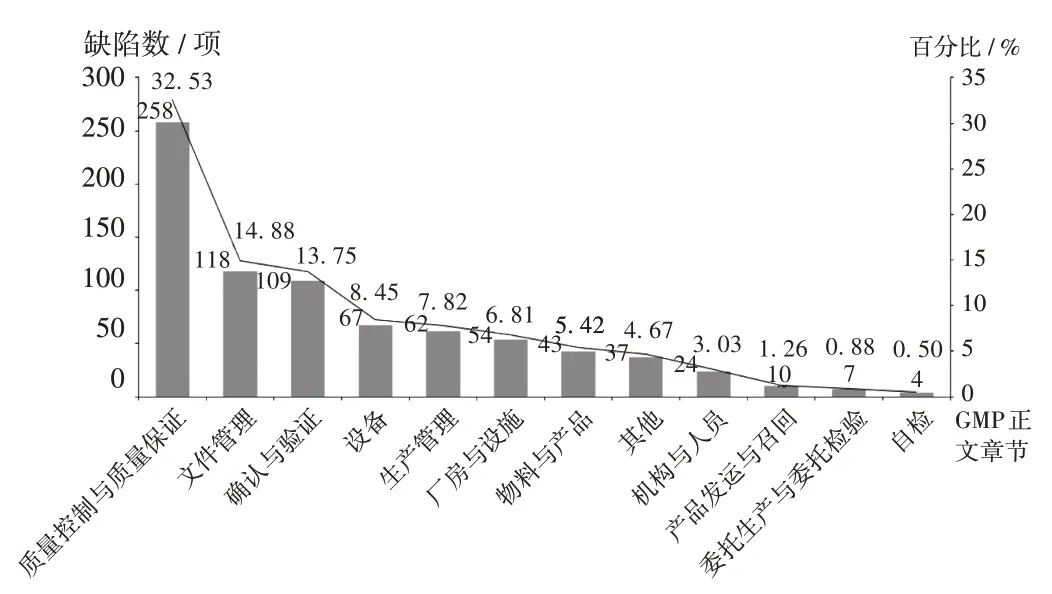
圖5 2019 年境外檢查觀察記錄我國(guó)化學(xué)藥生產(chǎn)企業(yè)的缺陷分布Fig.5 Distribution of defects found during international drug inspection and observation of Chinese chemical pharmaceutical production enterprises in 2019
3.2 境外藥品監(jiān)管機(jī)構(gòu)檢查觀察情況
3.2.1 FDA
2019 年,核查中心共組織FDA 對(duì)我國(guó)化學(xué)藥生產(chǎn)企業(yè)檢查觀察61家次,發(fā)現(xiàn)缺陷197項(xiàng),約占2019年全部境外藥品監(jiān)管機(jī)構(gòu)發(fā)現(xiàn)缺陷的24.84%,平均每次檢查提出缺陷約3項(xiàng)。參照GMP正文章節(jié),將FDA 檢查觀察中記錄的缺陷分類,詳見(jiàn)圖6 A。質(zhì)量控制與質(zhì)量保證、文件管理、確認(rèn)與驗(yàn)證部分提出的缺陷占比分別居第1,2,3 位,占比分別為40.61%,18.78%,10.15%,與2015年至2018年FDA在我國(guó)檢查發(fā)現(xiàn)的情況一致[8]。

A.FDA B.WHO C.EDQM圖6 2019 年部分境外監(jiān)管機(jī)構(gòu)檢查觀察記錄我國(guó)化學(xué)藥生產(chǎn)企業(yè)的缺陷分布A.FDA B.WHO C.EDQMFig.6 Distribution of drug inspection and observation defects of Chinese chemical pharmaceutical production enterprises by some overseas pharmaceutical regulatory agencies in 2019
1)質(zhì)量控制與質(zhì)量保證問(wèn)題涉及偏差調(diào)查不充分/未找到根本原因,糾正措施和預(yù)防措施(CAPA)無(wú)效,變更的風(fēng)險(xiǎn)評(píng)估不完整,年度質(zhì)量回顧不全面,投訴未啟動(dòng)調(diào)查,穩(wěn)定性考察項(xiàng)目的方法/標(biāo)準(zhǔn)與《美國(guó)藥典》(USP)不一致,儀器缺少/未開(kāi)啟審計(jì)追蹤,檢測(cè)儀器多人共用一個(gè)賬戶,取樣不具代表性,檢驗(yàn)的原始記錄/附圖不完全,質(zhì)量管理部門(mén)對(duì)電子數(shù)據(jù)審核缺失等。
2)文件管理問(wèn)題涉及記錄的信息不完整/缺失,記錄的唯一性不受控,記錄未及時(shí)填寫(xiě)和簽名,關(guān)鍵的操作/數(shù)據(jù)等缺少簽名和復(fù)核,相關(guān)操作未建立規(guī)程等。
3)確認(rèn)與驗(yàn)證問(wèn)題涉及清潔驗(yàn)證不足,部分設(shè)備/器具的清潔程序未驗(yàn)證,工藝驗(yàn)證未涵蓋工藝參數(shù)范圍,設(shè)備確認(rèn)未涵蓋生產(chǎn)使用范圍等。
3.2.2 WHO
2019 年,核查中心共組織WHO 對(duì)我國(guó)化學(xué)藥生產(chǎn)企業(yè)檢查觀察16家次,發(fā)現(xiàn)缺陷273項(xiàng),約占2019年全部境外藥品檢查機(jī)構(gòu)發(fā)現(xiàn)缺陷的34.43%,平均每次檢查提出缺陷約17 項(xiàng)。參照GMP 正文章節(jié),對(duì)WHO 檢查觀察中記錄的缺陷分類,詳見(jiàn)圖6 B。質(zhì)量控制與質(zhì)量保證、確認(rèn)與驗(yàn)證、文件管理部分提出的缺陷分別居第1,2,3位,占比分別為32.60%,15.02%,9.52%。
1)質(zhì)量控制與質(zhì)量保證問(wèn)題涉及偏差未按流程調(diào)查及CAPA 不足,偏差未定期回顧,缺少審計(jì)追蹤功能或未啟用,時(shí)區(qū)未鎖定/ 各檢測(cè)儀器時(shí)間存在較大差異,分析方法變更后未驗(yàn)證,水、環(huán)境檢測(cè)、投訴、偏差等未進(jìn)行年度回顧,變更未進(jìn)行風(fēng)險(xiǎn)評(píng)估/未對(duì)變更前后進(jìn)行對(duì)比,微生物實(shí)驗(yàn)室的標(biāo)識(shí)、人員培訓(xùn)、滅菌設(shè)備等管理存在不足,未進(jìn)行培養(yǎng)基適應(yīng)性試驗(yàn)等。
2)確認(rèn)與驗(yàn)證問(wèn)題涉及驗(yàn)證未考慮最差條件,未建立(再)驗(yàn)證與確認(rèn)計(jì)劃,驗(yàn)證與確認(rèn)未進(jìn)行/部分遺漏,未進(jìn)行清潔驗(yàn)證/清潔驗(yàn)證存在清潔溶劑選擇錯(cuò)誤,未考慮殘留及擦拭點(diǎn)未評(píng)估,工藝驗(yàn)證不充分,溶劑回收風(fēng)險(xiǎn)評(píng)估不足,物料/中間體等制訂的效期未驗(yàn)證等。
3)文件管理問(wèn)題涉及批記錄設(shè)計(jì)不全,批記錄未記錄偏差等異常事件,不同文件/記錄不一致,規(guī)程與實(shí)際操作不一致,記錄散頁(yè)不受控,未及時(shí)記錄和復(fù)核等。
3.2.3 EDQM
2019 年,核查中心共組織EDQM 對(duì)我國(guó)化學(xué)藥生產(chǎn)企業(yè)檢查觀察5家次,發(fā)現(xiàn)缺陷92項(xiàng),約占2019年全部境外藥品檢查機(jī)構(gòu)發(fā)現(xiàn)缺陷的11.60%,平均每次檢查提出陷約18 項(xiàng)。參照GMP 正文章節(jié),對(duì)EDQM 檢查觀察中記錄的缺陷分類,詳見(jiàn)圖6 C。文件管理、質(zhì)量控制與質(zhì)量保證、確認(rèn)與驗(yàn)證部分提出的缺陷分別居第1,2,3位,占比分別為26.09%,25.00%,10.87%。
1)文件管理問(wèn)題涉及批記錄未記錄偏差等異常事件,文件規(guī)定不全/未建立相關(guān)規(guī)程,文件規(guī)定不合理/錯(cuò)誤,記錄設(shè)計(jì)不全/信息填寫(xiě)不全,活頁(yè)記錄不受控,記錄編號(hào)/頁(yè)碼控制缺失,操作人員/復(fù)核人員未簽名等。
2)質(zhì)量控制與質(zhì)量保證問(wèn)題涉及偏差調(diào)查不徹底、評(píng)估不充分,變更未進(jìn)行評(píng)估/變更未完成前已實(shí)施,年度質(zhì)量回顧不全,水系統(tǒng)、潔凈區(qū)環(huán)境等監(jiān)測(cè)缺乏審查和趨勢(shì)分析,新增供應(yīng)商未確認(rèn),取樣點(diǎn)未評(píng)估/檢測(cè)的樣品不具代表性,計(jì)算機(jī)未得到適當(dāng)控制等。
3)確認(rèn)與驗(yàn)證問(wèn)題涉及工藝驗(yàn)證考慮不全,計(jì)算機(jī)系統(tǒng)驗(yàn)證未考慮操作系統(tǒng)的更新問(wèn)題,執(zhí)行的參數(shù)、效期等沒(méi)有進(jìn)行驗(yàn)證,設(shè)備驗(yàn)證不包括附屬設(shè)施,滅菌驗(yàn)證溫度探頭放置位置不科學(xué)等。
4 建議
通過(guò)分析近年來(lái)我國(guó)化藥品生產(chǎn)企業(yè)境外檢查觀察情況及缺陷分布,發(fā)現(xiàn)不同境外藥品檢查機(jī)構(gòu)雖發(fā)現(xiàn)的具體缺陷有差異,但檢查的重點(diǎn)及發(fā)現(xiàn)高頻缺陷的類別基本類似,表明我國(guó)化學(xué)藥生產(chǎn)企業(yè)在質(zhì)量控制和質(zhì)量保證、確認(rèn)和驗(yàn)證、文件管理等方面仍與國(guó)際水平有一定差距,建議藥品生產(chǎn)企業(yè)對(duì)癥下藥,全面提高質(zhì)量管理水平。另外,基于化學(xué)藥生產(chǎn)企業(yè)GMP 的實(shí)際情況,我國(guó)藥品檢查機(jī)構(gòu)也應(yīng)將質(zhì)量控制和質(zhì)量保證、確認(rèn)和驗(yàn)證、文件管理等作為檢查重點(diǎn),結(jié)合化學(xué)藥生產(chǎn)企業(yè)的具體情況,有的放矢地進(jìn)行檢查。
質(zhì)量控制和質(zhì)量保證、確認(rèn)與驗(yàn)證、文件管理等是藥品檢查發(fā)現(xiàn)缺陷的“重災(zāi)區(qū)”。現(xiàn)階段,我國(guó)相當(dāng)部分的化學(xué)藥生產(chǎn)企業(yè)以符合法規(guī)為目的、按GMP 組織生產(chǎn)活動(dòng),但未將GMP 作為強(qiáng)化自身管理的有力工具。化學(xué)藥生產(chǎn)企業(yè)應(yīng)根據(jù)自身實(shí)際,活學(xué)活用,持續(xù)提升其生產(chǎn)質(zhì)量管理水平,最終形成企業(yè)獨(dú)特的質(zhì)量文化[9-10]。
我國(guó)藥品生產(chǎn)企業(yè)GMP 水平參差不齊,而檢查資源又相對(duì)有限[11-12]。我國(guó)藥品監(jiān)管機(jī)構(gòu)可在境外藥品檢查機(jī)構(gòu)監(jiān)管的基礎(chǔ)上進(jìn)行風(fēng)險(xiǎn)研判,聚焦檢查關(guān)鍵性問(wèn)題及高風(fēng)險(xiǎn)問(wèn)題。同時(shí),對(duì)境外藥品檢查機(jī)構(gòu)監(jiān)管發(fā)現(xiàn)的問(wèn)題深入總結(jié)與分析,作為了解我國(guó)化學(xué)藥品行業(yè)生產(chǎn)質(zhì)量管理水平的重要手段。同時(shí),與我國(guó)藥品檢查機(jī)構(gòu)進(jìn)行藥品監(jiān)管時(shí)發(fā)現(xiàn)的問(wèn)題進(jìn)行對(duì)比分析,深入了解藥品的行業(yè)現(xiàn)狀和檢查現(xiàn)狀,做到基于風(fēng)險(xiǎn)的藥品檢查[13-14]。

