全胸腔鏡肺葉切除術對早期非小細胞肺癌患者miR-25、miR-29A、miR-126及T淋巴細胞亞群的影響
趙 芳 韓凱麗 張玉珠
作者單位:450000 鄭州大學第一附屬醫院
非小細胞肺癌(NSCLC)占肺癌的75%~80%,具有發病率高及病死率高等特點,臨床因技術予以有效的治療。現階段,臨床對于早期NSCLC多主張進行手術治療,開胸手術是治療NSCLC的傳統方法,可有效將癌灶清除,穩定患者病情,但手術創傷較大,對患者術后恢復不利[1]。胸腔鏡具有微創性,可有效減輕機體的應激反應,降低出血量,減少術后并發癥的發生[2]。相關研究發現,全胸腔鏡肺葉切除術(VATS)在NSCLC患者的治療中可獲得與開胸手術相同的效果[3]。但關于全胸腔鏡手術對NSCLC患者血漿微小核糖核(miR)指標的報道相對較少,還有待進一步研究。基于此,本研究對胸腔鏡肺葉切除術在NSCL治療中的具體效果進行探討。現報告如下。
1 資料與方法
1.1 一般資料
采用隨機數字表法將2020年1月至2021年1月醫院收治的NSCLC患者80例分為2組,各40例。研究經醫院醫學倫理委員會批準。觀察組中男性28例,女性12例;年齡38~65歲,平均年齡(53.45±5.69)歲;鱗癌12例,腺癌22例,其他6例;左側23例,右側17例;臨床分期:ⅠA期17例,ⅠB期23例;體重指數18.7~27.7 kg/m2,平均體重指數(23.33±1.57)kg/m2。對照組中男性25例,女性15例;年齡37~66歲,平均年齡(53.57±5.73)歲;鱗癌13例,腺癌23例,其他4例;左側26例,右側14例;臨床分期:ⅠA期15例,ⅠB期25例;體重指數18.6~27.7 kg/m2,平均體重指數(23.29±1.60)kg/m2。比較兩組一般資料(P>0.05),研究有可比性。患者及家屬均知曉本研究方案,并簽署知情同意書。
1.2 入選標準
(1)納入標準:符合《中華醫學會肺癌臨床診療指南(2018版)》[4]NSCLC的診斷標準,且經病理檢查確診;具有手術指征;預計生存期>3個月。(2)排除標準:合并嚴重臟器功能原發疾病;妊娠期哺乳期婦女;合并其他部位惡性腫瘤;凝血功能障礙;有既往精神疾病史;既往胸腹部手術史;合并心血管疾病;存在急慢性感染。
1.3 方法
對照組采用開胸手術:患者取健側臥位,氣管插管靜脈復合麻醉后,作切口(15~20 cm)在患者的第5或6肋間,對組織進行鈍性分離,仔細對病灶范圍、大小及周圍情況進行探查,對支氣管、肺靜脈、動脈分支進行游離,常規處理肺動靜脈分支及不全肺裂,閉合器閉合支氣管,將肺葉的病變組織切除,徹底清除肺門及縱膈淋巴結,常規止血,放置引流管,縫合。觀察組采用VATS:氣管插管靜脈復合麻醉后,患者取健側臥位,作切口(1.0~1.5 cm)在腋中線第7或8肋間,作為觀察孔,在鎖骨中線與腋前線第4或5肋間作切口(3~4 cm),作為主操作孔,作切口(1~2 cm)在腋后線第7肋間,作為副操作孔,置入胸腔鏡及相關器械,探查胸腔情況,分離胸腔粘連及不全葉裂,游離肺靜脈、支氣管及肺動脈,采用內鏡直線切開器將癌變的組織切除,經標本袋取出切除組織,左肺對第5、6、7、8、9、10、11組淋巴結進行清掃,右肺對第2、3A、4、7、8、9、10、11組淋巴結清掃,對胸腔進行沖洗,并進行止血操作,確認無出血及漏氣后,放置引流管,關閉切口。
1.4 觀察指標
(1)圍術期指標:統計兩組手術時間、淋巴結清掃數目、術中出血量、術后引流量及住院時間。(2)血漿miR相關指標:術前及術后1 d時,采集患者的空腹靜脈血5 mL,分離獲得血細胞后,采用美國ABI公司生產的ABI 7500實時熒光定量PCR儀測定miR-25、miR-29A及miR-126相對表達量。(3)免疫功能:術前及術后1 d時,采用美國貝克曼庫爾特公司生產的流式細胞儀測定CD3+、CD4+、CD8+、CD4+/CD8+水平。(4)預后:術后每1個月對患者進行隨訪,6個月后每3個月對患者隨訪1次,以月為單位記錄兩組無進展生存期及總生存情況。
1.5 統計學方法
2 結果
2.1 圍術期指標
觀察組住院時間短于對照組,術后引流量及術中出血量均少于對照組,有統計學差異(P<0.05);兩組淋巴結清掃數目、手術時間比較,無統計學差異(P>0.05),見表1。

表1 兩組圍術期指標比較
2.2 血漿miR相關指標
術前兩組miR-25、miR-29A、miR-126水平比較,無統計學差異(P>0.05);兩組術后miR-25、miR-29A、miR-126水平均較術前升高,且觀察組高于對照組,有統計學差異(P<0.05),見表2。

表2 兩組血漿miR相關指標比較
2.3 免疫功能
術前兩組CD3+、CD4+、CD8+、CD4+/CD8+水平比較,無統計學差異(P>0.05);兩組術后CD3+、CD4+、CD4+/CD8+水平均較術前降低,但觀察組高于對照組,兩組CD8+水平均較術前升高,但觀察組低于對照組,有統計學差異(P<0.05),見表3。

表3 兩組免疫功能比較
2.4 預后情況
隨訪1年 兩組無進展生存期及總生存期比較,無統計學差異(P>0.05),見表4。兩組無進展生存期及總生存期的生存函數見圖1、2。
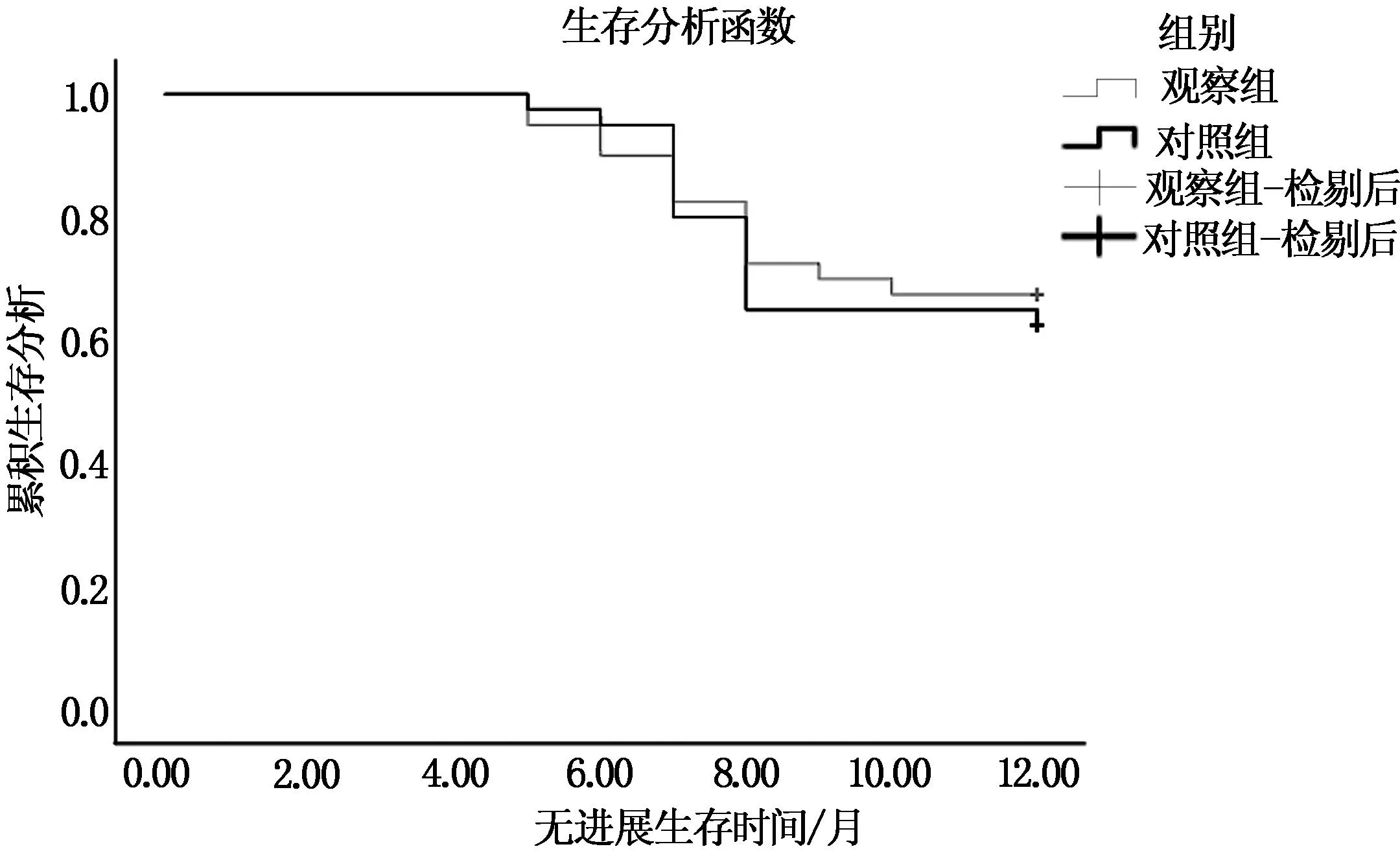
圖1 兩組無進展生存期的Kaplan-Meier曲線比較
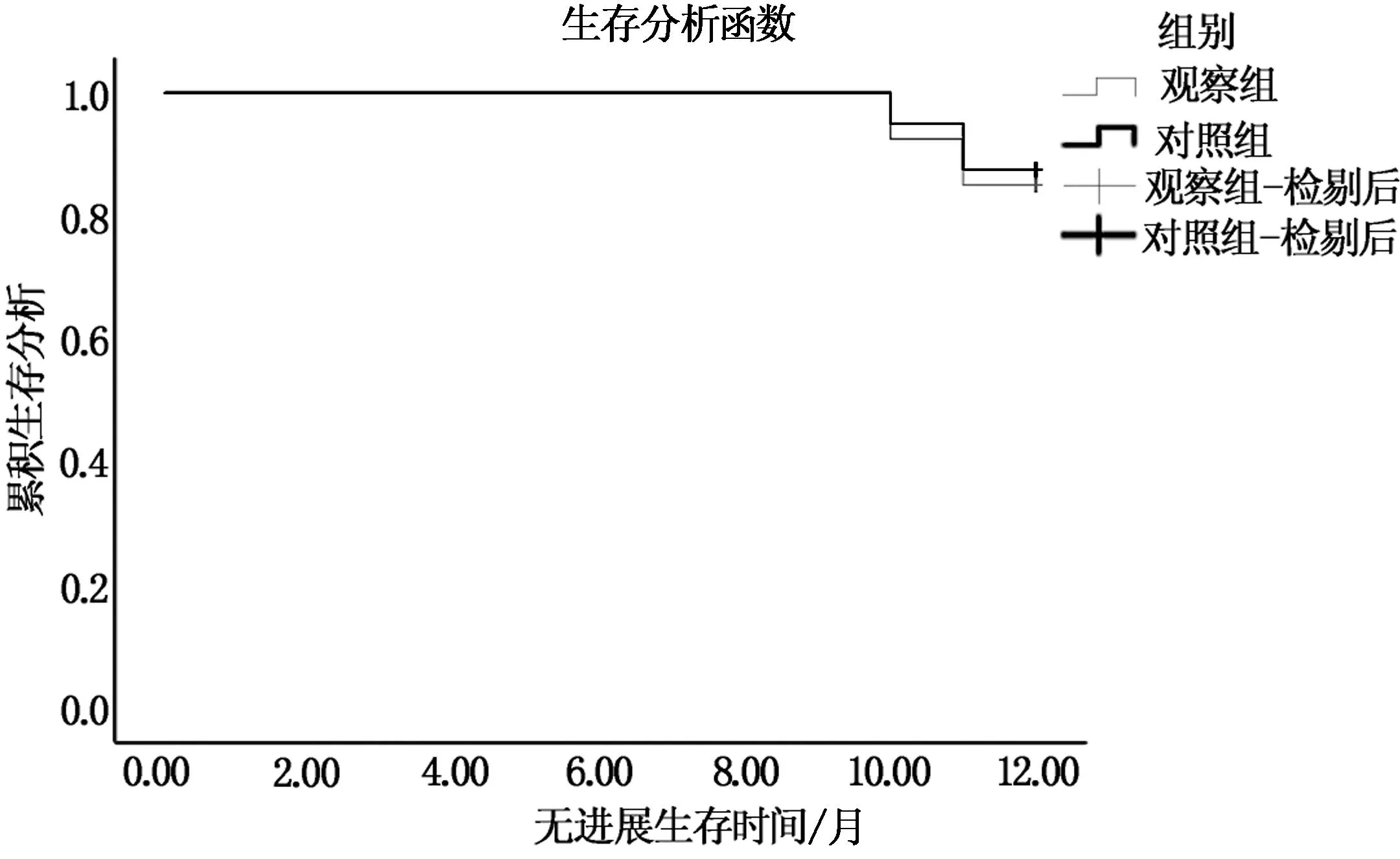
圖2 兩組總生存期的Kaplan-Meier曲線比較

表4 兩組無進展生存期及總生存期比較月)
3 討論
NSCLC的惡性程度較高,且易通過侵犯胸膜進行轉移,且轉移速度較快,嚴重威脅患者的生命安全[5]。現階段,臨床治療早期NSCLC的原則是盡量將癌灶清除,徹底的對縱膈淋巴結進行清掃,并最大限度保留健康的肺部組織[6]。開胸手術是既往臨床治療NSCLC的常用方法,可有效將癌灶清除,并進行淋巴結清掃。但開胸手術的切口大,術中廣泛性剝離對患者的損傷較為嚴重,并發癥多,不利于患者術后恢復[7]。
隨著微創技術的發展,胸腔鏡手術在肺癌治療中得到廣泛應用。本研究結果顯示,觀察組住院時間均短于對照組,術后引流量及術中出血量均少于對照組,術后CD3+、CD4+、CD4+/CD8+水平低于對照組,CD8+水平高于對照組,而兩組手術時間、淋巴結清掃數目、總生存期及無進展生存期比較無統計學差異,說明在早期NSCLC患者行VATS治療可獲得與開胸手術相當的效果,并具有出血量少、術后恢復快、對免疫功能影響小等優勢。其原因為VATS在胸腔鏡下進行手術操作,可有效將手術視野放大,在無死角情況下進行手術操作,對正常肺組織造成的損傷較小。同時胸腔鏡可對胸腔內的情況進行觀察,提高術中操作精細化,減少術中損傷,且胸腔鏡手術切口較小,操作簡單,無需將肋骨切斷,可降低術后并發癥發生風險,有利于患者術后恢復,縮短住院時間[8-9]。全胸腔鏡下手術操作精準性更高,可充分進行淋巴結組織清掃,并可盡可能保留肺組織,減少手術創傷,故對患者免疫功能影響較小[10]。
NSCLC的發病機制復雜,涉及一些列抑癌基因和癌基因的缺失表達或過表達,而miR參與這一過程。其中miR-25可作為抑癌基因,在肺癌的發生發展中起到重要作用;miR-126通過參與磷酸化修飾、蛋白合成、發育等途徑調控NSCLC;而miR-29A在多數腫瘤患者中異常表達,與不同類型的肺癌的發生及發展相關[11-12]。本研究結果顯示,觀察組術后miR-25、miR-29A、miR-126水平均高于對照組,說明VATS可有效調節早期NSCLC患者的血漿miR-25、miR-29A、miR-126水平。相關研究指出,手術將腫瘤組織切除后,可促使癌細胞溶解、死亡,而癌細胞內的miR可釋放至周圍微環境,導致血漿miR表達水平升高[13]。VATS造成的圍術期創傷應激反應較小,殘余癌細胞溶解、死亡較為徹底,故血漿miR-25、miR-29A、miR-126的表達水平更高[14]。
綜上所述,VATS治療早期NSCLC獲得的療效及生存情況與開胸手術相當,可有效調節血漿miR相關指標水平,且具有出血量少、對免疫功能影響小、術后恢復快等優勢。

