TFEB通路和自噬與IgA腎病臨床進程的相關性研究*
羅 潔,戚 月,李 晶,敖廣宇,陳亭宇,陳 民
(成都市中西醫結合醫院腎臟內科,成都 610041)
免疫球蛋白A(IgA)腎病是世界范圍內最常見的原發性腎小球腎炎,最早于1968年被提出,臨床表現為腎功能逐漸下降,腎病理活檢顯示為系膜IgA沉積,這是導致此病高發病率與高致死率的重要原因[1]。在世界范圍內,IgA腎病發病率因不同民族/種族群體的變化導致差異很大,東亞地區的發病率最高,我國IgA腎病患者約占原發性腎小球疾病的45.3%,日本為40.0%,其他亞洲國家為40.0%~50.0%,美國為12.0%,歐洲為25.0%,非洲為5.0%[2-3]。性別之間的分布因地區而異,北美和歐洲地區的男女比例約為2∶1,但東亞地區約為1∶1[4]。除了性別,蛋白尿也是IgA腎病的特征之一,腎小球濾過率的下降速率會隨蛋白尿量而變化,IgA腎病具有廣泛的臨床表現和病程,這導致患者間臨床嚴重程度出現不同表現,不利于開展治療[5]。因此有必要尋找與IgA腎病發展有關的因素。
自噬是一種進化上保守的自我消化系統,雙膜液泡選擇性或非選擇性地吞噬細胞質物質,并與溶酶體融合,降解所含物質[6]。這是一個高度動態的自降解過程,能促進溶酶體依賴的酶消化細胞質成分[7]。轉錄因子EB(transcription factor EB,TFEB)是多種哺乳動物細胞自噬信號的主控制器,能調節自噬相關基因(autophagy-related gene,ATG)和Beclin1、微管相關蛋白1輕鏈3(MAP1LC3B,簡稱LC3)、p62等自噬通路上的關鍵蛋白,在自噬體、自噬溶酶體形成,以及加快自噬底物降解等方面有促進作用[8-9]。盡管有證據表明自噬發生在腎間質纖維化過程中[10],但自噬活化在IgA腎病中的作用及自噬如何影響IgA腎病進程仍處于研究空白。因此,本研究探討IgA腎病患者中TFEB自噬通路與IgA腎病疾病分型的相關性,闡明其可能存在的調控關系,為開發以TFEB自噬通路為靶點的藥物與治療手段提供實驗基礎。
1 資料與方法
1.1 一般資料
選取2021年12月至2022年12月本院診斷并收治的IgA腎病患者24例。納入標準:(1)年齡18~60歲;(2)住院經腎臟病理活檢證實為IgA腎病;(3)首次行腎穿刺活檢患者;(4)腎組織病理切片腎小球數量>5個。排除標準:(1)過敏性紫癜腎炎、狼瘡性腎炎、乙型肝炎病毒相關性腎炎、類風濕性關節炎腎損傷等繼發性腎臟病患者;(2)有高血壓、糖尿病、自身免疫性疾病、腎功能不全、腎小球源性血尿及蛋白尿等病史;(3)拒絕執行腎穿刺者。本研究通過醫院倫理委員會批準(審批號:2023年KT第18號),所有患者均簽署相關知情同意書。以Katafuchi積分標準[11]作為IgA腎病患者分級標準,0級為無明顯病變,Ⅰ級為病變面積<30%,Ⅱ級為病變面積30%~70%,Ⅲ級為病變面積>70%。納入研究的24例患者,Katafuchi 0~Ⅲ級每個分級各6例。
1.2 方法
1.2.1一般資料與實驗室資料收集
記錄患者年齡與性別,在空腹狀態下采集靜脈血5 mL,收集24 h尿液,冷藏待測。采用全自動活檢腎穿針(美國巴德公司),16G或18G一次性活檢針在B超定位引導下行經皮腎穿刺活檢術,麻醉方式為局部麻醉,取材部位統一為腎下極,每例患者收集2份腎活檢組織供后續檢測。
1.2.2指標檢測
生化分析儀(深圳邁瑞生物醫療電子股份有限公司)檢測患者外周血中血肌酐(Scr)、尿素(UREA)和24 h尿蛋白水平。免疫組織化學染色法檢測腎穿組織中TFEB、LC3B、p62和腎病蛋白(nephrin)表達水平,腎穿組織病理切片經脫蠟至水、抗原修復、阻斷內源性過氧化物酶、血清封閉、一抗孵育、二抗孵育、DAB顯色、細胞核復染、脫水固封后,顯微鏡下觀察并使用圖像分析系統計算每張圖像陽性面積占比(%DAB)。抗體信息:TFEB(英國Abcam公司,1∶100)、nephrin(江蘇親科生物研究中心有限公司,1∶100)、LC3B(武漢三鷹生物技術有限公司,1∶100)、p62(武漢愛博泰克生物科技有限公司,1∶100)、兔二抗(武漢賽維爾生物科技有限公司,1∶100)。采用蘇木精-伊紅(HE)對腎穿組織病理切片進行染色,顯微鏡下觀察腎臟及腎小球病變情況。
1.3 統計學處理
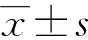
2 結 果
2.1 各分級IgA患者一般資料
各分級IgA患者年齡與性別差異無統計學意義(P>0.05),見表1。

表1 各組患者年齡與性別分布情況
2.2 各分級IgA腎病患者腎功能指標檢測結果
各分級患者24 h尿蛋白與血清中尿素水平比較,差異無統計學意義(P>0.05);Scr水平隨IgA腎病分級增大而升高(P<0.05),見表2。

表2 各組患者腎功能指標檢測情況
2.3 各分級IgA腎病患者腎穿組織病理學結果
結果顯示,Katafuchi 0級患者腎臟組織被膜較為完整,皮質與髓質分界較為清晰,皮質區腎小體結構完整清晰,腎小囊腔清晰可見,血管球未見毛細血管基底膜或系膜增生,無變性、壞死及纖維化;腎小管結構較為完整,上皮細胞未見明顯變性壞死,近曲小管刷狀緣豐富,管腔內無細胞管型或蛋白管型。Katafuchi Ⅰ級患者腎臟組織結構較為正常,腎小球局部輕度或輕微系膜增寬,部分區域系膜細胞增生,腎小管結構較為正常,偶見少量纖維組織增生。Katafuchi Ⅱ級患者腎臟組織結構被破壞,腎小球系膜彌漫性增厚、增寬,系膜細胞增多明顯,偶見硬化,周圍局部腎小管輕度萎縮半纖維組織增生及少量炎癥細胞浸潤。Katafuchi Ⅲ級患者腎臟組織腎小球結構被破壞,彌漫性系膜增殖和增寬、小球硬化明顯,偶見新月體、球囊粘連,腎小管萎縮明顯,間質可見大量纖維組織增生及炎癥細胞浸潤,以淋巴細胞為主,見圖1。

紅色箭頭:腎小球系膜增厚;綠色箭頭:腎小管萎縮;藍色箭頭:組織纖維增生。
2.4 各分級IgA腎病患者TEFB、nephrin、LC3B和p62蛋白表達水平比較
免疫組織化學檢測結果顯示,與Katafuchi 0級患者比較,Katafuchi Ⅰ級患者LC3B蛋白表達水平升高,nephrin蛋白表達水平降低,Katafuchi Ⅱ、Ⅲ級患者TEFB與LC3B蛋白表達水平升高,nephrin和p62蛋白表達水平降低(P<0.05),見表3、圖2。

圖2 各分級IgA腎病患者TEFB、nephrin、LC3B和p62蛋白表達情況(DAB染色)

表3 各分級IgA腎病患者TEFB、nephrin、LC3B蛋白和p62表達水平比較
2.5 影響IgA腎病分級的因素分析結果
IgA腎病分級與患者性別、年齡、24 h尿蛋白、尿素無相關性(P>0.05);與患者Scr和TEFB、LC3B蛋白表達水平呈正相關(P<0.05),與p62和nephrin蛋白表達水平呈負相關(P<0.05),見表4。

表4 IgA腎病分級與患者各指標的相關性分析
2.6 IgA腎病分級單因素回歸分析
以IgA腎病分級為因變量,在相關性分析中差異有統計學意義的指標為自變量,進行單因素回歸分析。結果顯示:Scr和p62、TEFB、nephrin和LC3B蛋白為IgA腎病分級的影響因素(P<0.05),見表5。

表5 IgA腎病分級單因素回歸分析
3 討 論
尿液蛋白質分析是一種比活檢更安全的選擇。尿液中蛋白質的主要來源是腎臟,尿液中的蛋白質生物標志物水平高于血液,尿液樣本在20 ℃下較為穩定,即使存儲多年也可以用于蛋白質分析[12]。目前臨床已發表了約40種尿蛋白標志物,其中20種能特異性標記IgA腎病;在低蛋白尿和腎功能穩定的IgA腎病中,30種尿蛋白和4種潛在標志物水平會發生改變[13]。一項大規模多中心研究結果顯示,尿中的膠原蛋白碎片數量減少可能對進展性IgA腎病最有意義,因為腎臟纖維化中膠原蛋白降解和膠原酶抑制減少[14]。蛋白尿是腎功能喪失最重要預測因子,腎小球濾過率的下降速率隨著蛋白尿量的增加而增加[15],表明蛋白尿可能與IgA腎病進展之間存在密切關系。本研究病理結果顯示,隨著IgA腎病分級的不斷提高,患者腎臟組織中腎臟及腎小球增生明顯,腎小球結構破壞程度也逐漸增加。IgA腎病患者雖然出現不同程度的蛋白尿,但是尿蛋白高低與IgA腎病分級卻沒有明顯相關性。相關檢測發現,只有Scr與IgA腎病分級具有正相關,這可能是因為IgA腎病具有廣泛的臨床表現和病程,臨床嚴重程度因個體差異而明顯不同。不同患者之間蛋白尿與腎功能差別較大,少數病例(約5%)可自發緩解,少數病例腎功能由快速惡化演變成緩慢進行性惡化,也有患者根本沒有進展[16]。這提示只根據臨床和組織學特征對患者進行詳細分層較為困難,初步判斷蛋白尿與尿素都可以作為IgA腎病患者的診斷標志,但不適用于疾病發展進程判斷,而Scr水平則可作為評價IgA腎病病情進展的輔助標準。
自噬是真核細胞中普遍存在的細胞生物學過程,它消除了受損的細胞器和生物大分子,被證明是維持細胞內穩態重要且高度保守的調節機制[17]。與選擇性降解短壽蛋白的泛素-蛋白酶體系統比較,自噬更喜歡老化和功能失調的細胞質蛋白[18]。IgA腎病患者的自噬現象最早是通過電子顯微鏡觀察足細胞發現,SATO等[19]發現支持細胞的自噬類型與IgA腎病的預后密切相關,以Ⅰ型自噬為主的IgA腎病患者腎損傷更嚴重,復發次數更多,進展更快,預后更差[20-21]。TFEB是溶酶體生物發生和自噬的主要調節因子,在正常生理條件下,TFEB被哺乳動物雷帕霉素C1靶蛋白(mTORC1)磷酸化,導致其被保留在細胞質中[22]。在饑餓或其他應激條件下,mTORC1從溶酶體中被釋放出來,導致TFEB去磷酸化,快速易位至細胞核,與自噬相關基因的啟動子區結合,誘導自噬體的生物發生、自噬體與自噬體融合[23]。在自噬溶酶體過程中,過表達TFEB可增加自噬小體的形成,而缺乏LC3/Atg8同源物會導致TFEB活化受阻[24],說明TFEB與LC3兩者可能與IgA腎病發展進程具有直接關系。本研究結果顯示,與Katafuchi 0級患者比較,Katafuchi Ⅰ級患者LC3B蛋白表達水平升高,nephrin蛋白表達水平降低,Katafuchi Ⅱ、Ⅲ級患者TEFB與LC3B蛋白表達水平升高,nephrin和p62蛋白表達水平降低,IgA腎病分級與患者Scr和TEFB、LC3B蛋白表達水平呈正相關,與p62和nephrin蛋白表達水平呈負相關。其中,nephrin是一種重要的足細胞特異性蛋白,參與調節肌動蛋白動力學和細胞存活的信號通路[25]。有研究發現,在IgA腎病大鼠中,nephrin的表達先增加后減少,提示這是一種代償性改變[26],結合本研究結果,說明IgA腎病患者中腎臟及腎小球損傷有可能是TFEB通路介導自噬造成的,高水平自噬及nephrin減少均有可能是促進IgA腎病進程的關鍵因素。單因素回歸分析結果顯示,TFEB、nephrin、LC3B和p62蛋白水平均是IgA腎病疾病進程的影響因素,與趙明明[27]研究結果一致,說明基于TFEB、LC3B和p62等自噬通路關鍵靶點可以對IgA腎病進行預測與治療,nephrin表達與自噬具有一定的相關性,可用于日后相關藥物的研究與開發,但其中涉及的機制還需要進一步深入研究。
綜上所述,IgA腎病患者發病進程與Scr、TFEB、LC3B、p62和nephrin等指標高度相關,提示Scr高水平,TFEB、LC3B高表達及nephrin、p62低表達均是IgA腎病患者病情惡化的潛在標志。

