lncRNA RUNX1-IT1和miR-195在NSCLC組織中的表達及臨床意義*
秦少文,張方琪
(1.中部戰(zhàn)區(qū)總醫(yī)院呼吸與危重癥醫(yī)學科,武漢 430070;2.中國人民解放軍聯(lián)勤保障部隊第九八七醫(yī)院呼吸與危重癥醫(yī)學科,陜西寶雞 721000)
非小細胞肺癌(non-small cell lung cancer,NSCLC)是肺癌的一種主要類型,其中腺癌和鱗狀細胞癌占大多數(shù)[1-3]。盡管目前在早期檢測和治療選擇方面進行了廣泛的研究,但該病依舊治療困難,晚期患者的5年生存率低于15%[4-5]。因此,尋找與NSCLC診斷及預后相關的生物標志物十分必要。長鏈非編碼RNA(long noncoding RNA,lnc RNA)已被發(fā)現(xiàn)在許多癌癥發(fā)生、發(fā)展過程中起著關鍵作用[6-8],且可參與包括NSCLC在內(nèi)的腫瘤的發(fā)生、發(fā)展[9-11]。RUNX1-IT1由RUNX1基因的內(nèi)含子轉錄,RUNX1的異常表達與NSCLC的進展密切相關[12]。但目前為止,RUNX1-IT1未在NSCLC中被報道過。miR-195被發(fā)現(xiàn)在NSCLC中表達下調(diào),并抑制NSCLC的細胞增殖[13]。已有研究證實,lncRNA RUNX1-IT1和miR-195之間存在調(diào)控位點。本研究旨在探討lncRNA RUNX1-IT1和miR-195在NSCLC中的表達及其臨床意義,現(xiàn)報道如下。
1 資料與方法
1.1 一般資料
選取2017年5月至2019年5月于武漢某三級甲等醫(yī)院接受手術治療的106例NSCLC患者為研究對象。納入標準:(1)術前未接受放化療及相關輔助治療;(2)臨床資料及術后隨訪資料完整,且病理標本保存完好;(3)經(jīng)病理科檢測及本院兩位副主任醫(yī)師確診為原發(fā)性NSCLC。排除標準:(1)合并其他惡性腫瘤;(2)嚴重心、肝、腎功能不全;(3)伴有重度支氣管擴張或慢性阻塞性肺疾病;(4)合并有嚴重免疫系統(tǒng)缺陷或血液病;(5)患者資料不全,依從性差,不配合。106例研究對象中男56例,平均年齡(58.53±10.87)歲,女50例,平均年齡(61.84±11.62)歲;腺癌46例,鱗癌60例;TNM分期Ⅰ~Ⅱ期39例,Ⅲ~Ⅳ期67例;有淋巴結轉移55例,無淋巴結轉移51例;高分化63例,低-中分化43例。
1.2 方法
1.2.1標本采集
采集研究對象NSCLC組織及癌旁正常組織(距癌組織>5 cm)。術后通過門診、電話及復查等方式對患者每3個月進行1次隨訪,隨訪截止時間為2022年5月31日,隨訪終點為隨訪時間終止或患者死亡。
1.2.2實時熒光定量PCR(quantitative real-time PCR,qPCR)
采用Trizol?試劑(美國Invitrogen公司)提取實驗所用組織中的總RNA,另經(jīng)NanoDrop 2000測定RNA的質(zhì)量和濃度。用PrimeScript RT試劑盒(日本Takara公司)將總RNA逆轉錄成cDNA。qPCR的檢測采用StepOnePlus real-time PCR系統(tǒng)(美國Applied Biosystems公司)和SYBR?Premix Ex TaqTM試劑(日本Takara公司)。反應體系為:cDNA產(chǎn)物2 μL,2× SYBR?Premix Ex TaqTMⅡ 8 μL,上下游引物各1 μL,50× ROX Reference Dye 0.4 μL,RNase-Free H2O 7.6 μL。反應條件為:95 ℃ 5 min;95 ℃ 15 s,58 ℃ 40 s,72 ℃ 30 s,共40個循環(huán)。以U6為內(nèi)參,lncRNA RUNX1-IT1和miR-195的表達水平以2-ΔΔCt表示。實驗所用引物序列見表1。

表1 實驗所用引物序列
1.3 統(tǒng)計學處理
2 結 果
2.1 lncRNA RUNX1-IT1和miR-195表達水平比較
與癌旁組織比較,NSCLC組織lncRNA RUNX1-IT1表達水平明顯升高,miR-195表達水平明顯降低,差異有統(tǒng)計學意義(P<0.05),見表2。
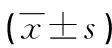
表2 lncRNA RUNX1-IT1和miR-195表達水平比較
2.2 lncRNA RUNX1-IT1和miR-195表達水平與患者臨床病理特征關系
根據(jù)lncRNA RUNX1-IT1和miR-195表達水平,將NSCLC患者分為lncRNA RUNX1-IT1高表達(≥3.65±0.33)、低表達(<3.65±0.33)和miR-195高表達(≥0.46±0.05)、低表達(<0.46±0.05)。lncRNA RUNX1-IT1高表達患者中有淋巴結轉移、TNM分期為Ⅲ~Ⅳ期、低-中分化的比例明顯高于低表達患者(P<0.05);miR-195低表達患者中有淋巴結轉移、TNM分期為Ⅲ~Ⅳ期、低-中分化的比例明顯高于高表達患者(P<0.05),見表3。

表3 lncRNA RUNX1-IT1和miR-195表達水平與患者臨床病理特征關系[n(%)]
2.3 不同lncRNA RUNX1-IT1和miR-195表達水平NSCLC患者的生存分析
lncRNA RUNX1-IT1高表達患者3年總生存率為35.60%(21/59),低表達患者為64.40%(38/47);miR-195高表達患者3年總生存率為68.75%(33/48),低表達患者為31.25%(15/58),見圖1。

A:lncRNA RUNX1-IT1高、低表達患者的生存曲線圖;B:miR-195高、低表達患者的生存曲線圖。
2.4 NSCLC患者的預后影響因素分析
以淋巴結轉移、TNM分期、分化程度、NSCLC組織lncRNA RUNX1-IT1和miR-195表達情況為自變量,以NSCLC患者隨訪期間生存狀態(tài)為因變量,進行多因素Cox比例風險回歸模型分析,結果顯示有淋巴結轉移、TNM分期為Ⅲ~Ⅳ期、低-中分化、lncRNA RUNX1-IT1高表達、miR-195低表達是NSCLC患者預后的獨立危險因素(P<0.05),見表4。

表4 NSCLC患者的預后影響因素分析
3 討 論
NSCLC具有高發(fā)病率及高病死率的特點,雖然目前分子靶向治療能明顯提高NSCLC患者的生存率,但其5年生存率仍然低于20%。由于缺乏有效的早期診斷方式,多數(shù)患者在確診時已至晚期,這也是該病患者預后較差的主要原因之一。因此,尋找能為NSCLC患者診斷和預后提供幫助的生物標志物是十分必要的。
lncRNA具有調(diào)節(jié)轉錄、增殖的功能,其分布在細胞核和細胞質(zhì)中,可為多個蛋白分子提供結合位點。已有多項研究發(fā)現(xiàn),lncRNA在腫瘤組織中有表達差異,可作為腫瘤診斷的生物標志物。如lncRNA MALAT1的下調(diào)可以通過增強miR-124和降低STAT3表達來抑制NSCLC的發(fā)生、發(fā)展。JIANG等[14]發(fā)現(xiàn),lncRNA HOTAIR的下調(diào)可通過上調(diào)miR-613的表達來抑制NSCLC的腫瘤發(fā)生和轉移。LI等[15]研究發(fā)現(xiàn),lnc01296/miR-143-3p/ATG2B軸在促進NSCLC進展和紫杉醇耐藥性的過程中至關重要。
RUNX1定位于人類染色體21q22區(qū)域,已被發(fā)現(xiàn)可參與腫瘤細胞的增殖和侵襲,且與患者預后相關[16]。BROWNE等[17]研究發(fā)現(xiàn),RUNX1促進了小鼠乳腺腫瘤的發(fā)展,并可能是人類乳腺癌進展和轉移的關鍵促進因素和預后因素。WU等[18]研究顯示,miR-216a-3p可通過靶向RUNX1和激活核因子-κB信號通路抑制人胃癌細胞的增殖、遷移和侵襲。另有研究證明,Rasip1部分受轉錄因子RUNX1調(diào)控,可能成為NSCLC的治療靶點[19]。lncRNA RUNX1-IT1是RUNX1的內(nèi)含子轉錄本1,定位于人類染色體21q22.12區(qū)域,長度為1 502個核苷酸。已有研究發(fā)現(xiàn),lncRNA RUNX1-IT1在結直腸癌、胰腺癌、惡性多形性腺瘤和口腔鱗癌的發(fā)生、發(fā)展中扮演重要角色[20-23]。但目前為止,其未曾在NSCLC中被報道過。本研究對106例NSCLC患者癌組織及癌旁組織進行檢測,結果發(fā)現(xiàn)lncRNA RUNX1-IT1在NSCLC組織中的表達明顯上調(diào),說明其表達水平與NSCLC的發(fā)生、發(fā)展密切相關。隨后,本研究探討了lncRNA RUNX1-IT1的表達水平與患者臨床病理特征的關系,發(fā)現(xiàn)lncRNA RUNX1-IT1高表達患者3年總生存率明顯低于低表達患者。且多因素Cox風險回歸模型分析發(fā)現(xiàn)lncRNA RUNX1-IT1高表達是NSCLC患者不良預后的獨立指標。上述結果表明,lncRNA RUNX1-IT1可能是NSCLC患者預后的生物標志物。
已有研究證明,lncRNA可通過與miRNA競爭性結合來調(diào)節(jié)腫瘤的進程。miR-195在多種類型的癌癥中具有腫瘤抑制功能,如miR-195可通過靶向細胞周期蛋白D1抑制宮頸癌細胞的增殖,其還可通過靶向CHEK1抑制NSCLC[13,24]。WU等[25]研究發(fā)現(xiàn),lncRNA RUNX1-IT1可通過與miR-195發(fā)生海綿吸附作用,進而促進膠質(zhì)母細胞瘤的增殖,且二者間具有結合位點。但二者與NSCLC患者預后的關系卻未曾被報道過。本研究發(fā)現(xiàn),miR-195在NSCLC組織中的表達水平明顯降低,低表達患者3年總生存率明顯低于高表達患者。多因素Cox風險回歸模型分析發(fā)現(xiàn)miR-195低表達是NSCLC患者不良預后的獨立指標,這一結果表明,miR-195同樣可能是NSCLC患者預后的生物標志物。
綜上所述,lncRNA RUNX1-IT1在NSCLC組織中表達上調(diào),miR-195在NSCLC組織中表達下調(diào),二者均可作為NSCLC患者潛在的預后生物標志物。但目前l(fā)ncRNA RUNX1-IT1和miR-195在NSCLC中的作用機制尚不明確,需進一步進行基礎實驗加以證實。

