脛骨橫向骨搬移治療糖尿病足的機制研究*
陳子豪,黎 立,艾爾肯·熱合木吐拉,司 裕,周泓宇,李靖揚
(新疆醫科大學附屬中醫醫院骨五科,烏魯木齊 830000)
糖尿病足(diabetic foot,DF)是糖尿病患者最嚴重的慢性并發癥之一,由于糖尿病引發的血管與神經病變,下肢微循環受到阻礙,最終可能導致肢體末端缺血性壞死、潰瘍和感染[1-3],其患病率為6.3%,預計到2040年全球范圍內的DF患者將達到6.42億[4-5]。25%的DF患者伴有潰瘍,而常規治療的1年復發率約為40%,3年和5年復發率為60%與65%[6],85%~90%的DF患者需要截肢,但其術后的5年死亡率仍高達25%~50%[7-9]。DF的臨床治愈十分困難且費用高昂,給家庭與社會帶來極大的負擔[10-11]。因此,迫切需要有效提高DF患者保肢率、降低死亡率的新的治療策略。
基于張力-應力法則的脛骨橫向骨搬移(tibial transverse transport,TTT)技術,通過持續應力性牽拉,能夠加速細胞新陳代謝,改善微循環,促進組織再生,近年來在DF治療方面受到廣泛關注[12]。目前研究表明,TTT治療DF具有成本低、手術簡便、創傷小、保肢率高等優勢[13],但其具體的作用機制尚不明確。基質細胞衍生因子-1(stromal cell-derived factor-1,SDF-1)及其趨化因子受體(chemokine receptor type 4,CXCR4)可調控骨髓源間充質干細胞歸巢,并在促進DF潰瘍愈合方面發揮關鍵作用[14]。近期研究還發現,SDF-1/CXCR4信號軸能夠活化磷脂酰肌醇3激酶(phosphatidylinositol 3 kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信號通路,促進細胞遷移[15-16]。因此,本研究旨在探討并驗證TTT技術是否通過SDF-1/CXCR4信號軸調控PI3K/Akt信號通路,促進DF潰瘍愈合,為TTT治療DF的機制研究提供更多的數據支持。
1 資料與方法
1.1 一般資料
選取2021-2022年在本院接受治療的63例DF患者為研究對象。納入標準:(1)符合《中國糖尿病足診治指南》[17]與《中西醫結合防治糖尿病足中國專家共識(第1版)》[18]中的診斷標準,且Wagner分級為2~4級的2型糖尿病并發DF患者;(2)民族不限,性別不限,年齡≥30歲;(3)下肢血管造影檢查提示下肢主要動脈無明顯堵塞;(4)創面局部組織無明顯感染或感染已經得到控制;(5)保肢意愿強烈,要求行TTT或常規保守治療。排除標準:(1)患足局部有惡性創面或未選擇保肢治療;(2)納入研究前30 d內接受過生長因子或高壓氧治療;(3)患有嚴重的蜂窩織炎或骨髓炎;(4)合并嚴重肝腎功能損害、惡性腫瘤、血液系統疾病等;(5)由于主觀或客觀因素無法配合手術或自愿退出研究。根據不同治療方式分為試驗組與對照組,兩組患者性別、年齡、BMI、糖化血紅蛋白、空腹血糖、糖尿病病程、Wanger分級、DF潰瘍面積與部位、創面感染程度與合并癥比較差異均無統計學意義(P>0.05),具有可比性,見表1。本研究經醫院醫學倫理委員會審查(2021XE0102-1),患者均簽署知情同意書。

表1 兩組患者一般資料比較
1.2 方法
1.2.1試驗組采用TTT治療
術前患者進行專科檢查和下肢血管造影檢查,嚴格監測并調節血糖水平,輔助抗生素控制感染,改善周圍神經功能,維持機體內環境平衡等。術中對患者病變部位進行麻醉處理后取平臥位,安裝橫向骨搬移外固定支架,于脛骨中上段內側做弧形切口,不同切口之間的距離在3~5 cm,全層切開至骨膜,將骨膜剝離后按照要求截取單層骨皮質,調整脛骨搬移外支架至合適位置固定,縫合骨膜和軟組織,敷料包扎。術后對患者應用抗生素預防感染,定期更換創面敷料及消毒針孔,于術后第5天使用外固定支架搬移骨塊,按照1 mm/d的速度向外側搬動,每天分4次搬移(0.25 mm/次);2周后以相同速度反向搬移,待骨塊復位即可擇期拆除外固定支架,橫向搬移共耗時4周。在搬移過程中,應注意防止發生創面感染,復查X線片后除去外固定支架,并再次進行下肢血管造影檢查。
1.2.2對照組采用常規保守治療
患者均在內分泌科醫師的指導下應用胰島素控制血糖,改善周圍神經功能,糾正內環境失衡,應用抗生素控制感染,并結合局部清創進行保守治療。
1.2.3療效標準
根據兩組患者的臨床癥狀與表現情況,判定臨床療效。顯效:創面愈合,紅腫、潰瘍、感染等臨床癥狀全部或基本消失;有效:創面部分愈合,肉芽組織生長良好,紅腫、潰瘍、感染等臨床癥狀有所改善;無效:創面未愈合,紅腫、潰瘍、感染等臨床癥狀未好轉甚至加重。總有效率(%)=(顯效例數+有效例數)/總例數×100%。
1.2.4外周血采集與單個核細胞分離
分別于治療前后抽取患者空腹外周靜脈血,將血液置于離心管當中適當翻轉以避免發生凝血現象,2 000 r/min離心10 min后去除上層血清,在剩下的細胞當中添加DMEM培養基,對其進行稀釋處理,混合均勻后獲得細胞樣本。加入淋巴細胞分離液后2 000 r/min離心30 min,分離并收集單個核細胞,以用于進一步實驗。
1.2.5多色流式細胞術檢測T細胞亞群指標變化
采用FACS Calibur流式細胞儀(美國BD公司)進行多色流式細胞檢測,其中FITC標記CD3抗體,APC標記CD4抗體,PE標記CD8抗體,PerCP標記CD45抗體。將患者的外周血根據上述方法收集與分離后,重懸單個核細胞并調整細胞濃度為1×107/mL,再分別加入20 μL熒光抗體CD3FITC/CD4APC/CD8PE/CD45PerCP,通過MultiSET軟件獲取數據,建立SSC/CD45PerCP、CD8PE/CD3-FITC、SSC/CD3FITC、CD4APC/CD8PE熒光散點圖,使用SSC/CD45PerCP-Gating細胞群圈門排除碎片干擾,每管獲取15 000個細胞,計算CD4+與CD8+比值。
1.2.6Western blot檢測相關蛋白表達情況
將收集的細胞樣品加入裂解液后勻漿,提取蛋白,采用二喹啉甲酸法對提取蛋白質進行定量。取20 μg蛋白經十二烷基硫酸鈉聚丙烯酰胺凝膠電泳轉印至聚偏二氟乙烯膜,5%脫脂牛奶室溫封閉2 h,分別加入一抗SDF-1抗體(1∶1 000,美國Abcam公司,ab9797)、CXCR4抗體(1∶1 000,美國Abcam公司,ab124824)、PI3K抗體(1∶8 000,美國CST公司,#4292)、p-PI3K抗體(1∶3 000,美國CST公司,#4228)、Akt抗體(1∶8 000,美國Abcam公司,ab8805)、p-Akt抗體(1∶3 000,美國Abcam公司,ab81283)、GAPDH抗體(1∶1 000,美國Abcam公司,ab181602)。GAPDH作為內參,4 ℃孵育過夜,緩沖液洗滌后加入二抗羊抗兔IgG(1∶2 000,美國Abcam公司,ab6721)室溫孵育2 h,增強化學發光法顯影,ImageJ軟件分析蛋白條帶灰度值,計算各蛋白相對表達水平。
1.3 統計學處理
2 結 果
2.1 臨床療效比較
試驗組的總有效率(93.94%)明顯高于對照組(73.33%),差異有統計學意義(P<0.05),見表2。試驗組患者術中可見感染性潰瘍,術后1個月原潰瘍處可見新生肉芽組織,且未見感染等不良反應,3個月后可見DF創面愈合良好,見圖1。

A~C:試驗組DF患者術中、術后1個月、術后3個月右足背部創面恢復情況;D、E:試驗組DF患者TTT術后外固定支架側面與正面圖。

表2 兩組臨床療效比較[n(%)]
2.2 T細胞亞群指標比較
治療前兩組患者CD3+、CD4+、CD8+、CD4+/CD8+水平比較差異均無統計學意義(P>0.05)。治療后試驗組CD3+、CD4+及 CD4+/CD8+水平均高于對照組,CD8+水平低于對照組,差異有統計學意義(P<0.05),見表3。
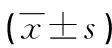
表3 兩組T細胞亞群指標比較
2.3 SDF-1/CXCR4信號軸與PI3K/Akt信號通路相關蛋白表達情況
治療前兩組患者SDF-1、CXCR4、p-PI3K、p-Akt蛋白表達水平比較差異無統計學意義(P>0.05);治療后試驗組SDF-1、CXCR4、p-PI3K、p-Akt蛋白表達水平均高于對照組,差異有統計學意義(P<0.05),見表4、圖2。

圖2 治療前后兩組SDF-1/CXCR4信號軸與PI3K/Akt信號通路相關蛋白表達情況
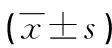
表4 兩組SDF-1、CXCR4、p-PI3K、p-Akt蛋白表達水平比較
3 討 論
DF潰瘍的病理機制復雜,與糖代謝紊亂、微血管功能障礙、周圍神經病變、免疫系統失調等因素密切相關[19-21]。DF的發病與進展通常由多種因素互相作用引起,最終導致足部受損和組織壞死,尤其針對重度DF潰瘍甚至壞疽,臨床治療只能選擇截肢手術以防止DF患者進一步發生感染性休克與死亡。因此,在臨床治療中需要能夠降低截肢率和保留DF患肢及其功能的治療方式,這對于DF患者的康復與預后具有重要的意義。
有學者發現在同一方向持續牽拉骨、肌肉、神經、血管可以刺激組織再生,并提出了遵循組織張力-應力法則的骨搬移技術[22-23]。骨搬移按照骨干長軸與骨塊搬移方向的關系分為橫向與縱向,Ilizarov技術的出現解決了臨床治療長骨骨不連與大段骨缺損等難題[24-25]。隨著近年來骨搬移技術的不斷發展,TTT已在臨床中廣泛運用于治療DF與下肢血栓閉塞性脈管炎等下肢缺血性疾病,尤其在DF微血管重建方面表現出較好的應用前景[26-29]。雖然研究已證實骨搬移的骨窗牽拉區域內會發生微循環重建,且多數研究認為是由于其牽拉應力動員了機體內某種生物因子,從而促進血管與神經等組織再生[13],但目前TTT技術牽引組織再生的詳細機制尚未完全闡明。
T細胞可分為CD4+與CD8+兩大亞群,其中CD4+與CD4+/CD8+水平降低是免疫缺陷的重要指征[30],而維持CD4+和CD8+T細胞之間的相互作用與平衡能夠使機體產生正常免疫應答[31]。此外,早期研究還認為T細胞在創面修復中能夠產生多種炎癥因子,且創面的損傷與CD8+T細胞的作用密切相關[32]。本研究結果顯示,DF患者治療前均存在T細胞免疫功能缺陷,這與既往研究結果基本一致[33-34]。對比兩組DF患者治療前后T細胞亞群的變化,發現TTT治療DF患者的CD3+、CD4+及CD4+/CD8+水平均高于對照組,而CD8+水平低于對照組,表明TTT技術可以明顯改善DF患者的T細胞免疫功能,加速創傷修復。
SDF-1/CXCR4信號軸不僅能通過激活多種信號通路從而介導細胞增殖與遷移,而且能在DF潰瘍等慢性創傷修復的過程中發揮重要的生物學作用,近期研究還發現SDF-1/CXCR4信號軸能夠參與并激活PI3K/Akt信號通路[14,35-37]。本研究結果顯示,與常規治療相比,TTT治療DF患者SDF-1、CXCR4、p-PI3K、p-Akt蛋白表達水平均明顯升高。LEE等[38]研究也證實了軸向牽張應力可引起血漿中SDF-1蛋白表達水平升高。此外,LI等[15]與XIU等[16]研究均表明SDF-1/CXCR4信號軸能夠通過PI3K/Akt信號通路促進骨髓源干細胞的遷移。因此,TTT治療DF可能通過上調SDF-1/CXCR4信號軸激活PI3K/Akt信號通路,促進細胞遷移到受損組織進行再生與修復。PI3K/Akt信號通路可能是SDF-1/CXCR4信號軸重要的下游之一,在調節干細胞向創傷組織遷移中發揮關鍵性作用。
綜上所述,TTT治療DF可能是通過激活SDF-1/CXCR4信號軸介導的PI3K/Akt信號通路,參與調控骨髓源干細胞的遷移,進而改善DF潰瘍愈合。TTT技術涉及醫學、生物學、力學等多學科領域,還有待深入研究以闡明其作用機制。

