膠質瘤患者術后血清IL-10、GFAP的表達變化及臨床意義
王志尚 薛蘭輝 王 佳
延安大學附屬醫院腫瘤科一病區,陜西省延安市 716099
膠質瘤是以頭痛、癲癇及神經障礙為主要癥狀的原發性神經系統腫瘤[1]。有研究表明我國膠質瘤發病率為(5~8)/10萬,5年病死率位列全身腫瘤第3位,僅次于胰腺癌及肺癌[2]。目前臨床以手術切除為首要手段,但膠質瘤病灶所處方位特殊,浸潤程度高,肉眼難以區分病灶邊界,經手術難以完全清除病灶,且因術中牽拉、電凝操作還可引發術后繼發性腦損傷,引起神經功能異常,進而影響療效,并導致預后不佳[3]。由此,及時評估膠質瘤術后腦損傷程度可預判療效及預后效果,故尋求特異性標志物為現今研究主要方向。目前,GFAP陽性表達用于膠質瘤分級程度反映獲有可靠證據[4],在微觀水平上可對神經局部代謝情況有一定反映。而白細胞介素-10(IL-10)主要發揮免疫抑制作用,可參與膠質瘤的發生及進展[5]。監測IL-10水平變化可較好反映創傷性腦損傷、缺血性腦卒中等神經損傷。故將GFAP、IL-10用于膠質瘤術后腦損傷評估具有可行,現以此為切入點開展研究,報道如下。
1 資料與方法
1.1 基線資料 選取本院于2020年12月—2022年12月收治的72例膠質瘤患者。納入標準:(1)符合《腦膠質瘤診療規范(2018年版)》中相關標準[6],且經影像學及病理檢查確立為膠質瘤;(2)首診患者,均擇期接受腫瘤切除術;(3)均自愿參與研究。排除標準:(1)存在顱腦外傷史;(2)合并腦梗死;(3)既往進行放化療治療;(4)肝腎功能重度不全;(5)凝血功能嚴重障礙;(6)精神認知異常。按格拉斯哥昏迷評分(GCS,包括語言、運動及睜眼3個維度,總分15分,評分越高,腦損傷程度越輕)評估術后腦損傷,根據腦損傷程度分為輕度組(n=24,GCS評分12~14分)及中重度組(n=48,GCS評分3~11分)。其中,輕度組:男16例,女8例;年齡34~69(50.24±7.56)歲;病理分級:Ⅰ級3例、Ⅱ級10例、Ⅲ級11例。中重度組:男29例,女19例;年齡32~70(52.45±7.49)歲;病理分級:Ⅰ級0例、Ⅱ級20例、Ⅲ級28例。兩組性別、年齡及病理分級比較無統計學差異(P>0.05),具有可比性。
1.2 治療方法 患者經入院后擇期進行腫瘤切除術。經全身麻醉完畢后開顱將骨瓣去除,使病灶及周圍浸潤組織充分暴露,在顯微鏡輔助下開展腫瘤切除術,應基于功能區保護前提下盡最大限度切除病灶,待手術完畢后予以常規止血,對硬腦膜及頭皮逐層縫合。
1.3 觀察指標 收集患者術前(T0)、術后3d(T1)及術后7d(T2)外周血5ml,經離心處理后(3 000r/min,10min)采集血清以備檢測。應用酶聯免疫吸附法(ELISA)測定IL-10、GFAP,試劑由武漢華美生物公司提供。

2 結果
2.1 兩組血清IL-10、GFAP水平比較 與T0時點比較,兩組IL-10、GFAP水平呈先上升后下降趨勢(P<0.05);兩組T0時點IL-10、GFAP水平比較無統計學差異(P>0.05);于T1、T2時點,中重度組IL-10、GFAP水平均高于輕度組(P<0.05),見表1。
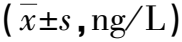
表1 兩組血清IL-10、GFAP水平比較
2.2 Pearson分析血清IL-10、GFAP與GCS的相關性 經Pearson相關性分析結果顯示:T0時點血清IL-10、GFAP與GCS無相關性(P>0.05),T1、T2時點血清IL-10、GFAP與GCS均呈負相關(P<0.05),見表2。
2.3 術后3d血清IL-10、GFAP單一及聯合對術后腦損傷嚴重程度評估價值 經ROC曲線顯示:血清IL-10、GFAP單一評估膠質瘤患者術后腦損傷有一定預測價值,AUC值依次為0.756、0.752,血清IL-10、GFAP聯合預測價值最高,AUC值為0.859,靈敏度、特異度依次為91.67%、66.67%,見表3、圖1。
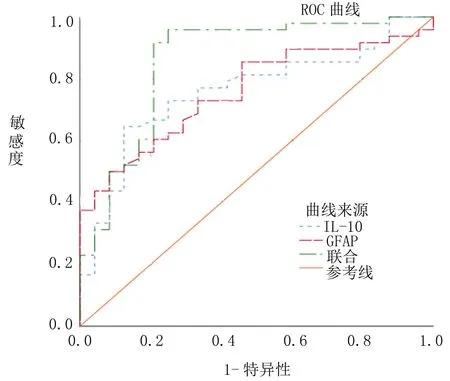
圖1 術后3d血清IL-10、GFAP單一及聯合預測術后腦損傷嚴重程度ROC結果

表3 術后3d血清IL-10、GFAP單一及聯合對術后腦損傷嚴重程度評估價值
3 討論
膠質瘤主要來源于神經膠質、室管膜等神經間質細胞,系臨床難治性神經系統腫瘤。因病灶主要發生于神經外胚層,且具有高侵襲性,可呈浸潤性生長,進而對周圍神經形成壓迫誘發腦水腫、顱內壓升高及相關炎癥反應,最終加重腦組織損傷[7]。在運用腫瘤切除術時因病灶與周圍正常腦組織邊界界定困難,為最大限度保護正常腦組織及血管,通常情況下病灶難以完全切除,且受術中牽拉、電凝等手術操作及機體應激、術后顱內水腫、出血等因素影響,還可導致術后腦損傷加重。由此,準確評估術后腦損傷情況對于手術療效評定至關重要。
鑒于目前多采用GCS量表評估患者意識形態,因主觀性較強,且干擾因素較多,在評估過程中存在較大偏差,難以準確把握術后腦損傷嚴重程度,進而對預后產生不利影響[8]。而GFAP作為膠質瘤標志蛋白,可行使細胞增殖分化、血腦屏障保護、神經遞質平衡及自噬等多項生物學功能,且有研究證實患者因創傷或腫瘤致使神經功能受損時,GFAP可呈異常高表達[9]。本文結果顯示:相比于T0時點,兩組T1、T2時點GFAP呈先上升后下降趨勢。具體分析:膠質瘤疾病發生后,隨病灶細胞生長及轉移,可破壞腫瘤周圍血腦屏障致使GFAP透過屏障流入血液呈異常高水平,經手術切除腫瘤組織后負荷減少或消失,膠質瘤細胞分泌減少,GFAP理應下降,但術后3d GFAP水平上升,原因在于此時期以腫瘤切除術的不良影響占據主要地位,在實施手術切除病灶過程中可損傷局部正常腦組織形成腦水腫,進而加重腦損傷。但隨時間推移,顱內水腫情況得以恢復, 由此導致GFAP降低,且較術前GFAP更低,可見手術獲有較佳療效。本文結果顯示:于T1、T2時點,GFAP與GCS呈明顯負相關,且GFAP單一預測膠質瘤術后腦損傷AUC值為0.752,靈敏度、特異度依次為83.33%、58.33%。表明GFAP用于評估膠質瘤術后腦損傷具有一定預測價值。這與羅肖宇等[10]研究GFAP靈敏度、特異度依次為81.50%、76.8%有一定類似。
IL-10不僅可介導炎癥反應促進腫瘤細胞生長及轉移,且可對抗腫瘤因子及腫瘤細胞凋亡產生抑制[11]。本文結果顯示:相比于T0時點,兩組T1、T2時點IL-10呈先上升后下降趨勢。原因在于腫瘤切除術后短時間腦損傷加重,故IL-10于術后3d有所上升,而隨時間延長,手術效果逐步顯現,因腫瘤組織被切除,病灶細胞合成減少,由此機體炎癥反應有所減輕,且術后繼發性腦損傷逐步恢復,故于術后7d顯著降低,并低于術前IL-10水平。本文結果顯示:于T1、T2時點,IL-10與GCS呈明顯負相關,且IL-10單一預測膠質瘤術后腦損傷AUC值為0.756,靈敏度、特異度依次為75.00%、66.67%。提示膠質瘤術后腦損傷亦可采用IL-10評估。
因膠質瘤術后腦損傷可由多因素、多機制造成,IL-10、GFAP可發揮協同作用共同參與膠質瘤術后腦損傷發生。本文結果顯示:IL-10、GFAP聯合評估膠質瘤術后腦損傷預測價值最高,AUC值為0.859,靈敏度、特異度依次為91.67%、66.67%。據此可知動態監測IL-10、GFAP變化(尤以術后3d最為關鍵)可及時掌握膠質瘤患者術后臨床效果,以便為后續治療提供可靠指導。
綜上所述,IL-10、GFAP變化與膠質瘤患者術后腦損傷有密切關聯,且對腦損傷嚴重程度評估有一定價值,尤以聯合評估效能最佳。

