Mfn2、miRNA-101調控轉化生長因子-β1參與肝泡型包蟲病肝纖維化的研究*
楊德武 馬福財 蓋志剛 王錚 朱海宏
(1.青海大學研究生院,青海 西寧 810000;2.青海省人民醫院普外科,青海 西寧 810000)
棘球蚴病是一種嚴重的人獸共患寄生蟲病,由棘球蚴幼蟲引起。目前研究表明,棘球蚴主要侵犯肝臟,并且在泡型包蟲病(Alveolar Echinococcosis,AE)病例中,多首先發現于肝臟[1]。AE被公認為世界上最致命的慢性寄生蟲病,嚴重威脅患者生命健康[2-5]。TGF-β/smad通路是導致肝纖維化的重要通路之一,在TGF-β亞分型中,TGF-β1(Transforming growth factor-β1,TGF-β1)能導致肝星狀細胞轉分化為肌成纖維細胞,經過一系列病理變化最終導致肝纖維化的發生[6]。α-平滑肌肌動蛋白(α-smooth muscle actin,α-SMA)是一種高度收縮的蛋白質,由肌成纖維細胞分泌,在肝纖維化中具有標志性作用。有研究報道在糖尿病腎病模型中,Mfn2表達增高時,膠原4的表達降低,可抑制腎間質纖維化[7],研究進一步表明敲除Mfn2后,對小鼠的肝纖維化有促進作用[8]。也有研究表明肝纖維化組織中,miRNA-101的表達顯著降低[9],由此可知Mfn2、miRNA-101在纖維化疾病進程中發揮重要作用。本課題旨在研究Mfn2、miRNA-101在肝泡型包蟲病中的表達與纖維化以及與TGF-β1信號通路的關系,完善肝泡型包蟲病導致肝纖維化的理論基礎,希望能為肝泡型包蟲病的治療提供新的治療途徑。
1 資料與方法
1.1 一般資料 以2020年7月-2020年10月在青海省人民醫院確診的20例肝泡型包蟲病患者作為研究對象,其中男性11例,女性9例,年齡20~50歲,均為青海藏族居民,均知情同意并簽署知情同意書。本研究通過倫理委員會批準。納入標準:①術前血清學包蟲抗體陽性,肝臟CT及術后病理均診斷為肝泡型包蟲病。②首次行肝泡型包蟲病病灶根治術。③術前未發現遠處臟器轉移。④無肝炎、黃疸等慢性肝功能受損史。排除標準:①合并肝囊性包蟲病及其它原因占位性疾病(寄生蟲、良惡性腫瘤、肝膿腫等)。②有上腹部尤其是肝膽系統手術史及介入治療史。
1.2 實驗材料 Mfn2兔抗人Ι抗、TGF-β1兔抗人Ι抗、α-SMA兔抗人Ι抗、HRP標記的鼠二抗、HRP標記的兔二抗,RNAsimple總RNA提取試劑盒、cDNA第一鏈合成預混試劑、SuperReal彩色熒光定量預混試劑、miRcute miRNA提取分離試劑盒、miRcute增強型miRNAcDNA第一鏈合成試劑盒、miRcute增強型miRNA熒光定量檢測試劑盒均購自于天根生化科技有限公司(北京),石蠟切片機,光學顯微鏡,羅氏LC480Ⅱ實時熒光定量PCR儀。
1.3 標本采集 各例患者術中取材,分為對照組A組(距病灶邊緣2 cm以外的正常肝組織)、實驗組B組(距病灶邊緣2cm以內肝組織)。1份組織經10%甲醛固定、石蠟包埋、切片(5片)后,分別行HE染色、Masson染色和免疫組化(dako試劑盒,兩步法)。切片由資深病理專家讀片,依據肝纖維化分期半定量評分系統METAVIR進行分級。免疫組化結果由兩位病理醫師采用盲法獨立檢測,在高倍鏡(400×)下讀片, 每張切片隨機觀察5個組織豐富的視野,按照陽性細胞所占百分比及細胞染色強度兩評分相加,兩位醫師的檢測數據結果取平均值綜合判定,評定標準,見表1。3份組織放入液氮后轉入-80℃冰箱保存,以備RT-qPCR使用。

表1 免疫組化計分判定標準
1.4 提取總RNA及miRNA 標本在液氮中充分研磨至粉末狀態,取適量粉末標本放入無酶管中,按照RNAsimple 總RNA提取試劑盒及miRcute miRNA提取分離試劑盒說明書提取總RNA及miRNA。
1.5 反轉錄 Mfn2、TGF-β1、α-SMA體系由5×FastKing-RT SuperMix 4ul、TotalRNA 1.5 ul、RNase-Free ddH2O 14.5ul組成20ul體系,程序:42℃、15 min,95 ℃、3 min ;miRNA-101由miRNA 5ul、2×miRNA RT Reaction Buffer 10ul、miRNA RT Enzyme Mix 2ul、RNase-Free ddH2O 3ul組成20 ul體系,程序:42 ℃、60 min,95 ℃、3 min。
1.6 實時熒光定量法(RT-qPCR) Mfn2、TGF-β1、α-SMA引物序列由生工生物工程(上海)股份有限公司設計、合成,miRNA-101序列由天根生化科技有限責任公司引物庫查詢得到并由上海生工生物有限公司合成,GAPDH內參基因于生工生物工程(上海)股份有限公司購買,U6內參基因于天根生化科技有限責任公司購買。具體引物序列,見表2。反應體系20 uL,設立3個復孔。Mfn2、TGF-β1、α-SMA的RT-qPCR程序:預變性95 ℃ 15 min,然后95 ℃變性10 s、60 ℃退火20 s、72 ℃延伸20 s,40個循環;miRNA-101的RT-qPCR程序:預變性95 ℃ 15 min,然后94 ℃變性20 s、60 ℃退火/延伸34 s,45個循環。反應結束后確認擴增曲線和溶解曲線。以GAPDH為內參照,計算目的基因Mfn2、TGF-β1、α-SMA的mRNA相對水平;以U6為內參照,計算目的基因miRNA-101的相對水平;計算結果用2-ΔΔCt表示。

表2 Mfn2、TGF-β1、α-SMA、GAPDH、miRNA-101、U6引物序列
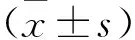
2 結果
2.1 HE、Masson染色及免疫組化檢測 依據HE、Masson染色,距病灶邊緣2 cm以外基本為正常肝組織,距病灶邊緣2 cm以內存在不同程度的纖維化,見圖1、2。 Mfn2、TGF-β1、α-SMA免疫組化檢測在肝組織內的表達呈黃色、棕黃色及棕褐色,見圖3~5。

圖1 肝組織HE染色(200×)

圖2 肝組織Masson染色(200×)

圖3 Mfn2在正常肝組織及肝纖維化組織中的表達(400×)

圖4 TGF-β1在正常肝組織及肝纖維化組織中的表達(400×)

圖5 α-SMA在正常肝組織及肝纖維化組織中的表達(400×)
2.2 Mfn2、TGF-β1、α-SMA蛋白和mRNA表達量 Mfn2、TGF-β1、α-SMA蛋白和mRNA在A、B組表達差異均有統計學意義(P<0.01);Mfn2蛋白和mRNA表達量在B組比A組顯著降低(P<0.001);TGF-β1蛋白和mRNA表達量在B組比A組顯著升高(P<0.001);α-SMA蛋白和mRNA表達量在B組比A組顯著升高(P<0.001),見表3、4。

表3 正常肝組織及病灶旁組織中的Mfn2、TGF-β1和α-SMA蛋白表達結果

表4 正常肝組織及病灶旁組織中的Mfn2、TGF-β1和α-SMA的mRNA表達結果
2.3 Mfn2、TGF-β1、α-SMA蛋白和mRNA在不同等級肝纖維化中的表達 Mfn2蛋白(r=-0.739,P<0.001)和mRNA(r=-0.652,P<0.001)的表達量與肝纖維化程度均成負相關,并且隨著肝纖維化級別增加,Mfn2蛋白和mRNA的表達量逐漸降低;TGF-β1蛋白(r=0.790,P<0.001)和mRNA(r=0.867,P<0.001)的表達量與肝纖維化程度均成正相關,并且隨著肝纖維化級別增加,TGF-β1蛋白和mRNA的表達量逐漸升高;α-SMA蛋白(r=0.882,P<0.001)和mRNA(r=0.758,P<0.001)的表達量與肝纖維化程度均成正相關,并且隨著肝纖維化級別增加,α-SMA蛋白和mRNA的表達量逐漸升高。見表5、6。

表5 Mfn2、TGF-β1和α-SMA蛋白在不同等級纖維化中的表達

表6 Mfn2、TGF-β1和α-SMA的mRNA在不同等級纖維化中的表達
2.4 Mfn2、TGF-β1、α-SMA蛋白和mRNA表達量兩兩之間相關性 Mfn2蛋白與TGF-β1蛋白、α-SMA蛋白表達均呈顯著性負相關(r=-0.768,P<0.001;r=-0.796,P<0.001),TGF-β1蛋白與α-SMA蛋白呈顯著性正相關(r=0.844,P<0.001)。Mfn2 mRNA與TGF-β1 mRNA、α-SMA mRNA表達均呈負相關(r=-0.750,P<0.001;r=-0.622,P<0.01); TGF-β1 mRNA 與α-SMA mRNA表達呈正相關(r=0.753,P<0.001)。
2.5 miRNA-101在肝泡型包蟲病中的表達 miRNA-101在A、B組的表達量差異具有統計學意義(P<0.001),miRNA-101在A組的表達量明顯高于B組,隨著肝纖維化程度加重,miRNA-101表達量逐漸減少,見圖6。miRNA-101的表達量與Mfn2、TGF-β1、α-SMA的 mRNA表達量相關性分析: miRNA-101與TGF-β1 mRNA的表達呈負相關(r=-0.508,P<0.05);miRNA-101與α-SMA mRNA的表達呈負相關(r=-0.709,P<0.001);miRNA-101與Mfn2 mRNA的表達無顯著相關性(r=0.402,P>0.05)。

圖6 miRNA-101在正常肝組織、病灶旁組織以及不同等級纖維化中的表達
3 討論
研究表明,肝纖維化的發展特點是細胞外基質(Extracellular matrix,ECM)過度沉積。ECM的過度產生會導致組織實質的破壞,進而導致肝臟結構框架的改變[10]。目前研究顯示,肝星狀細胞(HSC)的轉分化、激活和增殖是促進肝纖維化進展的主要驅動力[11],病毒、寄生蟲等導致肝細胞受損和免疫細胞浸潤,激活HSC轉分化成肌成纖維細胞。肌成纖維細胞通過合成和分泌膠原纖維促進肝臟細胞外基質的積累。肝泡型包蟲病病灶旁組織出現局部纖維化改變,考慮與泡球蚴入侵肝臟后的增值和彌漫性浸潤生長方式有關。泡球蚴感染入侵肝臟后以出芽和浸潤式的方式增殖,會在肝臟形成很多囊泡,這些囊泡外壁角質層很薄,且與周圍組織沒有明顯的纖維膜界限,并且在肝臟內長期存在,不斷刺激周圍肝組織,長期持續刺激使肝星狀細胞活化轉化成肌成纖維細胞,從而導致ECM的過度產生,導致肝纖維化。
TGF-β的多效性在肝臟疾病進展的幾乎每個階段都發揮著作用,且TGF-β為現知作用最強的促肝纖維化因子[12-13]。TGF-β1被認為是可使HSC激活的主要信號傳導途徑之一,和肝臟中最有效的纖維細胞因子[14-15]。四氯化碳或血吸蟲病引起的中毒導致肝纖維化動物模型中TGF-β1水平升高,并且在肝纖維化患者中,也觀察到TGF-β1 mRNA水平升高[16-17]。此外,α-SMA,被認為是肝纖維化的標記物,本研究發現,在肝泡型包蟲病患者肝臟病灶旁組織局部肝纖維化中,TGF-β1、α-SMA的 mRNA和蛋白水平較正常肝組織明顯升高,并且隨著肝纖維化程度的增加,TGF-β1、α-SMA的 mRNA和蛋白表達水平也逐漸增加,并且TGF-β1與α-SMA相關性分析結果呈正相關,進一步證明了TGF-β1對肝纖維化有促進作用。
Mfn2在許多細胞過程中發揮著各種作用,包括細胞增殖和死亡[18-19]。有研究報道,在小鼠肝纖維化過程中,隨著纖維化程度的進展,Mfn2表達量逐漸下降;高表達Mfn2后,小鼠肝纖維化進程得到一定緩解,并且很有可能是通過TGF-β/Smad通路起作用[20]。另有研究報道慢病毒載體CV072介導的Mfn2過表達抑制肝星狀細胞活化,從而抑制肝纖維化[21]。本研究發現病灶旁纖維化組織中Mfn2的mRNA和蛋白表達量顯著低于正常肝組織,隨著纖維化程度的增加,Mfn2的mRNA和蛋白表達量逐漸降低,并且與TGF-β1、α-SMA分別行相關性分析,顯示Mfn2與TGF-β1、α-SMA呈負相關,表明Mfn2可能通過抑制TGF-β1抑制肝泡型包蟲病肝纖維化的進展。
miRNA是一種非編碼單鏈小RNA,可調節纖維化疾病的生理和病理過程[22]。本研究中,miRNA-101在肝泡型包蟲病病灶旁纖維化組織中的表達量顯著低于正常肝組織,隨著纖維化程度的增加,miRNA-101表達量逐漸降低,并且與TGF-β1、α-SMA分別行相關性分析,顯示miRNA-101與TGF-β1、α-SMA呈負相關,提示miRNA-101可能通過抑制TGF-β1抑制肝泡型包蟲病肝纖維化的進展。有研究報道一些miRNAs已被鑒定通過直接靶向Mfn2參與纖維化和平滑肌細胞增殖[23],但在本實驗中miRNA-101與Mfn2行相關性分析,未發現顯著相關。
4 結論
本研究表明,肝泡型包蟲病病灶旁存在不同程度的局部肝纖維化,纖維化范圍基本局限在病灶旁2 cm以內,病灶旁2 cm以外基本上是正常肝組織;在肝泡型包蟲病肝纖維化中,進一步證明了TGF-β1對纖維化有促進作用;Mfn2、miRNA-101可能抑制肝泡型包蟲病肝纖維化,并且可能通過抑制TGF-β1發揮抗纖維化作用。

