肝轉移瘤患者TACE術后肝臟體積變化對肝功能及預后的影響
王燕慧 張秀真 劉 芳 錢皓月
作者單位:450000 鄭州大學第一附屬醫院
肝轉移瘤較為常見,是其他部位癌癥病灶的癌細胞脫落后經血液循環至肝臟,并于肝臟形成大小不一的轉移性癌癥,且原發性肝癌也可出現肝內播散,形成肝內轉移瘤[1]。臨床認為肝轉移瘤的出現提示腫瘤已開始擴散,病情惡化程度高,難以穩定控制,且幾乎喪失手術治療機會,僅可通過放化療、靶向治療等手段抑制病情進展。肝動脈灌注化療栓塞(TACE)為當前肝轉移瘤常用治療手段,具有侵襲性小、可重復性強、效率高等優勢,通過導管將化療藥物置入肝內腫瘤動脈中,能夠于腫瘤周圍形成高濃度藥物環境,滅殺腫瘤細胞,并可阻斷腫瘤血供,使得瘤體失去營養供應,從而逐漸縮小[2]。但臨床隨訪發現,化療藥物會對肝功能造成一定損害,影響患者預后。相關研究顯示[3],肝臟體積變化與肝功能存在密切關系,通過CT容積法動態評估肝臟容積,能夠良好反映肝臟功能,且操作簡單、可重復性強。但關于TACE術后肝臟體積變化在評估患者肝功能及預后中的具體價值仍需深入研究明確。鑒于此,本研究旨在分析肝轉移瘤患者TACE術后肝臟體積變化對肝功能及預后的影響。報告如下。
1 資料與方法
1.1 一般資料
回顧性分析我院2018年1月至2020年12月收治的86例肝轉移瘤患者臨床資料,其中男性51例,女性35例;年齡49~81歲,平均年齡(64.52±5.19)歲;體質量指數18~28 kg/m2,平均體質量指數(24.05±1.86)kg/m2;原發腫瘤:19例肺癌,22例肝細胞癌,11例結腸癌,17例胃癌,17例胰腺癌。納入標準:經病理證實肝細胞癌或其他癌癥肝轉移;治療前肝功能良好;凝血功能正常;精神狀態正常;患者及家屬簽署知情同意書。排除標準:接受過影響肝體積的治療;門靜脈癌栓患者;中途轉院或失訪;術前CT檢查與TACE治療間隔1周以上。
1.2 方法
TACE術:所有患者經以Seldinger穿刺技術經股動脈插管,將導管緩慢插入腹腔感造影,腫瘤血供明確后,將導管超選至腫瘤供血動脈,隨后注入化療藥物和超液化碘油混合物3~15 mL,化療藥物包括培美曲塞、吉西他濱、雷替曲塞、奧沙利鉑、5-氟尿嘧啶、洛鉑,藥物劑量均嚴格按照說明書要求進行。CT檢查:選用256層螺旋CT儀,于TACE術前及術后4~8周開展平掃、增強掃描,檢查前常規禁食、禁水,并于前30 min指導患者靜坐胸式呼吸,飲入清水600 mL左右,幫助胃腸道充盈;先平掃上腹部,以3 ml/s速度注射對比劑,于注射后34、70 s分別開展動脈期、門靜脈期增強掃描;參數為300 mAs,120 kV,重建層厚、間距均1 mm,螺距0.99,準直器寬度128 mm×0.625 mm,矩陣512×512。之后將獲取的掃描圖像上傳至后臺工作站,經后處理后,由兩名經驗豐富的影像醫師以雙盲法閱片,并測定手術前后肝臟體積(LV)、腫瘤體積(TV)變化,具體方法為腫瘤最清楚顯示時,軸位圖像上勾勒出殘肝、腫瘤,并于矢狀位、冠狀位圖像上調整,之后以計算機開展3D重建并計算體積,并計算術前術后肝臟體積變化值,以△LV表示。采用Child-Pugh分級標準評估患者術前術后肝臟儲備功能變化,內容包括白蛋白水平、凝血酶原活動度、膽紅素水平等多個方面,可分為A、B、C 3個級別,A級最好,C級最差。開展長期隨訪,以患者死亡或隨訪2年為止,隨訪內容包括生存時間。
1.3 觀察指標
(1)肝功能損傷情況:統計86例患者TACE術后肝損傷情況。(2)LV與TV變化:比較肝功能損傷與未損傷組患者術前及術后LV與TV變化。(3)預測價值:繪制ROC曲線,分析LV在預測肝轉移瘤患者TACE術后肝損傷中的應用價值。(4)影響肝轉移瘤患者TACE術后肝功能損傷的因素分析:收集肝功能損傷與未損傷組患者年齡、性別、體質量指數、△LV分級(1級為△LV≤154.22 cm3,2級為△LV>154.22 cm3)、Child-Pugh分級等基礎治療,先開展單因素分析,之后將具有差異指標納入Logistic回歸模型分析,最終獲取影響肝轉移瘤患者TACE術后肝功能損傷的獨立危險因素。(5)肝臟體積變化與預后關系:統計隨訪資料,記錄所有患者生存時間,并分析不同△LV分級患者間生存率差異。
1.4 統計學方法
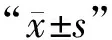
2 結果
2.1 肝功能損傷情況
86例肝轉移瘤患者,TACE術后出現19例肝功能損傷,損傷率為22.09%(19/86)。
2.2 LV與TV變化
2組術前LV、TV相比,差異無統計學意義(P>0.05);術后肝損傷組LV小于未損傷組,TV大于未損傷組,差異有統計學意義(P<0.05)。見表1。
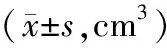
表1 2組LV與TV變化對比
2.3 預測價值
繪制ROC曲線顯示,術后LV、TV預測肝轉移瘤患者TACE術后肝功能損傷的曲線下面積分別為0.916、0.603,LV預測價值高。見表2、圖1。
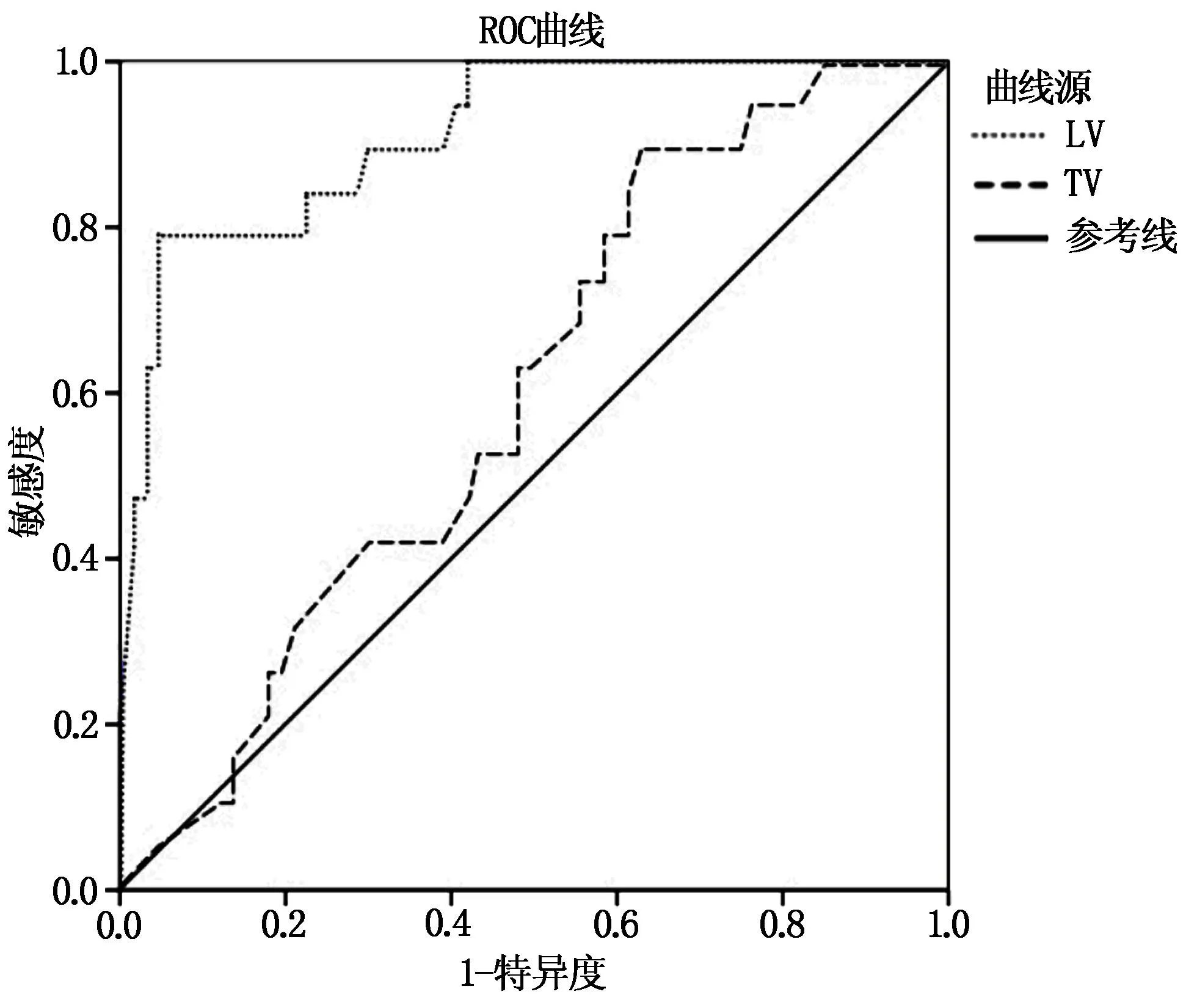
圖1 預測肝功能損傷ROC曲線
2.4 影響肝轉移瘤患者TACE術后肝功能損傷的因素分析
多因素分析顯示,△LV分級、術前Child-Pugh分級為肝轉移瘤患者TACE術后肝功能損傷的獨立影響因素(P<0.05且OR>1)。見表3、4。
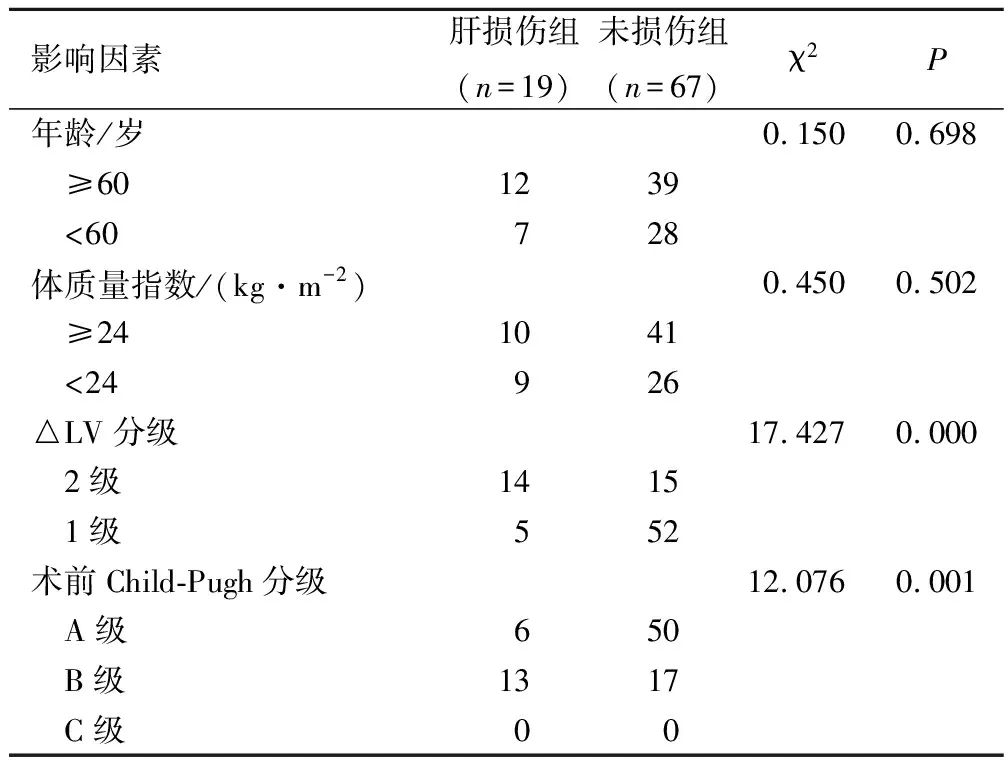
表3 影響肝轉移瘤患者TACE術后肝功能損傷的單因素分析/例

表4 影響肝轉移瘤患者TACE術后肝功能損傷的多因素分析
2.5 肝臟體積變化與預后關系
所有患者中位生存時間為15個月,△LV1級患者中位生存時間17個月,△LV2級患者中位生存時間12個月。隨訪結束,△LV1級患者生存率為78.95%(45/57),△LV2級患者生存率為51.72%(15/29);△LV1級患者生存率高于△LV2級患者,差異有統計學意義(χ2=6.754,P=0.009)。見圖2。
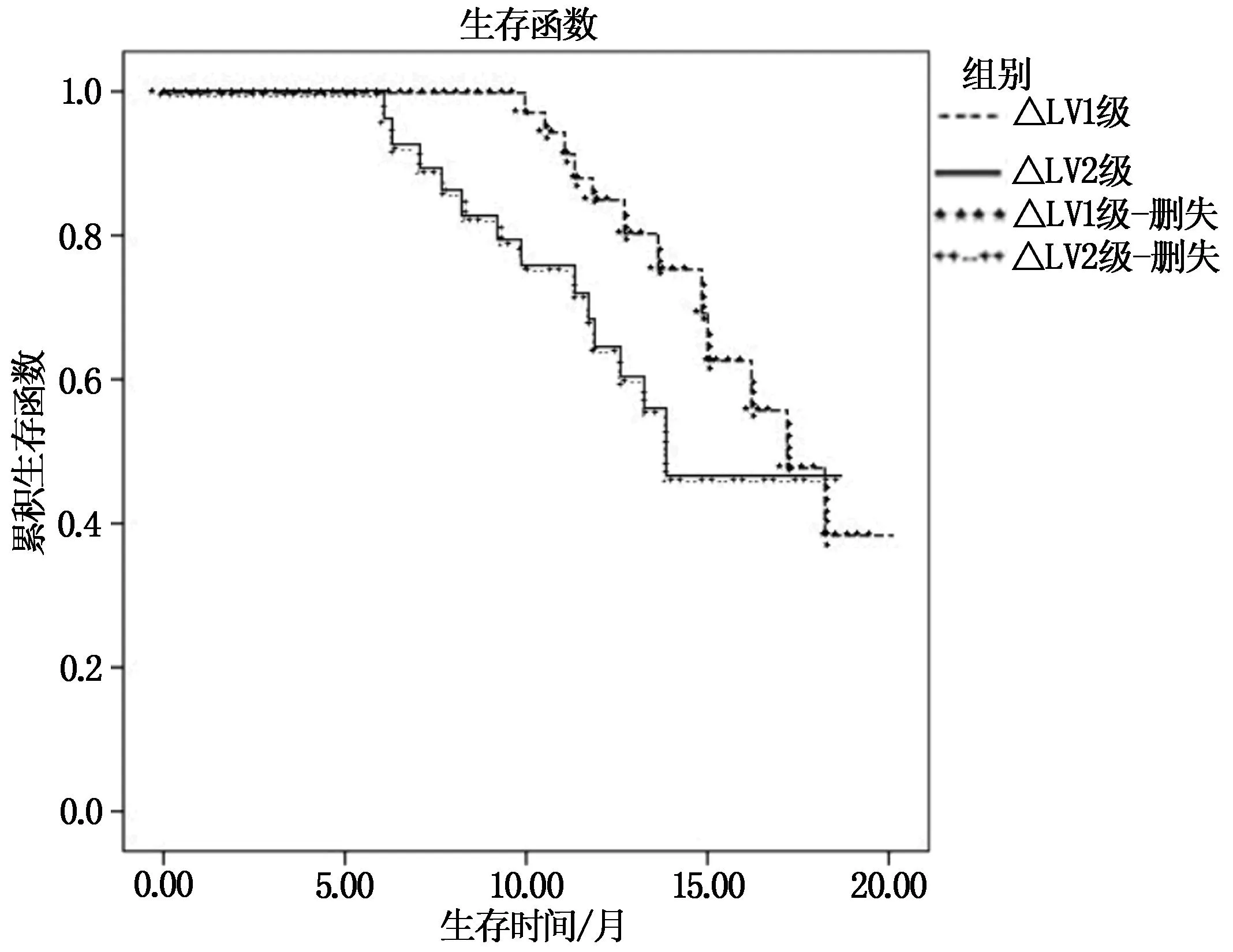
圖2 肝轉移瘤生存曲線
3 討論
肝臟為人體重要組織,為各種惡性腫瘤易發生轉移的臟器,肝臟轉移的發生提示惡性腫瘤進入晚期[4-5]。惡性腫瘤具有較強侵襲、轉移能力,出現肝轉移時多數患者已錯失手術機會,或長期消耗下機體難以承受手術治療,臨床多采取放化療等措施控制病情,以延長生存時間[6]。
TACE為肝轉移瘤重要治療手段,通過導管選擇性插入腫瘤供血靶動脈內,不僅能夠注入化療藥物直接抑制腫瘤細胞生長,還能夠起到栓塞靶動脈作用,切斷腫瘤供血,從而多方面發揮抗腫瘤作用,以延長患者生存時間[7-8]。但臨床長期實踐發現,TACE術后患者易出現肝功能損傷情況,不僅加重肝臟障礙程度,甚至可直接影響患者預后。本研究結果顯示,86例肝轉移瘤患者,TACE術后出現19例肝功能損傷,損傷率為22.09%(19/86);肝損傷組術后LV低于未損傷組,TV高于未損傷組;繪制ROC曲線顯示,LV、TV預測肝轉移瘤患者TACE術后肝功能損傷的曲線下面積分別為0.916、0.603,LV預測價值高;多因素分析顯示,△LV分級、術前Child-Pugh分級為影響肝轉移瘤患者TACE術后肝功能損傷的獨立危險因素(P<0.05且OR>1)。提示TACE術后肝臟體積可發生一定程度變化,且肝損傷患者LV下降明顯,LV可作為預測肝損傷的重要指標。其原因為TACE術治療中注入化療藥物可一定程度上激活促凋亡基因表達,加快肝臟細胞凋亡,并會引起肝內炎癥應答,從而引起肝損傷。同時TACE術中栓塞腫瘤供血動脈的同時也會影響周圍小動脈及毛細血管,使得肝臟組織出現缺血、缺氧等。以上變化過程中均會加速肝纖維化、肝硬化等進展,從而使得LV下降,且LV下降越明顯則越容易出現肝功能損傷[9-10]。同時,Child-Pugh分級能夠直接反映肝臟儲備功能,A級為肝臟儲備功能正常,B級和C級則肝臟儲備功能偏差,故術后肝功能損傷風險較高,還需早期積極進行保肝治療或其他對癥治療,使得肝功能達到理想狀態。本研究結果顯示,△LV1級患者生存率高于△LV2級患者,提示肝臟體積變化與患者預后關系密切,LV下降越明顯則患者預后越差。其原因為肝臟為人體重要代謝器官,不僅能夠合成分泌性蛋白質、儲存肝糖,還可制造消化系統內膽汁、調節機體去氧化功能,一旦肝臟功能發生障礙,則會對機體全身代謝造成一定程度的影響,從而導致預后欠佳[11]。
綜上所述,肝臟體積變化能夠良好預測TACE術后肝功能損傷,且與肝轉移瘤患者預后有關。臨床針對LV下降明顯患者需加強保肝治療,以減輕肝功能損害,改善患者預后。

