急性冠狀動脈綜合征合并惡性腫瘤患者的臨床病理特征及預后分析
鄭潤茹 許亞平 胡豐陽
作者單位:450000 鄭州大學第一附屬醫院
心血管疾病及惡性腫瘤均是誘發人類死亡的主要因素,二者均具有較高發病率,惡性腫瘤的治療會引發心血管疾病,常見的心血管疾病是急性冠狀動脈綜合征(acute coronary syndromes,ACS)。ACS是指粥樣斑塊分裂,并發完整或不完整的閉塞血栓誘發一系列臨床癥狀。ACS合并惡性腫瘤發病情況較急,如不及時治療還會合并發作心律失常、低血壓等,致使患者的病情不斷加重,且會呈現出間接性或連續性的發作,轉變成急性心肌梗塞,嚴重危害患者的生命健康[1-2]。經皮冠狀動脈介入術(percutaneous coronary intervention,PCI)是使用經皮刺入技巧放入導管或其他有關治療工具,緩解動脈窄小或梗塞,再建血流的方式,其可以迅速開通急性閉塞血管,有效降低患者的病死率,且具有較高安全性和有效性,已成為治療ACS患者常用的方式[3-4]。本研究挑選我院172例ACS合并惡性腫瘤患者,研究PCI治療的遠期預后狀況。
1 資料與方法
1.1 一般資料
選取2015年1月至2019年12月我院ACS合并惡性腫瘤患者86例作為合并組,結合1∶1比例選擇同期進行PCI治療的未合并惡性腫瘤的ACS患者86例作為對照組。對照組:男性56例,女性30例;年齡57~72(64.38±1.34)歲;BMI指數18~35(26.47±2.63)kg/m2。合并組:男性63例,女性23例;年齡57~72(64.51±1.41)歲;BMI指數18~35(26.53±2.65)kg/m2。2組基線資料對比無明顯變化(P>0.05)。
1.2 選取標準
(1)納入標準:①確定診斷為急性ST段心梗死(STEMI)[5]、非急性ST段心梗死(NSTEMI)[6]、不穩定心絞痛(UAP)[7];②合并組經活體組織病理學診斷有惡性腫瘤;③均采用手術治療;④患者及家屬同意,簽訂知情書。(2)排除標準:①伴有ACS患者PCI治療病史;②伴有其他心血管疾病及心功能不全患者;③伴有自身免疫性疾病或全身感染性疾病者;④出現PCI治療禁忌證。
1.3 方法
1.3.1 收集資料 采用我院自制調查問卷收集2組患者一般基線資料(性別、年齡、BMI指數、吸煙史、飲酒史等)、以往病史[高血壓、糖尿病、高脂血癥、心肌梗死、心力衰竭、短暫性腦缺血(TIA)、冠心病家族史、PCI、冠狀動脈旁路移植術(CABG)史等]、術后臨床及心臟超聲檢查[高壓(SBP)、低壓(DBP)、心率(HR)、心室射血(LVEF)、腎小球濾過率(eGFR)]、藥物治療狀況[阿司匹林、β受體阻滯劑、P2Y12受體抑制劑、血管轉換酶抑制藥物(ACEI)、利尿劑、他汀類藥物]。冠狀動脈結果需由兩位醫生實施結果判定,冠狀動脈狹窄標準為左主干、前降、回旋、動脈窄小多于50%;PCI有關資料包括病變血管數量、部位、支架部位、種類及特殊病變種類。
1.3.2 術后隨訪 使用電話和門診等方式獲得患者術后遠期預后終點事件,分為主要終點事件[心腦血管不良事件(MACCE)、心血管死亡、非致死心梗死、靶血管重建、腦卒中、心梗死溶栓(TIMI)大出血]和次要終點事件(全因死亡、腫瘤死亡、心源性休克、心血管因素再入院或再次PCI、再次CABG)。TIMI大出血標準為血紅蛋白降低多于50 g/L,紅細胞降低多于15%。
1.4 觀察指標
(1)記錄對照2組基線資料、以往病史。(2)臨床及超聲檢查,記錄對照2組SBP、DBP、HR、LVEF、eGFR變化。(3)藥物使用狀況,阿司匹林、β受體阻滯劑、P2Y12受體抑制劑、ACEI、利尿劑、他汀類藥物使用情況。(4)PCI有關資料,記錄對照2組ACS類型、病變血管數目、特殊病變、支架置入數目。(5)遠期預后。
1.5 統計學方法
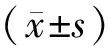
2 結果
2.1 2組一般基線資料、以往病史比較
合并組性別、年齡、BMI指數、以往病史和對照組相比無明顯差異(P>0.05)。見表1。
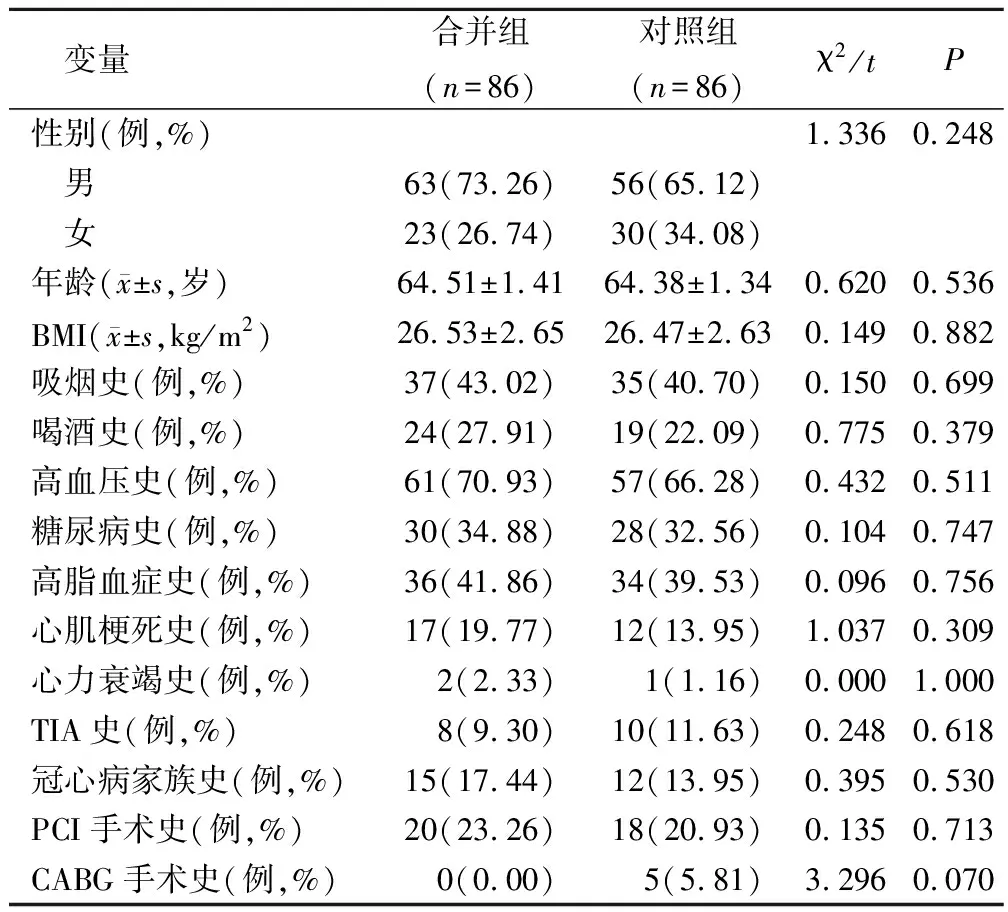
表1 2組一般基線資料、以往病史比較
2.2 2組臨床及超聲檢查比較
合并組SBP、DBP、HR、LVEF、eGFR比對照組高(P<0.05)。見表2。
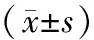
表2 2組臨床及超聲檢查比較
2.3 2組藥物治療狀況比較
合并組阿司匹林、β受體阻滯劑、P2Y12受體抑制劑、ACEI、利尿劑、他汀類藥物使用情況和對照組相比無明顯差異(P>0.05)。見表3。
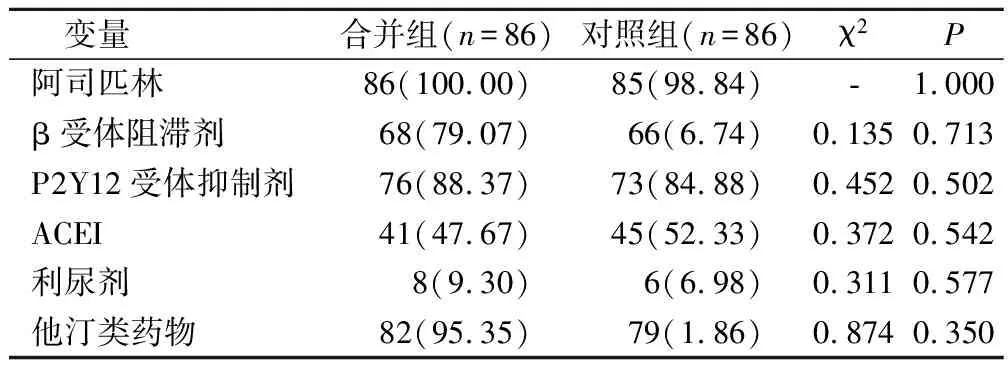
表3 2組藥物治療狀況比較(例,%)
2.4 2組PCI有關資料比較
合并組CTO病變較對照組高,且鈣化病變較對照組低(P<0.05);合并組ACS類型、病變血管數目、左主干病變、分叉病變、支架置入數目和對照組相比無明顯差異(P>0.05)。見表4。
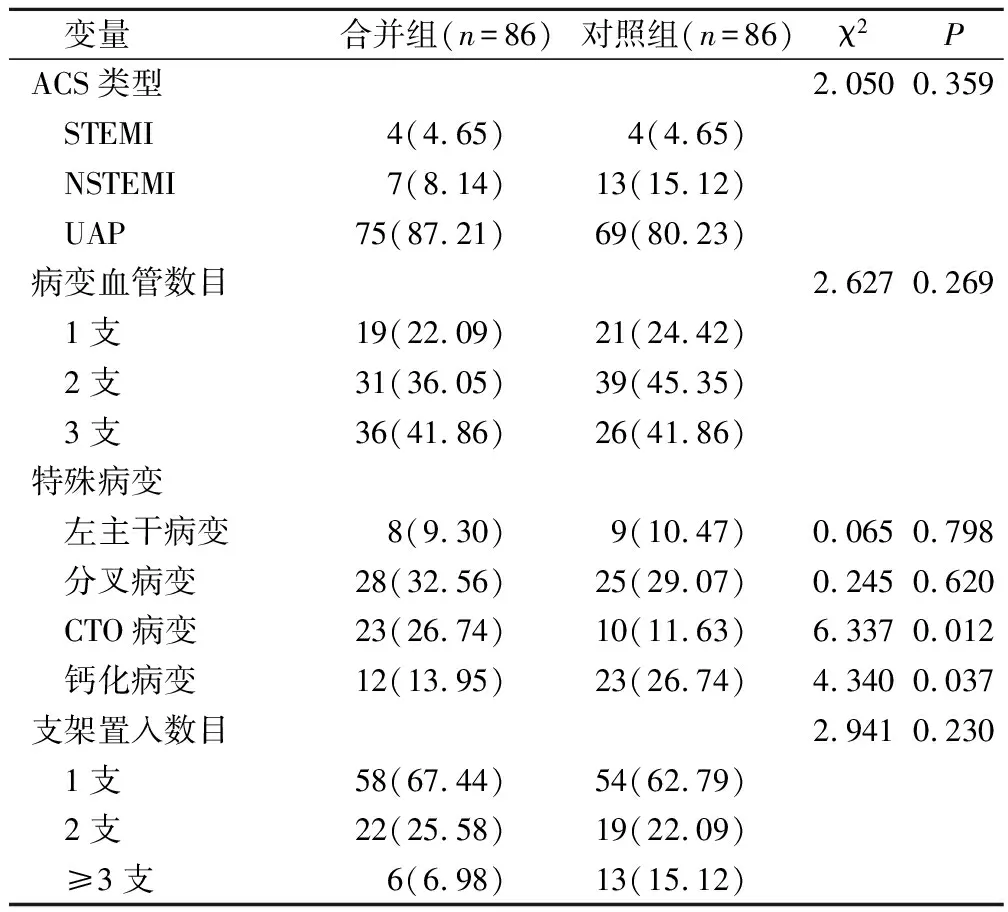
表4 2組PCI有關資料比較(例,%)
2.5 2組遠期預后比較
隨訪8~21個月,平均隨訪時間為(13.41±0.34)個月,剔除隨訪期間失訪患者21例(12.21%),其中合并組失訪11例,對照組失訪10例。合并組靶血管血運重建發生率較對照組低(P<0.05);合并組MACCE、心血管死亡、非致死性心血管死亡、非致死性心肌梗死、腦卒中、TIMI大出血、全因死亡、腫瘤死亡、心源性休克、再入院、再次PCI、再次CABG發生率和對照組相比無明顯差異(P>0.05)。見表5。
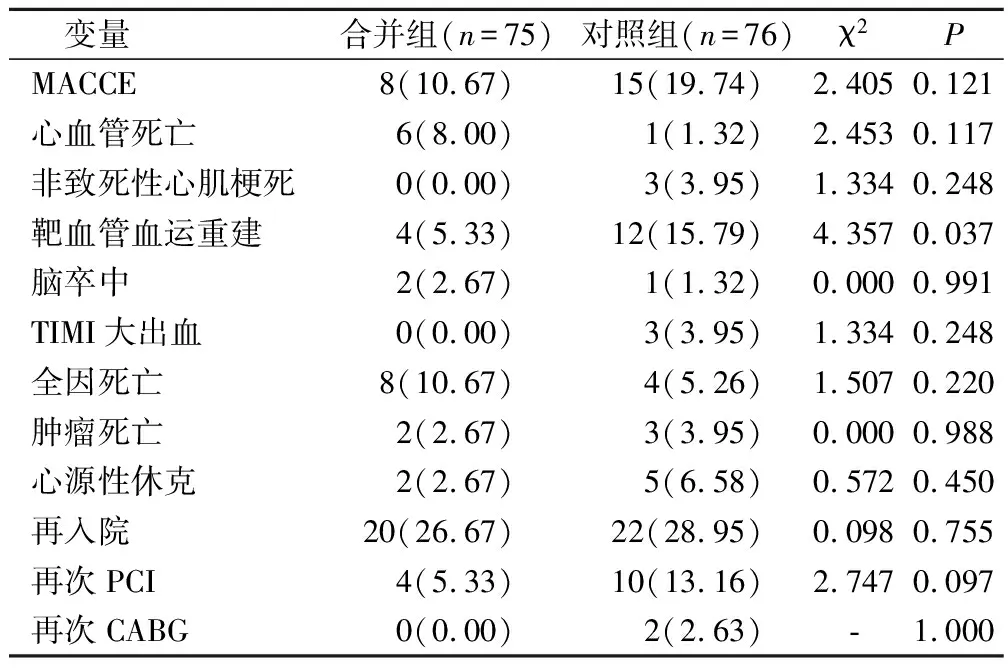
表5 2組遠期預后比較(例,%)
3 討論
惡性腫瘤和心血管疾病具有相同的危險因素,且治療惡性腫瘤的藥物會增加血管損傷,引發ACS。ACS主要發病原因是冠狀動脈粥樣硬化斑塊不穩定、供血與心肌之間產生矛盾、血栓栓塞等,臨床特征為發作性胸骨后悶痛、緊縮壓榨感、壓迫感。ACS合并惡性腫瘤會導致患者的心肌收縮與舒張功能產生異常,增加高血壓的發生概率,且此類病情進展快速,增加胰島素對人體的抵抗能力,會增加病毒感染風險,進而導致患者體內的凝血因子提高,嚴重影響到患者的生命[8]。在以往的臨床治療中,常使用抗栓、冠脈搭橋等方式進行治療,雖具有一定的療效,但會導致患者的經濟負擔加重,且會讓患者產生嚴重的不良反應。
PCI作為一種技術經心導管可以通暢窄小甚至阻塞的動脈管腔,是治療心臟疾病的重要手段,其具有恢復快、效果顯著、安全性高的優勢,可以有效改善心肌缺血,防止急性心梗患者出現生命危險,其可以通過球囊擴張支架將斑塊清除,使冠狀動脈重新通暢,且對患者的影響相對較小,可以有效縮短患者恢復時間,降低心絞痛發生的概率,改善患者預后狀況[9]。本試驗研究ACS合并惡性腫瘤使用PCI術后遠期預后,結果表示,合并組SBP、DBP、HR、LVEF、eGFR比對照組高(P<0.05),提示單純ACS患者血流動力學較穩定。PCI手術可以穩定患者的血壓,以免出現血壓變動,導致患者出現其他心腦血管疾病,對于循環的穩定具有積極意義,還可以保證患者的血流動力學變得平穩。ACS合并惡性腫瘤患者會增加心血管疾病的發生幾率,還會加快血管病變的進展,使血流動力學紊亂。本研究數據還表示,合并組CTO病變較對照組高,且鈣化病變較對照組低(P<0.05),提示合并組特殊病變發生率較高。ACS合并惡性腫瘤患者心血管儲備能力較差,癌細胞會促使炎癥因子和趨化因子的產生,加快血管內皮損傷,讓癌癥患者處于血栓形成前狀態,且內皮細胞損傷后會喪失天然抗凝血特征,并獲取促凝血特征,提高血液高凝狀態,使特殊病變發生率提高[10-11]。本研究數據還表示,合并組靶血管血運重建發生率較對照組低(P<0.05),提示ACS合并惡性腫瘤患者預后不良事件與介入操作無關,大劑量射線會引發微血管破損,誘發內皮組織損壞和功能異常,且血管損傷加快了動脈粥樣硬發展進度,導致患者出現冠狀動脈管腔狹窄,誘發心臟缺血事件。此外治療惡性腫瘤的化療藥物會利用心肌細胞組織消亡而誘發不可逆的心臟異常,同時還會給患者帶來嚴重的心血管損傷。
綜上,惡性腫瘤在PCI術后具有不可忽略的發病率,與單純ACS患者比較,ACS合并惡性腫瘤患者遠期心血管不良事件發生率較高,遠期預后效果較差。

