豬輪狀病毒抗原蛋白相關特性的研究進展
于洪敏,單春喬,梁方印,李 娟,王 巖,劉 艷
(1. 大連三儀動物藥品有限公司,遼寧 大連 116000 ; 2. 濮陽縣農業農村局,河南 濮陽 457000)
急性腹瀉引起的豬群胃腸道感染是十分棘手的問題,也是導致仔豬死亡的重要原因之一,該病的傳播嚴重阻礙了養豬業的健康發展。該病可由病毒、細菌和寄生蟲引起,而在這幾種病原體中,豬輪狀病毒(Rotavirus,RV)被認為最重要且最常見[1]。豬輪狀病毒屬于呼腸孤病毒科、輪狀病毒屬,在我國生豬養殖業中廣泛存在,特別是密集型商業養豬場尤為易感,且該病毒引起的豬場大規模感染和腹瀉不分年齡階段[2],因此研發有效防治該病毒的藥物或疫苗至關重要。本文簡述了豬輪狀病毒的特點及其抗原蛋白的特性,以期獲得一些基線信息,制定未來的防疫策略,保護養豬業免受這一重要病原體的影響。
1 豬輪狀病毒感染的臨床癥狀
豬輪狀病毒感染發生于10~60日齡仔豬,發病率高達80%,新生仔豬感染該病毒后的死亡率可達100%。該病毒感染引起的主要癥狀是精神萎靡、厭食、不愿走動,仔豬患嚴重的胃腸炎和小腸病變,出現脫水性腹瀉,同時該病毒還可破壞機體的酸堿平衡,致使仔豬生長緩慢,嚴重制約了我國養豬業的健康發展,給我國養豬業造成了巨大的經濟損失[3-5]。近年來,不僅越來越多的仔豬由于感染豬輪狀病毒而發生死亡,大豬和種豬往往也呈隱性感染,而且一旦感染豬輪狀病毒,會嚴重影響機體的生長發育,即使恢復健康的成年豬也會停止生長,豬場淘汰率明顯升高。
2 豬輪狀病毒的病原學特征
豬輪狀病毒的外形似車輪,無囊膜,呈二十面體對稱,中央為核酸構成的芯髓,呈致密的六角形(圖1)[6],該病毒核酸中富含大量的A/T堿基對,含量大約在65%,這也是其與大多數病毒的不同之處。豬輪狀病毒是分節的雙鏈RNA(Double-stranded RNA,dsRNA)病毒,由11個片段編碼6個結構蛋白和6個非結構蛋白,結構蛋白包括VP1、VP2、VP3、VP4、VP6和VP7,非結構蛋白包括NSP1、NSP2、NSP3、NSP4、NSP5和NSP6[7],各種蛋白的電泳遷移情況如圖2所示[8]。病毒粒子由3層衣殼蛋白構成,最內層由VP2及少量VP1和VP3蛋白組成,三者共同包裹病毒基因組RNA,形成病毒基因組的核心封裝和復制復合體,是病毒基因轉錄和復制過程中不可缺少的蛋白;中間層由VP6 蛋白組成,呈輻條狀;最外一層由VP7和VP4兩種蛋白質組成,其中VP7蛋白形成病毒的光滑表面,VP4蛋白形成病毒顆粒的尖峰,二者是病毒血清型的主要決定因素[9,10]。
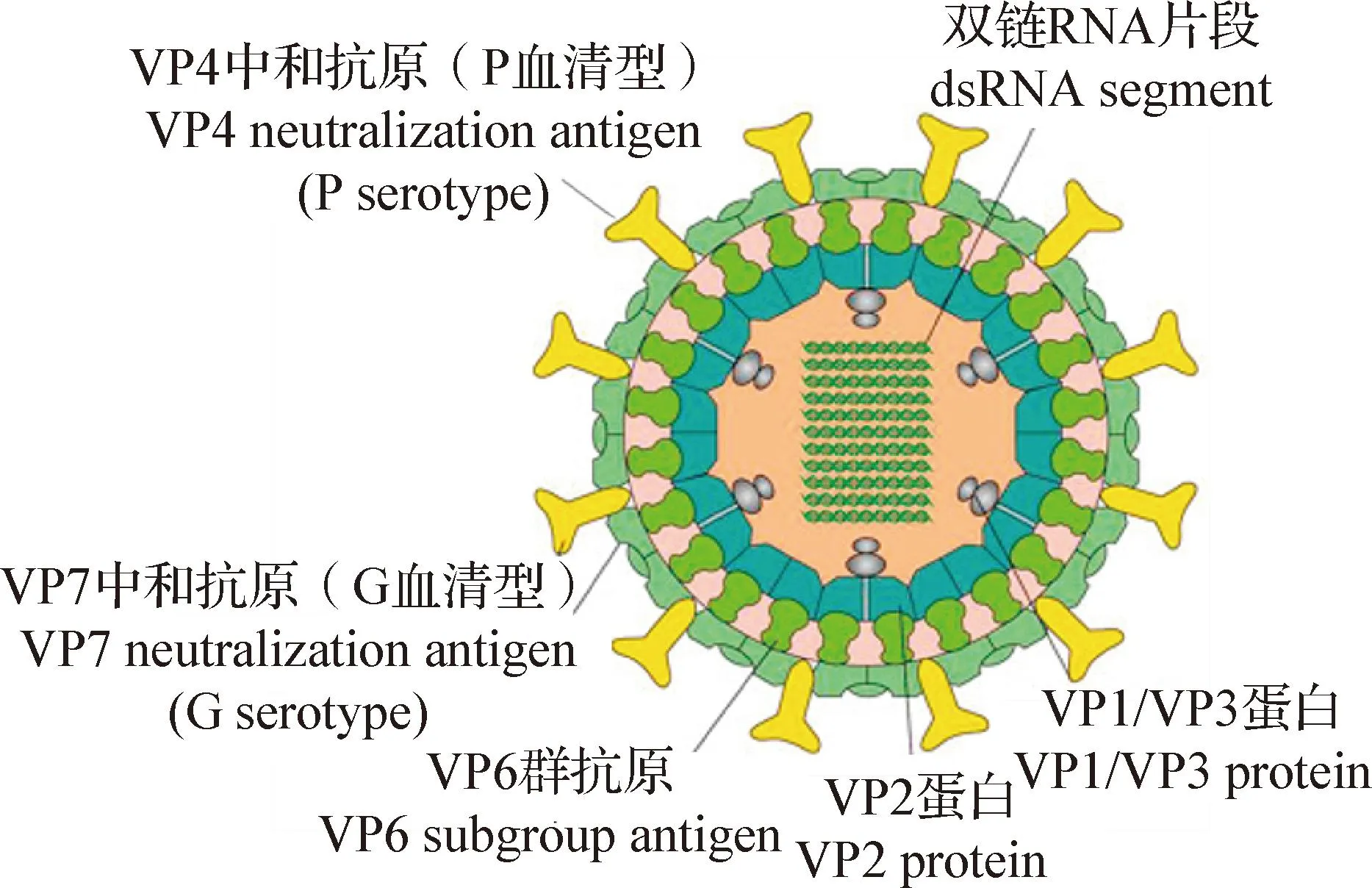
圖1 豬輪狀病毒的病毒粒子結構示意圖[6]Fig.1 Schematic diagram of the viral particlestructure of porcine rotavirus[6]
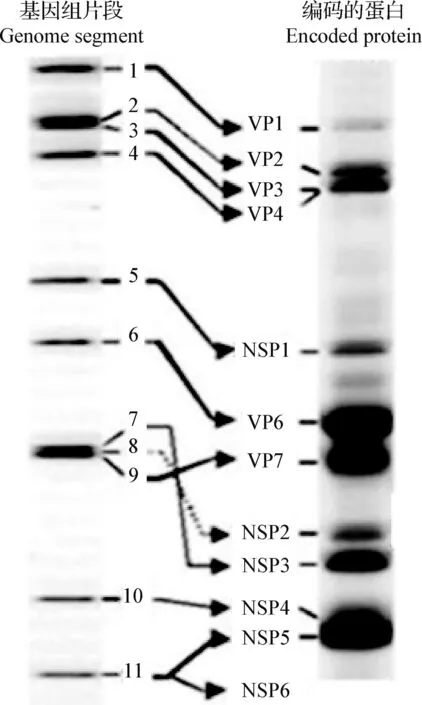
圖2 豬輪狀病毒雙鏈RNA及其編碼蛋白的電泳遷移譜[8]Fig.2 Electrophoretic migration profiles of viral dsRNA and encoded proteins[8]
3 豬輪狀病毒的分群依據和各群差異
豬輪狀病毒VP6蛋白既是核衣殼蛋白也是該病毒的群抗原,根據VP6的抗原特性,將該病毒分為A~J共10個基因群,其中與豬的臨床和經濟密切相關的常見群體是A、B和C基因群,而家畜育種中常診斷出A群輪狀病毒感染,因此,A群輪狀病毒被認為是引起豬腹瀉的主要基因群[11]。根據糖蛋白VP7(G型)和外衣殼蛋白VP4(P型)的抗原特性,可將輪狀病毒分為G型和P型,A群豬輪狀病毒的12個G基因型和16個P基因型都與豬相關,G3、G4、G5、G9和G11是豬最常見的G基因型,最常見的基因型組合為G9P[23]、G4P[6]和G9P[32];C群豬輪狀病毒有G1、G3、G5~G10基因型,而與之相組合的P基因型是由不同毒株間基因的親緣關系決定的[12,13]。為了評估豬輪狀病毒之間的遺傳差異,不少學者使用這種雙重遺傳分類方法,目前該方法已被廣泛接受并應用于基因型的鑒定,基于雙重分型系統,國內外已經發表了多篇基于雙重分型系統的豬基因型研究相關文獻。
4 豬輪狀病毒抗原蛋白的致病機理
豬輪狀病毒的病毒粒子表面有3種抗原蛋白:中和抗原、群抗原和血凝素抗原。中和抗原主要由第9節段編碼的外殼糖蛋白VP7所決定;群抗原與多種結構蛋白相關,主要是由第6節段編碼的內衣殼蛋白VP6所決定;血凝素抗原由第4節段編碼的外衣殼蛋白VP4所決定。感染早期,豬輪狀病毒經黏膜感染引起消化道病變,最嚴重的部位是小腸,病毒粒子主要集中在小腸絨毛頂部表面的成熟吸收上皮細胞中,導致小腸從上部到下部均發生病變。感染后期,該病毒破壞成熟的腸細胞,導致腸道吸收不良或發生滲透性腹瀉,在感染動物的血液和全身器官中可以檢測到病毒抗原、基因組RNA和感染性顆粒[14,15]。
4.1 抗原蛋白VP4致病機理 VP4蛋白具有血凝作用,能夠促進病毒入侵、融合細胞膜,與病毒粘附、侵入和血凝性相關,此外,VP4蛋白還決定病毒毒力,是病毒的主要識別因子之一,其可介導血清型特異性,在病原檢測和中和抗體產生以及免疫性保護過程中都具有重要意義[16,17]。病毒感染后,VP4蛋白與宿主細胞相互作用,參與受體結合和細胞滲透,VP4蛋白可被蛋白酶水解,被切割成C端VP5和N端VP8兩條長度不等的片段,裂解后增強了病毒的感染能力。酶解后的VP5在最初被靶細胞攝取后穿過包圍它的囊泡膜的脂質雙分子層,使細胞膜的滲透性增加,從而促進病毒進入細胞內;VP8含有能粘附唾液酸的部位,可將病毒附著在其細胞受體上,改變上皮細胞的分子結構和功能,對上皮細胞造成破壞,導致小腸絨毛長度變短、密度降低,來自腸隱窩的未成熟細胞代替成熟細胞,從而引起吸收障礙、消化不良和滲透性腹瀉[18,19]。
4.2 抗原蛋白VP6致病機理 結構蛋白VP6具有抗原特異性、免疫原性和轉錄活性,能夠參與病毒轉錄,并與其他蛋白發生相互作用,指導結構蛋白和非結構蛋白的合成,對于病毒感染細胞、病毒復制和發揮致病功能都十分重要。在病毒感染早期,VP6蛋白主動誘導黏膜免疫反應并產生免疫球蛋白A(Immunoglobulin A,IgA),聚合型IgA能夠使輪狀病毒從腸上皮細胞的基底外側膜經胞漿作用進入腸腔,并使產生IFN-γ的T細胞顯著增多,誘導多種促炎細胞因子和趨化因子的分泌[20]。
4.3 抗原蛋白VP7致病機理 糖蛋白VP7是病毒外衣殼中含量最高的蛋白,其高度保守,是病毒的主要識別因子,能夠誘導機體產生細胞免疫和體液免疫,并產生特異性抗體IgA和IgG[21,22]。VP7蛋白作為最外層的衣殼蛋白,可介導病毒粒子的吸附,并通過與細胞表面的整合素受體α2β1和α4β1結合,使豬輪狀病毒粘附并進入細胞[22]。VP7蛋白的結構是可維持鈣離子穩定的三聚體,因此能幫助VP4蛋白錨定在病毒粒子感染的細胞表面,通過鈣離子依賴性結合鈣離子,從而應對感染早期鈣離子的損失,具有穩定VP4蛋白結構和保障VP4蛋白發揮功能的作用[23,24]。
5 豬輪狀病毒抗原蛋白的免疫學特性
目前,臨床中尚無針對豬輪狀病毒的特效藥物,盡管接種疫苗是防控該病毒感染的主要方法,但仔豬因感染該病毒而引起的嚴重腹瀉仍未完全解決。豬輪狀病毒多經黏膜感染機體,所以口服免疫可能是較為理想的預防途徑。口服免疫可有效刺激黏膜免疫細胞產生分泌型免疫球蛋白A(Secretory immunoglobulin A,sIgA),并進一步引起全身免疫反應,由此一些學者便試圖從豬輪狀病毒抗原蛋白免疫學特性的相關研究中找到能有效控制該病的方法,研究內容見表1。

表1 豬輪狀病毒抗原蛋白的免疫學特性相關研究Table 1 Study on immunogenic characteristics of porcine rotavirus antigenic protein
6 小結
豬輪狀病毒病是生豬養殖過程中的一種常見疾病,尤其是由其導致的仔豬腹瀉頻繁暴發,給養豬場帶來巨大的經濟損失。VP4、VP6和VP7蛋白是豬輪狀病毒主要的抗原蛋白,也是導致腹瀉的重要毒力因子,最近有文獻報道除上述3種蛋白外,腸毒素NSP4蛋白也是該病毒的主要毒力因子之一,與該病毒引起的腹瀉密切相關[34],雖然尚沒有研究顯示NSP4屬于豬輪狀病毒的抗原蛋白,但該蛋白在病毒粒子的裝配和感染過程中也起到了重要作用,且對與其共免疫的抗原具有增強免疫原性的佐劑作用,可作為重要的抗原免疫刺激劑[35,36]。豬輪狀病毒抗原蛋白相關特性的深入研究對亞單位疫苗的研制至關重要,其應用前景十分廣闊,尤其在無特效治療藥物和理想疫苗的情況下,對豬群腹瀉的防治和人類公共衛生的提升均具有重要意義,有望使豬輪狀病毒病得到有效的防控。

