雞源大腸桿菌噬菌體LHE71的生物學特性和全基因組序列分析
榮家慶,任慧英,劉文華,張 燦
(青島農業大學動物醫學院,山東 青島 266109)
大腸桿菌(Escherichiacoli,E.coli)是臨床上最常見的條件致病菌,也是近年來流行病學領域的重點研究對象,通常引起多種動物發生大腸桿菌病,多以幼齡畜禽高發,嚴重危害養殖業健康,每年由該病造成的經濟損失數以億計[1]。抗生素類藥物曾是畜禽養殖過程中治療大腸桿菌病的首選,然而隨著抗生素的長期廣泛使用,耐藥性大腸桿菌迅速出現并蔓延,臨床上已有大量多重耐藥和廣泛耐藥菌株報道[2,3]。抗生素耐藥性的全球性傳播已成為威脅人畜健康的社會公共安全問題,亟需尋找新型抑菌制劑防控耐藥菌的傳播和感染[4]。噬菌體作為細菌的天敵,在自然界中廣泛存在,可特異性侵入并破壞宿主細菌,且不對動物本身造成損害,具有替代抗生素治療細菌病的潛力。早在19世紀初期,噬菌體即應用于臨床細菌病的防治,后因發現抗生素治療細菌病效果卓越,噬菌體研究被擱置,幾十年間僅在格魯吉亞等少數國家以噬菌體雞尾酒制劑方式應用于臨床,如今噬菌體重新成為世界關注的熱點[5]。在臨床生產中通常選擇裂解譜寬、效價高、裂解能力強、無毒力基因的烈性噬菌體進行噬菌體雞尾酒的配制[6]。
本試驗以96株大腸桿菌為宿主菌,從雞場糞樣中分離得到1株長尾噬菌體,命名為LHE71,并對其生物學特性和全基因組進行分析,以期為后續噬菌體制劑的開發和應用提供參考數據。
1 材料與方法
1.1 材料
1.1.1 菌種和樣品 96株大腸桿菌臨床分離株由本實驗室保存;5份糞便樣品,采集自山東省臨沂市某雞場。
1.1.2 主要試劑 磷鎢酸(Phosphotungstic acid,PTA)和SM緩沖液,均購自北京雷根生物技術有限公司;LB培養基和普通營養瓊脂等,均購自青島海博生物技術有限公司。
1.1.3 主要儀器 超凈臺(SW-CJ-2F型),蘇凈集團安泰公司產品;電熱恒溫培養箱(HH·B11·360-s型),上海躍進醫療器械廠產品;電熱恒溫水浴鍋(HH·SYZ1-N型)和六聯電子調溫電爐,龍口市先科儀器公司產品;臺式離心機(TDL80-2B型),上海安亭科學儀器廠產品;可調式微量移液器,大龍興創實驗儀器(北京)股份公司產品;透射電子顯微鏡(HT7700 TEM),日力高新技術公司產品。
1.2 方法
1.2.1 噬菌體的分離和純化 以96株大腸桿菌臨床分離株為宿主菌,使用糞便樣品進行噬菌體的分離。取10 g糞樣放入燒杯中,加入100 mL LB培養液放入37 ℃恒溫培養箱培養6 h,加入96株大腸桿菌的混合菌液5 mL,于37 ℃恒溫培養箱培養過夜,4 000 r/min離心30 min,取上清液,用0.22 μm無菌濾器抽濾,濾液置于4 ℃保存備用。
利用雙層平板法[7]進行噬菌體的分離和純化。取100 μL濾液分別與等體積的 96株大腸桿菌菌液于上層培養基中混勻,倒于普通瓊脂平板上,凝固后在37 ℃條件下倒置培養3~4 h,觀察并記錄各菌株平板上的噬斑。摳取單個噬斑于離心管中,用1 mL生理鹽水浸出,于37 ℃孵育30 min,12 000 r/min離心5 min,取上清,用0.22 μm無菌濾器抽濾,將濾液稀釋至適宜濃度梯度,取50 μL分離出噬菌體對應的大腸桿菌菌液 (109CFU/mL)與等體積的濾液混勻,雙層平板法純化噬菌體。按上述方法將噬菌體純化3代以上,得到噬斑形態單一的純化噬菌體,-80 ℃凍存于30%甘油中待用。
1.2.2 噬菌體裂解譜測定 用雙層平板法[7]測定噬菌體的裂解譜。取100 μL 純化噬菌體增殖液(103PFU/mL)分別與96株大腸桿菌菌液以及E.coliK12菌液混合于上層培養基中,倒于普通瓊脂平板上,倒置于37 ℃恒溫培養箱中培養4 h,觀察并記錄結果。
1.2.3 噬菌體形態觀察 取20 μL純化噬菌體增殖液(5.0×1014PFU/mL)滴于銅網上靜置15 min,用濾紙吸去多余的液體。銅網上滴加5 μL 2% PTA,染色5 min,用濾紙吸去多余的染液,自然晾干后,用透射電子顯微鏡觀察噬菌體形態特征。
1.2.4 最佳感染復數(Multiplicity of infection,MOI)測定 取純化噬菌體增殖液進行10倍倍比稀釋,與對應宿主菌菌液(1.0×109CFU/mL)按照MOI為0.01、0.1、1、10、100和1 000混勻,加入5 mL LB培養基,37 ℃振蕩培養4 h,12 000 r/min離心20 min,0.22 μm無菌濾器抽濾,獲得噬菌體增殖液,雙層平板法[7]測定噬菌體效價,每個MOI設3個平行,最高效價的噬菌體對應的MOI即為最佳MOI。
1.2.5 熱穩定性測定 取500 μL純化噬菌體增殖液(1.0×1015PFU/mL)分別置于40、50、60、70和80 ℃水浴1 h,于20、40和60 min各取樣200 μL,用雙層平板法[7]測定噬菌體效價,每個溫度設3個平行。以時間為橫坐標,噬菌體效價為縱坐標,繪制噬菌體的熱穩定性曲線。
1.2.6 紫外線穩定性測定 取4 mL純化噬菌體增殖液(1.0×1015PFU/mL)置于平皿中,將其置于距紫外燈(功率:30 W)40 cm處持續照射。每10 min取200 μL噬菌體增殖液,用雙層平板法[7]測定噬菌體效價,連續測定60 min,每個時間點設3個平行。以時間為橫坐標,噬菌體效價為縱坐標,繪制噬菌體紫外線穩定性曲線。
1.2.7 一步生長曲線測定 取純化噬菌體增殖液(3.0×108PFU/mL)和對應宿主菌菌液(3×109CFU/mL)各200 μL,充分混勻,37 ℃孵育5 min,加至7 mL LB肉湯中,置于37 ℃振蕩培養箱培養。分別于不同時間點(從0 min開始,前1 h每隔10 min,1 ~3 h每隔20 min,3 h后每隔30 min)取200 μL增殖液,13 000 r/min離心1 min,取上清,雙層平板法[7]測噬菌體效價,每個時間點設3個平行。以時間為橫坐標,噬菌體效價為縱坐標,繪制一步生長曲線,確定噬菌體的潛伏期、爆發期和爆發量。
1.2.8 pH穩定性測定 取純化噬菌體增殖液(1.0×1012PFU/mL)分別加入不同pH(3~12)的LB肉湯,37 ℃水浴條件下孵育,分別于1、2 和3 h取樣,雙層平板法[7]測定噬菌體效價,每個時間點設3個平行。以時間為橫坐標,噬菌體效價為縱坐標,繪制噬菌體pH穩定性曲線。
1.2.9 噬菌體全基因組測序和分析 將噬菌體增殖液送至深圳市惠通生物科技有限公司,使用Illumina 測序平臺進行全基因組測序,用SPAdes軟件進行序列拼接,對獲得的數據使用RAST平臺(https://rast.nmpdr.org/)進行注釋,獲得噬菌體的全基因組注釋信息,使用DNASTAR軟件分析(G+C)%含量,并將全基因組序列提交到GenBank數據庫中進行BLAST同源比對,使用在線工具tRNAscan-SE(http://lowelab.ucsc.edu/tRNAscan-SE/)對噬菌體進行tRNA預測;使用在線數據庫CGE Server(https://cge.cbs.dtu.dk/services/MLST/)預測噬菌體基因組中攜帶的毒力基因和耐藥基因;使用在線工具Phyre 2(http://www.sbg.bio.ic.ac.uk/phyre2)預測噬菌體基因組中解聚酶基因。根據以上基因組分析結果,使用SnapGene軟件繪制噬菌體的全基因組框架圖。
1.2.10 噬菌體進化樹分析和共線性分析 選取噬菌體的末端酶大亞基和衣殼蛋白,在MEGA軟件中用鄰接法(Neighbor-joining method)選擇默認參數構建進化樹。噬菌體全基因組序列提交到GenBank數據庫進行同源性比對,選擇與噬菌體同源性較高的5個噬菌體,使用Mauve軟件進行共線性分析。
2 結果
2.1 噬菌體的分離、純化和裂解譜測定 利用雙層平板法從雞場糞樣中分離到1株大腸桿菌噬菌體,命名為LHE71。雙層平板法測定噬菌體LHE71的裂解譜,可裂解17株大腸桿菌分離株,裂解率為17.7%(17/96),結果見表1。噬菌體LHE71能夠裂解大腸桿菌參考株E.coliK12,因此,以E.coliK12為宿主菌進行后續試驗。
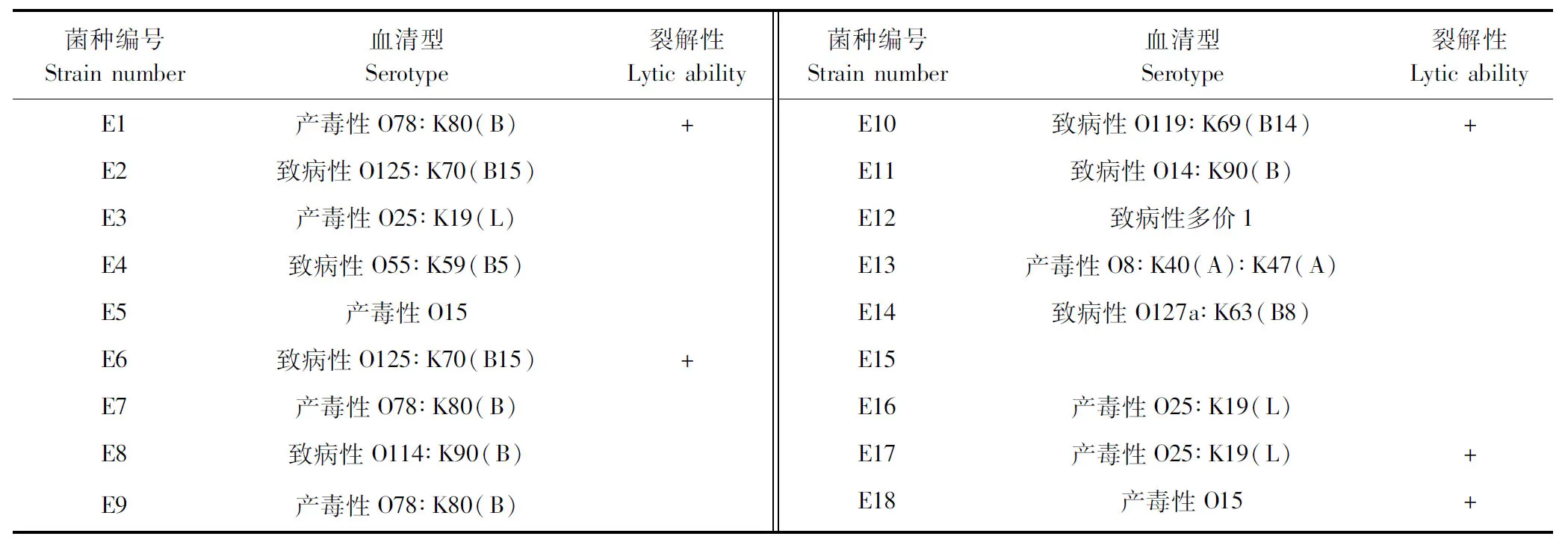
表1 噬菌體LHE71的裂解譜范圍Table 1 Lytic spectrum range of phage LHE71
2.2 噬菌體形態觀察 大腸桿菌噬菌體LHE71經3次純化,形成清澈透亮、邊緣整齊帶暈環的噬斑(圖1A),暈環隨培養時間的延長逐漸擴大,最終暈環直徑可達4~5 mm(圖1B)。對大腸桿菌噬菌體LHE71進行透射電鏡形態觀察,可見噬菌體LHE71由明顯的正二十面體頭部和不可伸縮的彎曲尾部構成,頭部直徑約70 nm,尾部長約150 nm (圖2)。
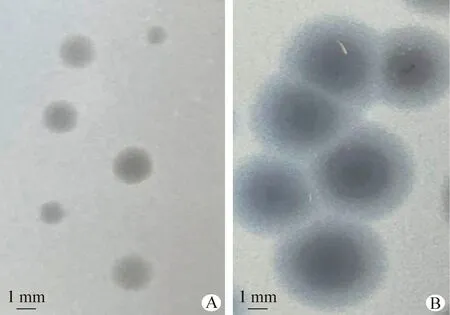
圖1 噬菌體LHE71的噬斑形態觀察Fig.1 Plaque morphology observation of phage LHE71A:噬菌體孵育4 h; B:噬菌體孵育12 hA:Phage incubation for 4 h; B:Phage incubation for 12 h
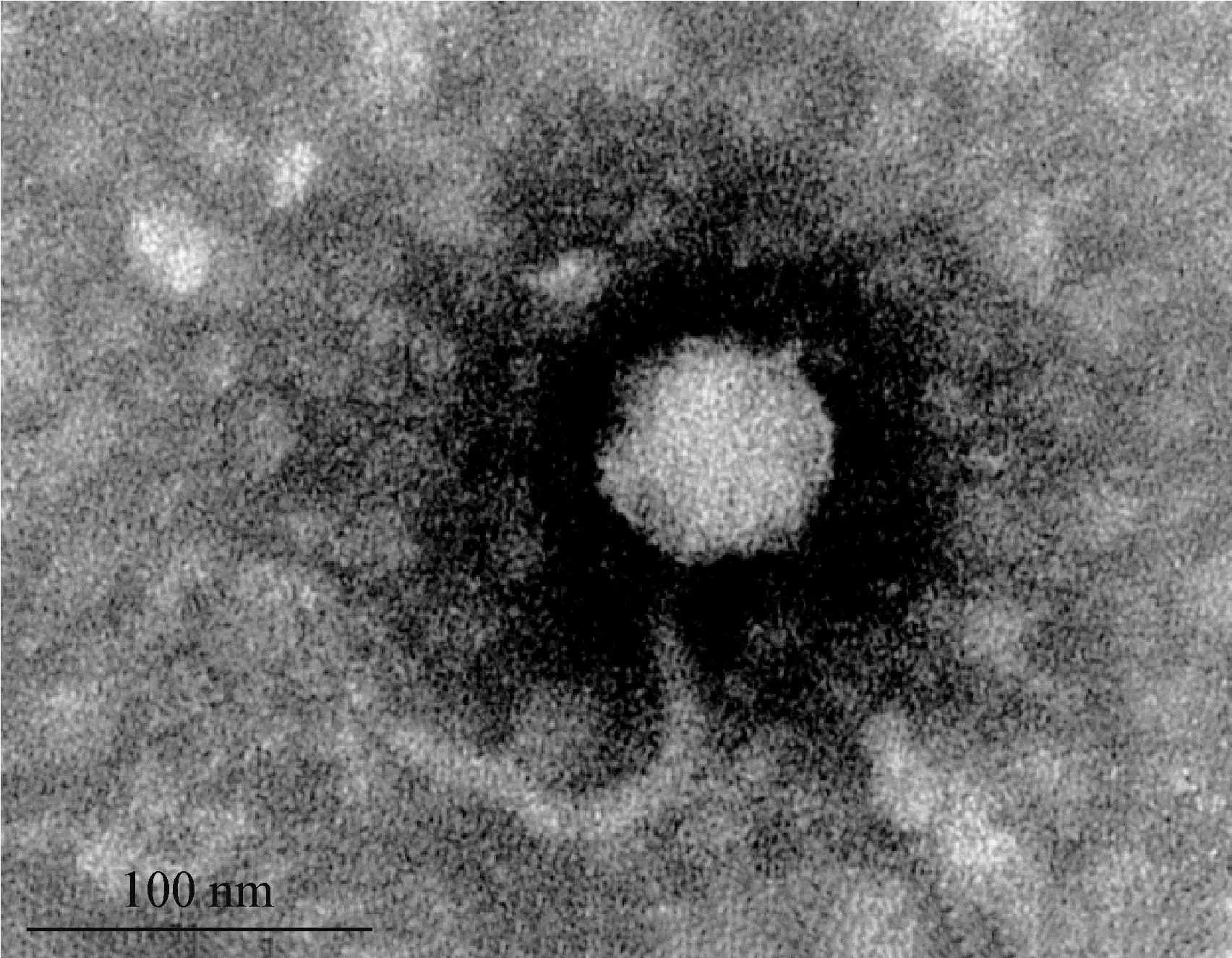
圖2 噬菌體LHE71在透射電鏡下的形態Fig.2 Morphology of phage LHE71 under transmission electron microscope
2.3 最佳MOI測定 分別將噬菌體LHE71與宿主菌E.coliK12按不同MOI混合培養,雙層平板法測定噬菌體最佳MOI,結果如表2所示,當MOI為0.1時,噬菌體LHE71的效價最高,達到2.6×1015PFU/mL。
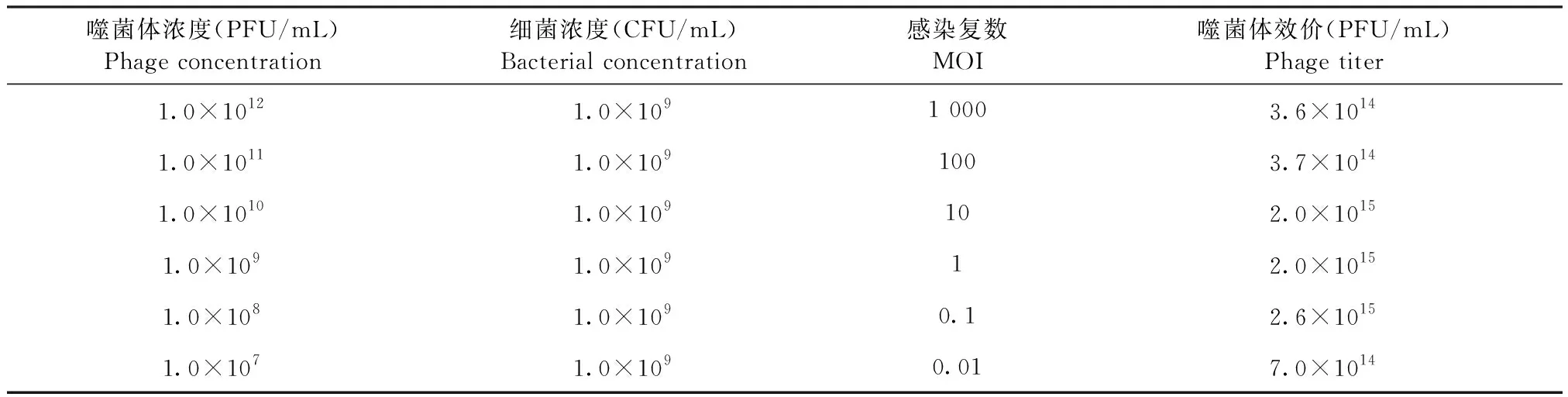
表2 噬菌體LHE71最佳感染復數(MOI)Table 2 Optimal MOI of phage LHE71
2.4 熱穩定性測定 用雙層平板法測定噬菌體在不同溫度條件下的穩定性,結果如圖3所示,噬菌體LHE 71在40和50 ℃條件下,效價保持穩定;當溫度為60 ℃時,噬菌體LHE71效價在20 min內未見明顯下降,60 min時噬菌體效價下降3個數量級;當溫度為70 ℃時,噬菌體LHE71效價在20 min時顯著下降至103PFU/mL;當溫度為80 ℃時,噬菌體效價迅速下降,40 min時全部失活。
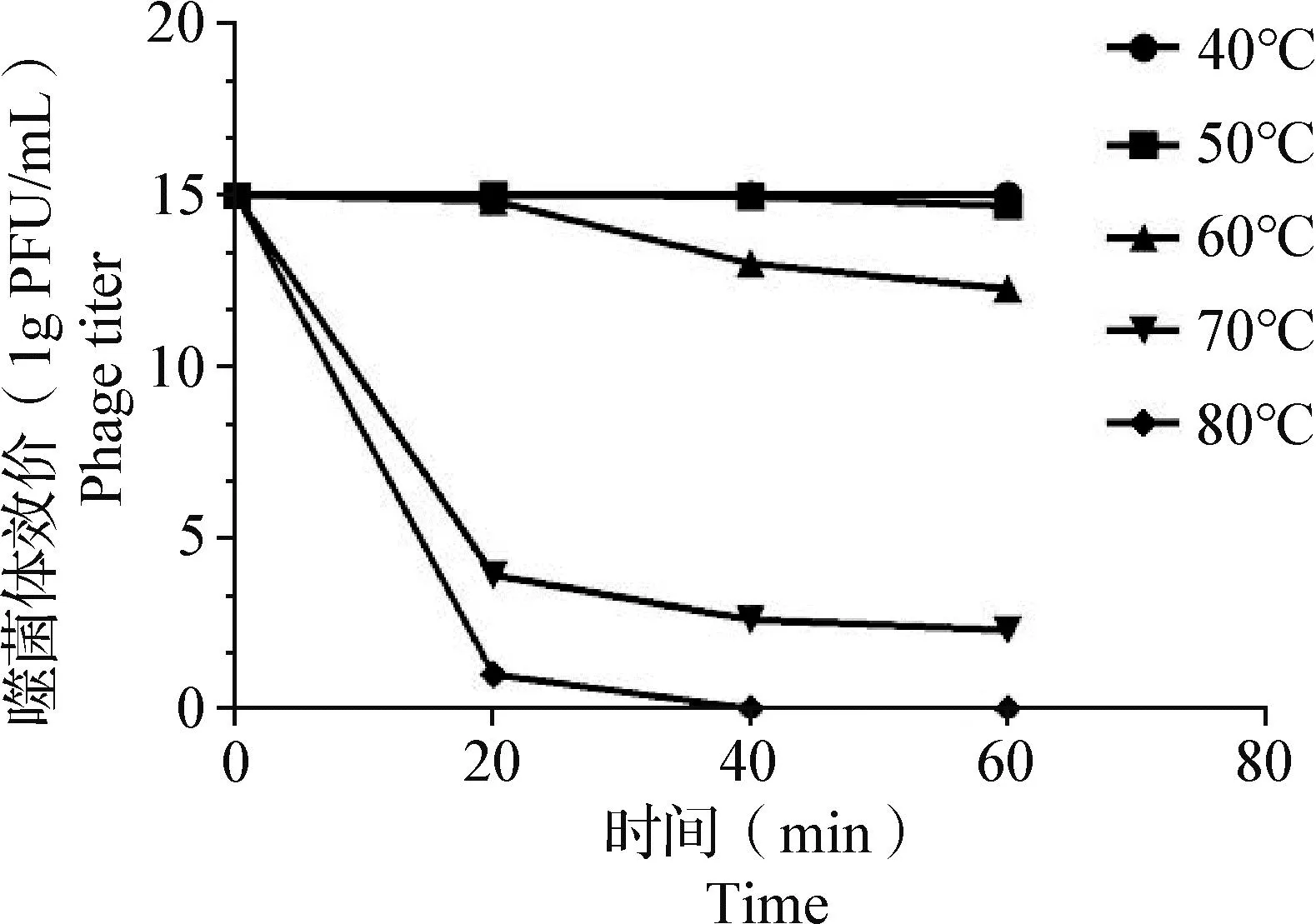
圖3 噬菌體LHE71熱穩定性Fig.3 Thermal stability of phage LHE71
2.5 紫外線穩定性測定 噬菌體LHE71紫外線穩定性結果如圖4所示,噬菌體LHE71隨紫外線照射時間延長,效價逐漸下降;紫外線連續照射40 min時,噬菌體LHE71效價下降約7個數量級;紫外線連續照射60 min時,噬菌體LHE71效價降低至107PFU/mL。
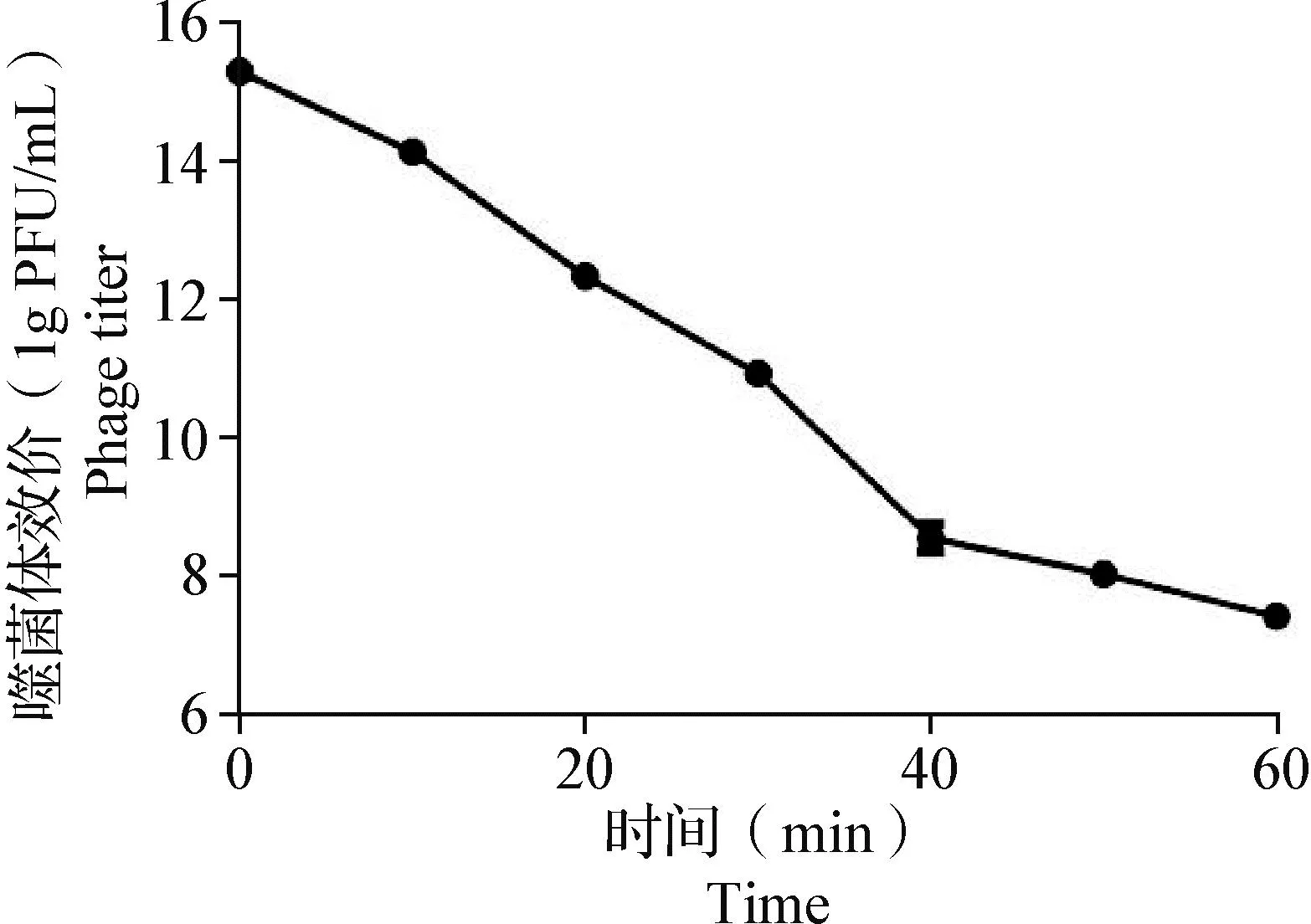
圖4 噬菌體LHE71紫外線穩定性Fig.4 UV stability of phage LHE71
2.6 一步生長曲線測定 以E.coliK12為宿主菌,測定MOI為0.1時噬菌體LHE71的一步生長曲線,結果如圖5所示,噬菌體LHE71的潛伏期約為40 min,爆發期約為110 min,150 min后進入平臺期,爆發量為104PFU/cell。
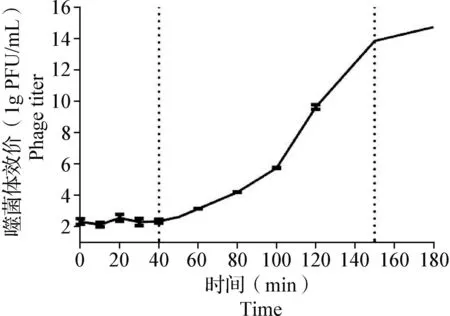
圖5 噬菌體LHE71的一步生長曲線Fig.5 One-step growth curve of phage LHE71
2.7 pH穩定性測定 噬菌體LHE71 pH穩定性如圖6所示,噬菌體LHE71在pH 7~9范圍內相對穩定;當pH<7或pH>9時,噬菌體效價隨時間延長而迅速下降;當pH≤4或pH≥11時,噬菌體在1 h內完全失活。
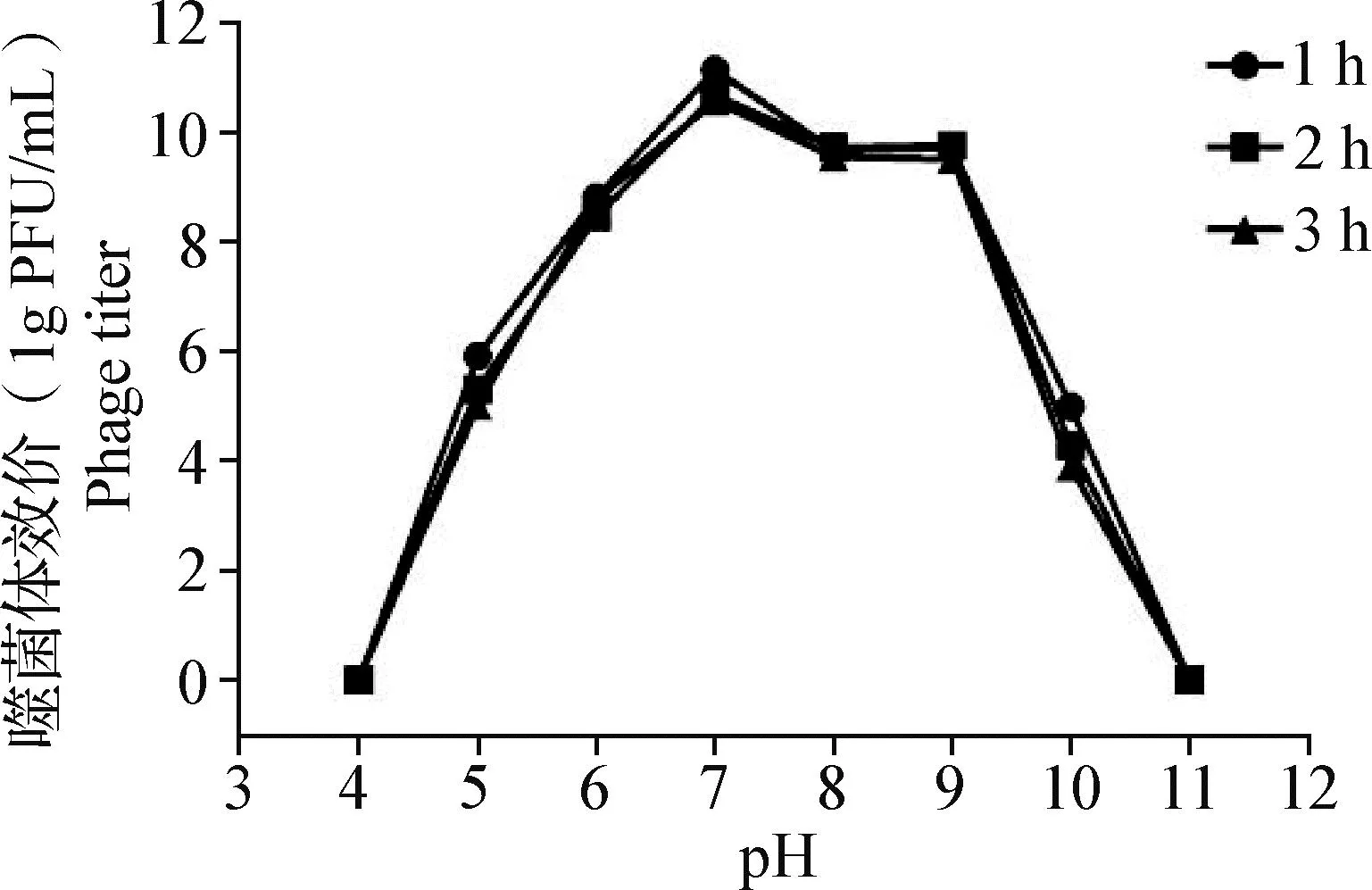
圖6 噬菌體LHE71的pH穩定性Fig.6 pH stability of phage LHE71
2.8 噬菌體全基因組組成分析 噬菌體LHE71全基因組序列全長為50 158 bp,(G+C)%含量為45.11%。LHE71基因組中未發現tRNA,不攜帶耐藥基因和毒力基因。同源性比對結果顯示,在GenBank中共有32株噬菌體與LHE71具有同源性,其中志賀氏菌噬菌體Sfin-3與噬菌體LHE71同源性最高,覆蓋率為91%,相似性為92.41%。根據 Turner等[8]報道,確定噬菌體LHE71為一新種。
2.9 噬菌體LHE71功能注釋和開放閱讀框分析 用RAST在線平臺對噬菌體LHE71進行全基因組注釋,結果如圖7所示,噬菌體LHE71基因組共注釋81個開放閱讀框 (Open reading frame,ORF),其中僅18個為正向轉錄,其余均為反向轉錄。噬菌體LHE71全基因組呈現典型的模塊化特征,共有24個orf基因注釋為已知功能的基因,無tRNA,不含毒力基因和耐藥基因。全基因組按照功能可劃分為3個區域:(1)結構蛋白部分集中在基因組下游,主要和翻譯后期組裝成完整的噬菌體結構相關,包括orf51、orf60、orf61、orf62、orf63、orf64、orf65、orf68、orf74、orf77、orf78、orf79、orf80和orf81;(2)DNA復制和代謝部分,該部分主要負責利用細菌基因組進行自身復制和組裝,主要集中在全基因組中游,包括orf9、orf47、orf49、orf50、orf52、orf55和orf56;(3)裂解系統,包括裂解酶(orf40)和穿孔素(orf41)。其余orf基因均為編碼未知功能蛋白的基因。經Phyre 2在線平臺分析結果顯示,orf53編碼的蛋白和編號為C5EW5C的蛋白有較高的同源性(98%),預測與噬菌體形成暈環相關。
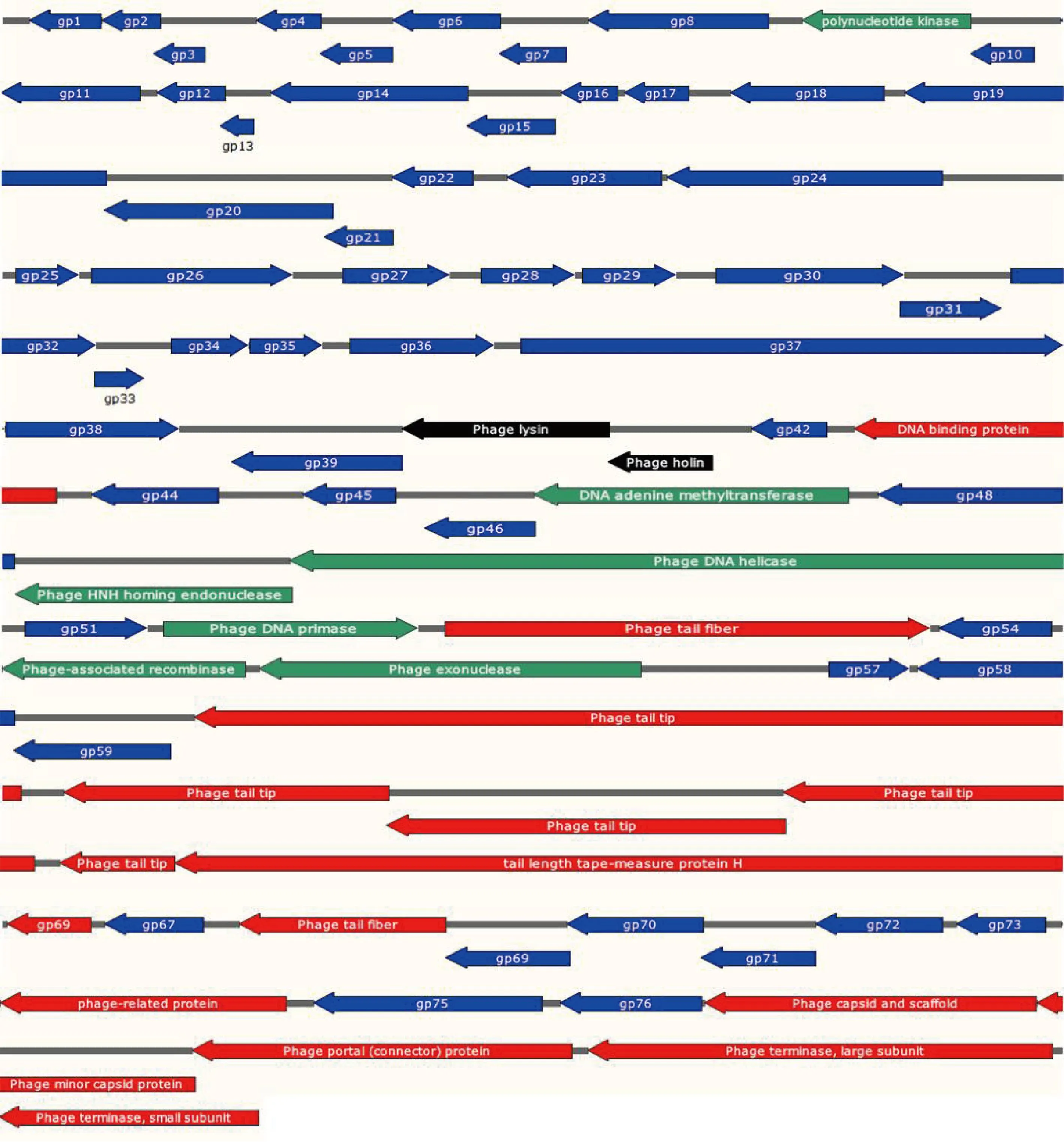
圖7 噬菌體LHE71的全基因組框架圖Fig.7 Whole genome frame diagram of phage LHE71箭頭:轉錄方向; 不同顏色:不同功能的蛋白,其中結構蛋白為紅色,裂解系統蛋白為黑色,復制轉錄相關蛋白為綠色,假設蛋白為藍色Arrow:Transcription direction; Different colors:Proteins with different functions,the structural proteins are red,the lysis system proteins are black,the replication-transcription-related proteins are green,and the hypothetical proteins are blue
2.10 噬菌體LHE71進化樹分析和共線性分析 選取噬菌體LHE71的末端酶大亞基和衣殼蛋白基因序列,與其他同源性較高的噬菌體構建系統發育進化樹,結果如圖8所示,噬菌體LHE71分別與噬菌體phi2013和pSf-2親緣關系最近,且2株噬菌體均為同一屬成員,根據Turner等[8]報道,可以確定噬菌體LHE71為Drexlerviridae科Tunavirus屬的新成員。
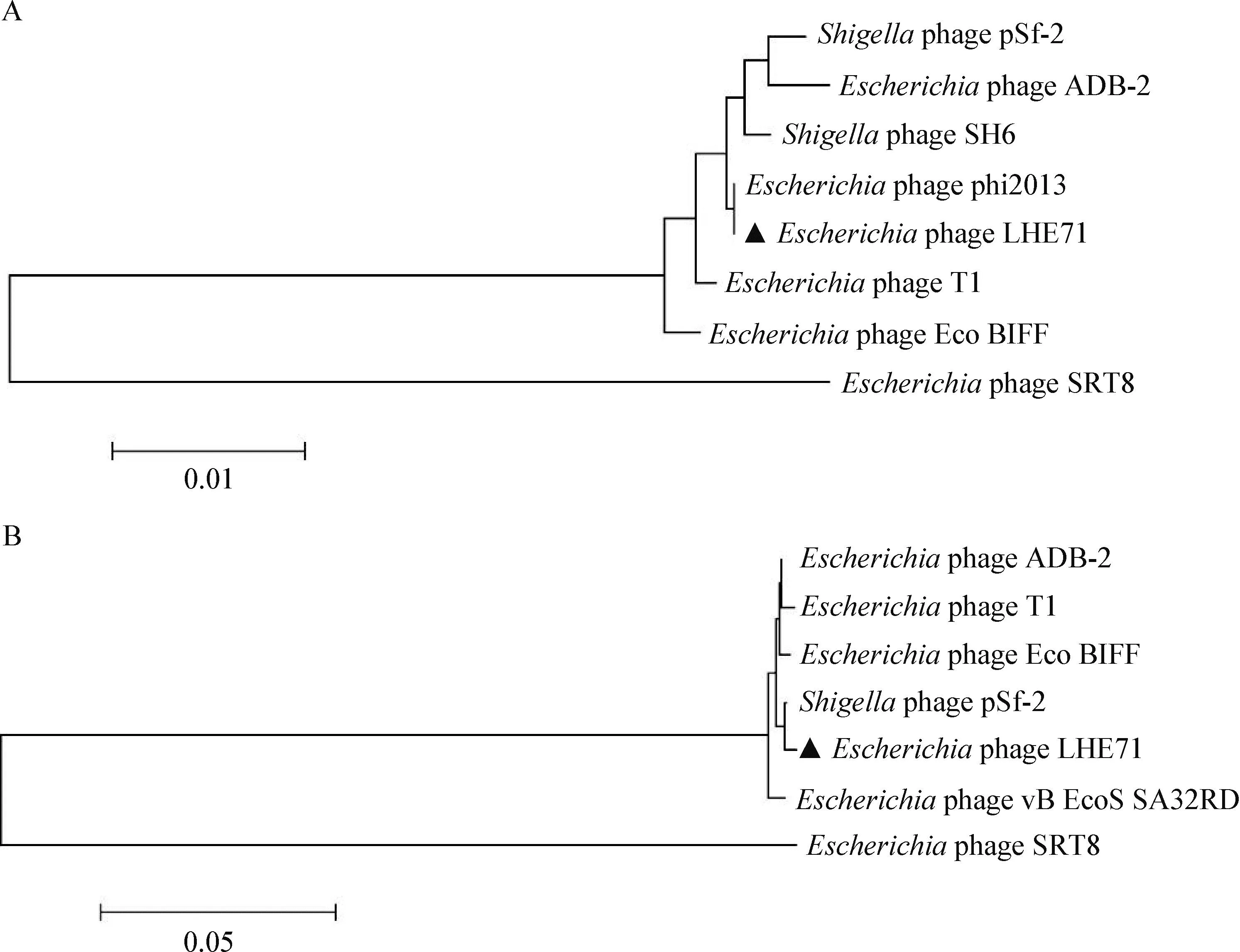
圖8 噬菌體LHE71系統發育關系分析Fig.8 Phylogenetic analysis of phage LHE71A:末端酶大亞基進化樹; B:衣殼蛋白進化樹A:Phylogenetic tree of terminase large subunits; B:Phylogenetic tree of capsid proteins
選取與噬菌體LHE71同源性較高的5個噬菌體進行基因組共線性分析,結果見圖9所示,噬菌體LHE71與噬菌體MA9V-1基因組排序一致,與其余4株噬菌體的基因組比較,在9 500~50 000 bp區域出現了大片段的重排,其中6 100~7 500 bp區域無同源性,在GenBank數據庫中也無同源序列,為噬菌體LHE71獨有序列。

圖9 噬菌體LHE71共線性分析Fig.9 Collinearity analysis of phage LHE71
3 討論
近40年來,新型抗生素研發工作近乎停滯,世界衛生組織于2017年宣布全球抗生素瀕臨枯絕,細菌耐藥性將成為威脅健康的最大問題之一,抗生素替代品研發成為全球關注的熱點[9]。噬菌體能夠特異性裂解宿主菌,其裂解細菌的作用機制與抗生素完全不同,因而不受細菌耐藥性的限制,近年來已有大量噬菌體成功應用于臨床的報道,噬菌體展現出良好的應用前景[10]。在格魯吉亞的Eliava噬菌體治療中心和位于波蘭Wroclaw市的噬菌體治療中心,噬菌體雞尾酒療法已被成功應用上百年[11]。本試驗從雞場糞樣中分離到1株大腸桿菌噬菌體,命名為LHE71,并對其生物學特性和全基因組開展了研究。
噬菌體具有嚴格的宿主特異性,這既是噬菌體治療的優點,同時在一定程度上也限制了噬菌體的臨床應用。生產上通常將多種具有不同裂菌譜的噬菌體混合制成噬菌體雞尾酒,以解決噬菌體裂解譜普遍較窄的問題。因此,噬菌體雞尾酒制劑通常選擇宿主譜寬、裂解能力強且無毒力基因的噬菌體,使制劑具有廣譜的裂菌活性特征。本試驗中分離到的烈性噬菌體LHE71基因組中不含毒力基因和耐藥基因,可特異性裂解多種血清型的大腸桿菌,并且對多種理化因子耐受性強,表現出良好的應用潛力。
細菌生物膜是導致細菌耐藥性增強的原因之一。與游離生長的細菌相比,生物膜中細菌的抗生素耐藥性增加了1 000~5 000倍,這給細菌感染的臨床治療帶來了極大困難。研究發現,噬菌體編碼的解聚酶可以有效抑制細菌生物膜的形成,對已形成的細菌生物膜也有很強的裂解效果,有望成為應對細菌感染的新型工具[12]。解聚酶最直觀的表現是能夠在噬斑周圍產生暈環,暈環的大小反應解聚酶的活性。本試驗中分離到的大腸桿菌噬菌體LHE71可在雙層瓊脂平板上長出大小均勻、邊緣整齊且帶有暈環的噬斑,且暈環隨培養時間的延長而逐漸擴大,有典型的解聚酶特征;基因組分析發現,LHE71orf53基因編碼具有解聚酶特征的肽段,值得進一步研究。
噬菌體的增殖性能與噬菌體制劑的生產成本息息相關。噬菌體LHE71在MOI為0.1時,效價高達2.6×1015PFU/mL,爆發量達104PFU/cell,表明該噬菌體具有優異的增殖性能。通常情況下,噬菌體效價和爆發量大小與宿主細胞的潛伏期和蛋白質合成機制有關[13]。宿主細胞越大,噬菌體潛伏期越長,往往爆發量越高[14]。例如,噬菌體SA的潛伏期為30 min,爆發量為103PFU/cell[15];噬菌體MS2潛伏期為45 min,爆發量為2×103PFU/cell[16];1株以禽致病性大腸桿菌(Avian pathogenicEscherichiacoli,APEC)為宿主菌的噬菌體潛伏期為24 h,爆發量高達2.4×104PFU/cell[17]。本試驗生長曲線結果顯示,噬菌體LHE71潛伏期長,爆發量高,用于生產可極大節約生產成本,有開發為噬菌體制劑的價值。
綜上所述,本試驗分離并鑒定了1株烈性大腸桿菌噬菌體LHE71,不含毒力基因和耐藥基因,對多種理化因子具有良好的耐受性,并且具有解聚酶活性,增殖性能高,具有良好的應用價值,可進一步開發為噬菌體制劑用于防控臨床耐藥性大腸桿菌感染。

