替米考星對胞內金黃色葡萄球菌的抗菌活性
鞠牧潔,劉金環,蔣永濤,冷楠楠,羅萬和
(1.新疆生產建設兵團塔里木畜牧科技重點實驗室,新疆 阿拉爾 843300 ; 2.塔里木大學動物科學與技術學院,新疆 阿拉爾 843300)
金黃色葡萄球菌(Staphylococcusaureus,S.aureus)嚴重危害奶牛健康養殖[1]。金黃色葡萄球菌作為一種常見的兼性胞內菌,具有多種免疫逃避機制,可在宿主細胞內持續存活,使得宿主免疫系統和抗生素難以將其完全清除,進而引起胞內細菌感染[2,3]。Siwczak等[4]研究發現,金黃色葡萄球菌能以小菌落變異體(Small colony variant,SCV)形式靶向感染M2型巨噬細胞,并在胞內持續增殖,這與慢性和隱性奶牛乳腺炎的反復感染密切相關。
由于宿主細胞對胞內金黃色葡萄球菌具有一定的保護作用,導致常規藥物難以滲透到胞內金黃色葡萄球菌的感染部位,難以達到有效的治療濃度和時間[5,6]。例如,氨基糖苷類藥物有較強的極性,被攝入細胞內的藥物達不到有效殺菌濃度,最終導致金黃色葡萄球菌產生耐藥性[7,8];四環素類藥物膜滲透率較低,且金黃色葡萄球菌的細胞膜對四環素類藥物有主動外排作用,難以殺滅細菌[9];β-內酰胺類藥物一直是治療革蘭陽性菌的首選抗生素,但由于其不合理使用導致越來越多的細菌對其產生嚴重的耐藥性[10]。大環內酯類藥物具有較強的膜滲透性,其中替米考星是一種半合成的大環內酯類抗生素,對多種革蘭陽性菌和部分革蘭陰性菌、支原體和螺旋體等均具有良好的抗菌活性[11,12]。由胞內金黃色葡萄球菌引起的奶牛乳腺炎的典型特征是持續性和反復性感染,因此對于奶牛乳腺炎的治療應首選長效制劑。而替米考星具有良好的抗生素后效應,其半衰期長,生物利用度高,且口服給藥后靶部位藥物濃度高于血漿藥物濃度[13,14]。研究發現,替米考星對金黃色葡萄球菌的最小抑菌濃度(Minimum inhibitory concentration,MIC)為 2 μg/mL,推測替米考星對胞內金黃色葡萄球菌同樣具有較強的抗菌活性[15]。
本試驗以金黃色葡萄球菌ATCC 29213為靶細菌,以小鼠單核巨噬細胞(RAW264.7)為載體細胞,在構建金黃色葡萄球菌感染細胞體系的基礎上,測定胞內金黃色葡萄球菌生長曲線、MIC、最低殺菌濃度(Minimum bactericidal concentration,MBC)、防突變濃度(Mutant prevention concentration,MPC)、耐藥突變選擇窗(Mutant selection window,MSW)、抗菌后效應(Post-antibiotic effect,PAE)和殺菌曲線,旨在探究替米考星對胞內金黃色葡萄球菌的抗菌活性,為防治胞內金黃色葡萄球菌感染提供參考資料。
1 材料與方法
1.1 試驗材料
1.1.1 藥品和試劑 替米考星溶液,購自山東雨澤銀豐動物藥業有限公司,批號:20201101;Dulbecco's Modified Eagle Medium(DMEM)培養基、四甲基偶氮唑藍(Methyl thiazolyl tetrazolium,MTT)、二甲基亞砜(Dimethyl sulfoxide,DMSO)和磷酸鹽緩沖液,均購自武漢默瑞斯生物科技有限公司;胰蛋白酶大豆肉湯(Tryptic soytone broth,TSB)培養基和甘露醇鹽瓊脂(Mannitol salt aga,MSA)培養基,均購自鼎源生物技術有限公司。
1.1.2 主要儀器 二氧化碳培養箱,長沙長錦科技有限公司產品;PCR儀,山東恒美電子科技有限公司產品;Micro Screen高通量實時微生物生長儀,廣州湘喜生物科技有限公司產品;酶聯免疫檢測儀,北京凱奧科技有限公司產品。
1.1.3 試驗菌株 金黃色葡萄球菌標準菌株(ATCC 29213),由塔里木大學動物科學與技術學院提供。
1.2 金黃色葡萄球菌的培養 將復蘇的金黃色葡萄球菌加入TSB培養基中,培養18~24 h。復蘇后的金黃色葡萄球菌傳代培養3次以上。
1.3 RAW264.7細胞的培養 將RAW264.7細胞復蘇后,加入DMEM培養基,培養24 h后傳代。
1.4 金黃色葡萄球菌感染細胞體系的構建 向鋪有RAW264.7細胞的24孔板中加入金黃色葡萄球菌(1×107CFU/mL)(模型組)或者DMEM培養基(對照組),培養1 h后加入0.5 mL慶大霉素(100 μg/mL),共同孵育30 min以殺滅細胞外的金黃色葡萄球菌,因慶大霉素無法透過生物膜屏障,所以對胞內菌株無殺滅作用 [慶大霉素對金黃色葡萄球菌的90%最低抑菌濃度(90% minimum inhibitory concentration,MIC90)為1 μg/mL][16,17]。使用PBS沖洗殘留的慶大霉素后,用細胞裂解液裂解被感染的細胞,并涂布于MSA平板。若金黃色葡萄球菌生長良好,則可初步判斷金黃色葡萄球菌感染細胞體系構建成功。通過PCR方法進一步驗證金黃色葡萄球菌感染細胞體系是否構建成功。PCR引物序列(nuc基因)見表1,由生工生物工程(上海)股份有限公司合成。PCR擴增反應體系(50 μL)和程序參照參考文獻[18],分別以滅菌去離子水和金黃色葡萄球菌ATCC 29213為陰性和陽性對照。
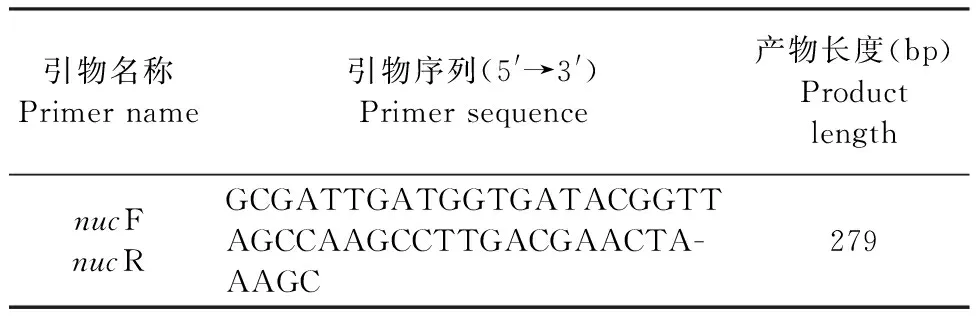
表1 PCR引物信息Table 1 PCR primer information
1.5 胞內金黃色葡萄球菌在RAW264.7細胞中生長曲線的測定 將構建好的感染細胞體系置于培養箱中,分別在培養0、0.5、1、2、3、4、6、8、12、18、24和48 h時,吸棄細胞培養液,用PBS清洗3次。加入細胞裂解液,以釋放出胞內細菌。使用Micro Screen高通量實時微生物生長儀測定金黃色葡萄球菌的濃度,以菌液濃度與培養時間的關系繪制金黃色葡萄球菌在RAW264.7細胞中的生長曲線。
1.6 替米考星對RAW264.7細胞活力的影響 將200 μL RAW264.7細胞懸液(細胞濃度為1×104個/mL)接種于96孔培養板中培養24 h,每孔加入含有128、64、32和16 μg/mL替米考星的DMEM基礎培養液,同時設置空白組(僅有DMEM培養基)和對照組(僅有細胞和DMEM培養基)。培養6、12和24 h后,使用酶聯免疫檢測儀于490 nm處測定吸光度(Optical density,OD)值,進而計算細胞存活率[16]。
1.7 替米考星對胞內金黃色葡萄球菌MIC和MBC的測定 在感染細胞體系中分別加入倍比稀釋的替米考星溶液(濃度為128、64、32、16、8、4、2、1、0.5、0.25、0.125和0.062 5 μg/mL),并設陰性對照(只有細胞)和陽性對照(只有細菌和細胞)。培養18~24 h后,經細胞裂解液釋放出胞內細菌,并使用Micro Screen高通量實時微生物生長儀測定細菌濃度。
1.8 替米考星對胞內金黃色葡萄球菌MPC的測定 將感染細胞體系置于培養箱培養,待細菌濃度達1×107CFU/mL后,離心,重懸,調節細菌濃度約為1×109CFU/mL。加入含有不同濃度替米考星(4、2、1、1/2和0×MIC)的細胞培養基,置于培養箱中培養18~24 h后,初始防突變濃度(Initial mutation prevention concentration,MPCpr)為無菌落生長的最低藥物濃度。以MPCpr為基礎,按20% MPCpr重復以上步驟,得到最終MPC和MSW(MSW=MIC-MPC)。
1.9 替米考星對胞內金黃色葡萄球菌PAE的測定 在感染細胞體系中分別加入不同濃度替米考星(4、2和1×MIC),使用Micro Screen高通量實時微生物生長儀測定不同時間點(0、1和2 h)的細菌濃度,計算PAE[14]。
1.10 殺菌曲線的繪制 在感染細胞體系中分別加入不同濃度替米考星(4、2、1、1/2和0×MIC),并設空白對照(同體積的DMEM培養基)。在共同孵育0、1、2、4、8、12、18、24和48 h后,經裂解液釋放出胞內細菌,使用Micro Screen高通量實時微生物生長儀測定細菌濃度,以孵育時間為橫坐標,細菌濃度為縱坐標繪制殺菌曲線。
2 結果
2.1 金黃色葡萄球菌感染細胞體系的構建 MSA平板觀察結果如圖1A所示,對照組MSA平板無金黃色葡萄球菌生長,而模型組中被感染的細胞釋放出金黃色葡萄球菌后,在MSA平板上生長良好。PCR結果如圖1B所示,金黃色葡萄球菌擴增產物為279 bp。綜合以上結果表明,已成功構建金黃色葡萄球菌感染細胞體系,可用于后續試驗。
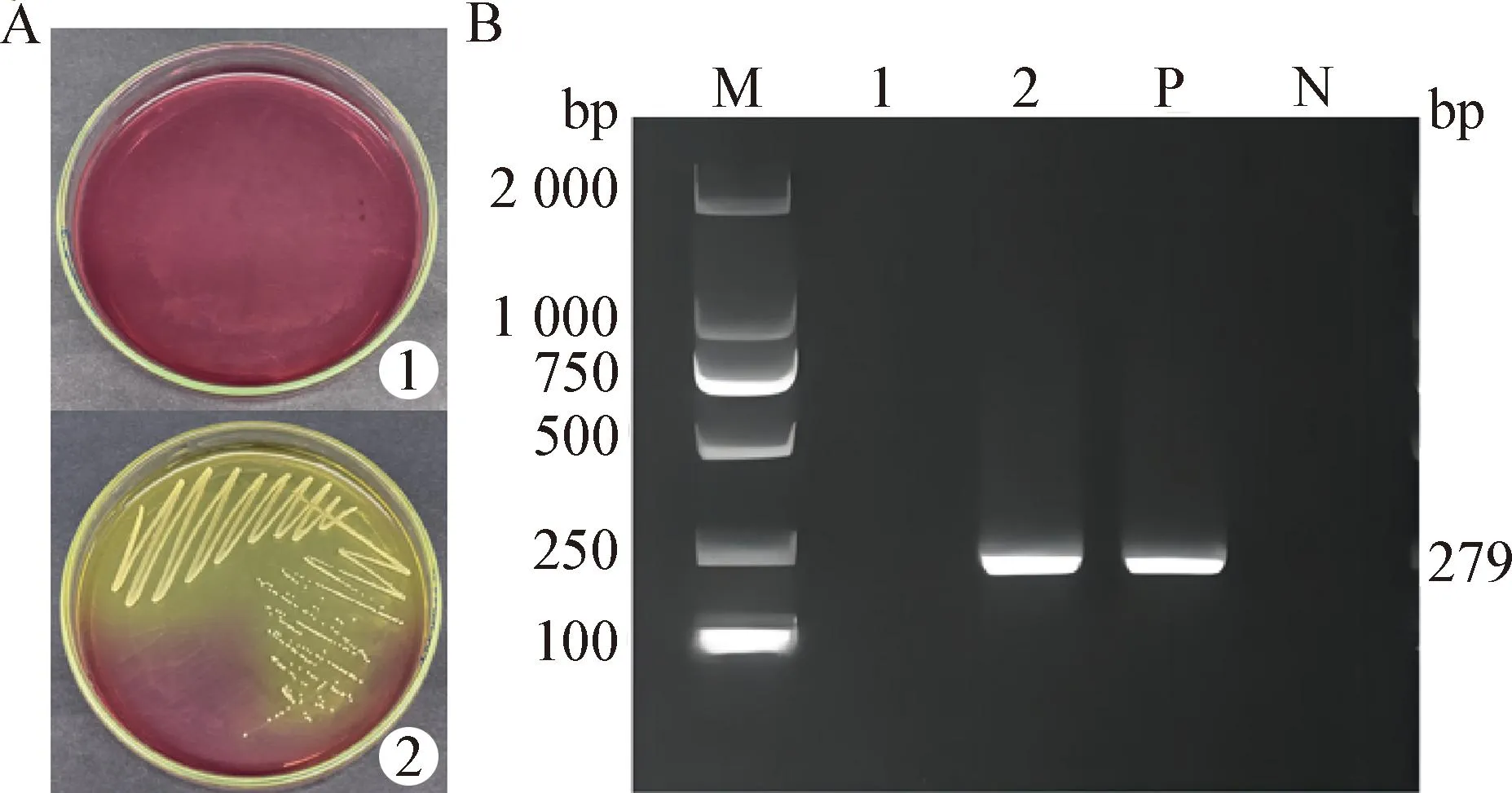
圖1 金黃色葡萄球菌感染RAW264.7細胞體系的構建Fig.1 Construction of RAW264.7 cells system infected by Staphylococcus aureusA:MSA平板觀察(1:對照組; 2:模型組); B:胞內金黃色葡萄球菌的PCR檢測(M:DL2 000 DNA相對分子質量標準; 1:空白孔; 2:待測孔; P:陽性對照; N:陰性對照)A:MSA plate observation (1:Control group; 2:Model group); B:PCR detection of intracellular Staphylococcus aureus (M:DL2 000 DNA relative molecular weight standard; 1:Blank hole; 2:Test hole; P:Positive control; N:Negative control)
2.2 胞內金黃色葡萄球菌在RAW264.7細胞中生長曲線的測定 如圖2所示,在0.5、1、2、3和4 h時,胞內金黃色葡萄球菌生長緩慢,故0~4 h為遲緩期;在6、8、12和18 h時,胞內金黃色葡萄球菌生長迅速,細菌濃度快速增加,故4~18 h為對數期,且此時細菌致病力最強;在24 h時,胞內金黃色葡萄球菌生長數與死亡數相似,故18~24 h為穩定期;在48 h時,死亡細菌濃度逐漸上升,活菌濃度逐漸減少,故24~48 h為衰亡期。
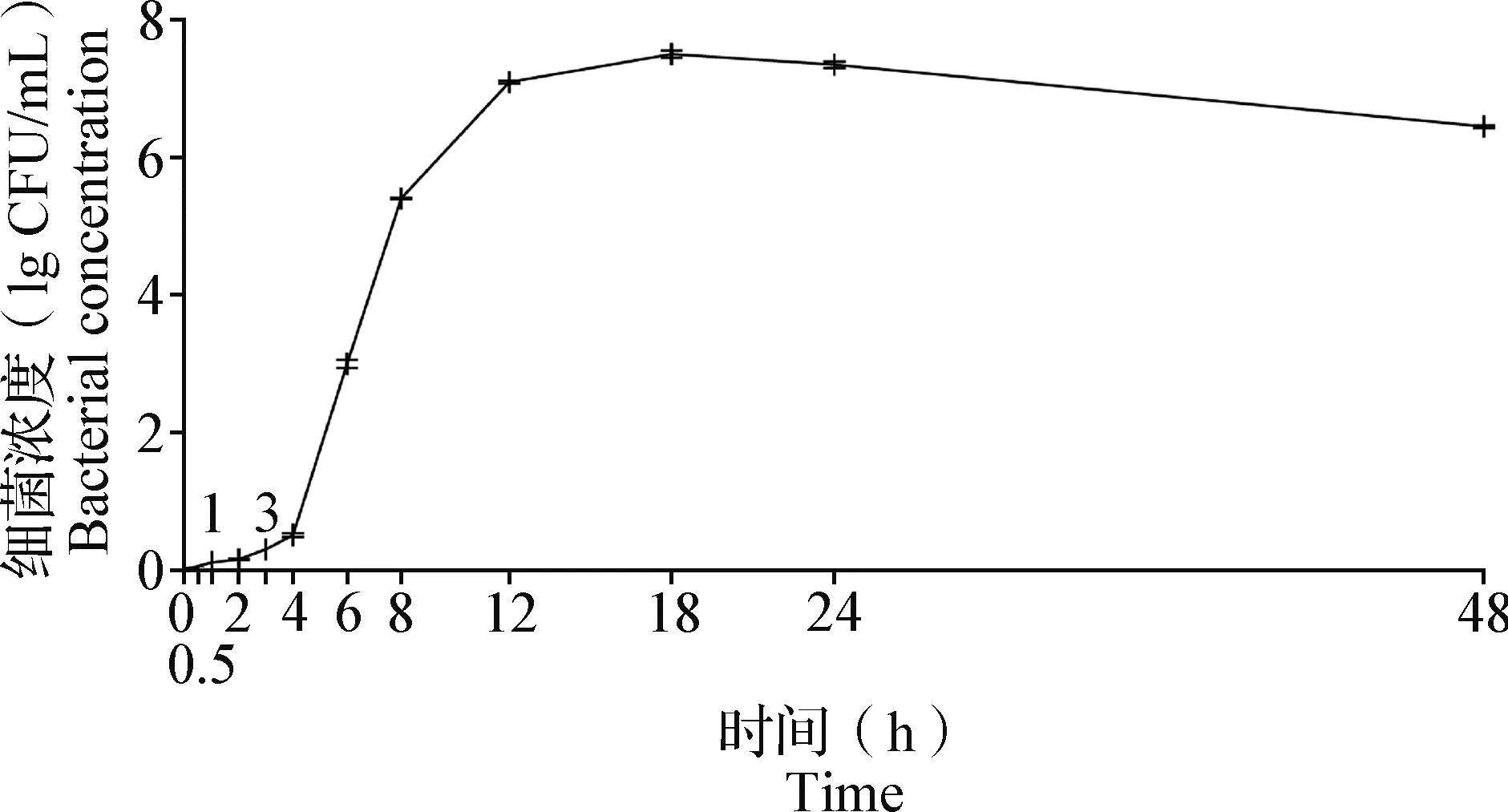
圖2 金黃色葡萄球菌在RAW264.7細胞中的生長曲線(Mean±SD,n=3)Fig.2 Growth curve of Staphylococcus aureus in RAW264.7 cells (Mean±SD,n=3)
2.3 替米考星對RAW264.7細胞活力的影響 如圖3所示,細胞存活率會隨著替米考星濃度和孵育時間的增加而降低,但濃度為128 μg/mL替米考星與RAW264.7細胞共同孵育24 h時,細胞存活率仍然高于80%。結果表明,替米考星對RAW264.7細胞無毒性作用。
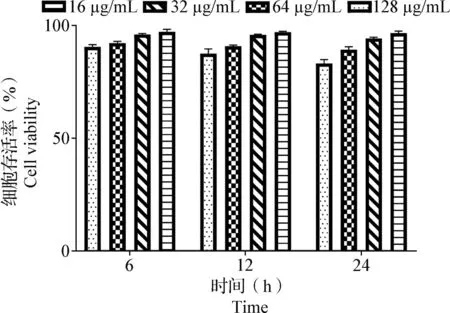
圖3 替米考星對RAW264.7細胞活力的影響(Mean±SD,n=3)Fig.3 Effects of tilmicosin on cell viability of RAW264.7 cells (Mean±SD,n=3)
2.4 替米考星對胞內金黃色葡萄球菌MIC、MBC、MPCpr、MPC和MSW的測定 經測定,替米考星對胞內金黃色葡萄球菌的MIC和MBC分別為4和8 μg/mL;MPCpr為16 μg/mL,最終MPC為12.8 μg/mL,故MSW范圍為4~12.8 μg/mL。
2.5 替米考星對胞內金黃色葡萄球菌PAE的測定 結果如表2所示,當替米考星與胞內金黃色葡萄球菌共同孵育1 h時,隨著替米考星濃度的增大,產生PAE的時間略微延長;當替米考星與胞內金黃色葡萄球菌的共同孵育2 h時,產生PAE的時間明顯延長。結果表明,隨著時間的增加,產生PAE的時間明顯延長,表現出明顯的時間依賴性的殺菌特點。另外,隨著藥物濃度的增大,產生PAE的時間也隨之延長。

表2 替米考星對胞內金黃色葡萄球菌的抗菌后效應Table 2 PAE of tilmicosin against intracellular Staphylococcus aureus
2.6 殺菌曲線的繪制 如圖4所示,替米考星對胞內金黃色葡萄球菌具有明顯的抗菌活性,隨著替米考星濃度的增大,殺菌效果隨之增強。
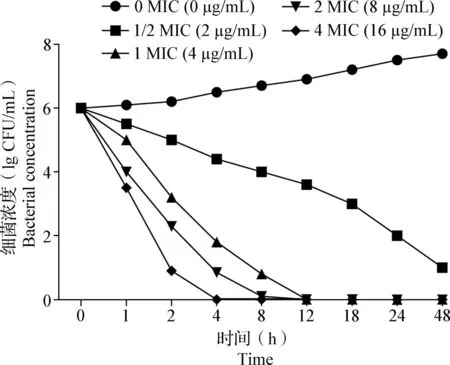
圖4 替米考星對胞內金黃色葡萄球菌的殺菌曲線(n=3)Fig.4 Bactericidal curve of tilmicosin against intracellular Staphylococcus aureus(n=3)
3 討論
由金黃色葡萄球菌引起的奶牛乳腺炎會引起牛奶產量和質量下降,給奶牛養殖業帶來巨大損失。金黃色葡萄球菌作為一種常見的兼性胞內菌,可在宿主細胞內持續存活,從而巧妙地抵御抗生素殺傷作用和宿主免疫系統殺菌作用[19]。M2型巨噬細胞主要負責在感染后期的組織修復,隨著胞內金黃色葡萄球菌的不斷增殖,使巨噬細胞死亡裂解釋放金黃色葡萄球菌,從而感染周圍健康組織形成膿腫,這與奶牛長期、反復感染金黃色葡萄球菌性乳腺炎密切相關[20]。替米考星對金黃色葡萄球菌的抗菌活性較強,且具有良好的組織穿透性,可作為治療胞內金黃色葡萄球菌感染的優選藥物[21]。Martínez-Cortés 等[22]研究證明,替米考星是一種有效的乳腺炎癥調節劑,可通過調節絲裂原活化蛋白激酶磷酸化、活性氧自由基產生和促炎細胞因子分泌等,來修復由金黃色葡萄球菌感染引起的細胞損傷,有助于維持牛乳腺上皮細胞的正常生理功能。
本試驗通過測定替米考星對胞內金黃色葡萄球菌的MIC、MBC、MPC、MSW和PAE,發現替米考星對胞內金黃色葡萄球菌有較強抗菌活性,明確了替米考星對胞內金黃色葡萄球菌的殺菌特點具有明顯的時間依賴性,對于制定替米考星治療奶牛乳腺炎的合理給藥方案具有重要意義,并且可避免耐藥性的產生。MSW對探究替米考星對胞內菌的耐藥性有很好的參考價值,當藥物濃度在4~12.8 μg/mL時,替米考星對胞內金黃色葡萄球菌有較好的臨床治愈率,但也容易出現耐藥突變體的選擇性富集[15]。所以選擇替米考星治療胞內金黃色葡萄球菌感染時,藥物濃度至少≥12.8 μg/mL,即在殺滅敏感株和耐藥菌株的同時,又可避免胞內金黃色葡萄球菌耐藥性的產生[23]。PAE可延長抗菌藥物和細菌之間的作用時間,在一定范圍內,產生PAE的時間長短與藥物濃度和作用時間成正比[24]。本試驗中替米考星對胞內金黃色葡萄球菌的PAE結果顯示,隨著作用時間的增加,產生PAE的時間明顯延長,即替米考星對胞內金黃色葡萄球菌的殺菌特點具有明顯的時間依賴性(時-效關系)。根據這一特點可以適當增加替米考星的給藥濃度和延長作用時間,提高藥物在胞內的停留時間,以獲得更好的殺菌效果。藥效學作為藥動學-藥效學模型(Pharmacokinetic-pharmacodynamic modeling,PK-PD modeling)的重要組成部分,對于研究藥物在體外的抗菌活性有參考價值[25-27]。本試驗替米考星對胞內金黃色葡萄球菌的殺菌特點具有明顯的時間依賴性,可判斷其PK-PD擬合參數為T>MIC。因此,本試驗有望增強替米考星對胞內金黃色葡萄球菌的抗菌活性,對于替米考星的合理使用具有一定的參考價值。本試驗中替米考星對胞內金黃色葡萄球菌的MIC和MBC值為分別為4和8 μg/mL,而替米考星對金黃色葡萄球菌ATCC 29213體外抑菌的MIC為2 μg/mL[15]。這可能是由于宿主細胞對金黃色葡萄球菌具有一定的保護作用,使滲透進入胞內的藥物濃度偏低,所以導致替米考星對胞內金黃色葡萄球菌的MIC偏大[5,6,7,28]。其次由于體外培養和細胞內環境的差異,也可能會對胞內金黃色葡萄球菌產生一定的影響[29]。
本試驗雖證明了替米考星在治療胞內金黃色葡萄球菌感染中具有較好的抗菌活性,但也存在一定的局限性,在體外構建的胞內金黃色葡萄球菌感染模型較為簡單,無法反映由胞內金黃色葡萄球菌感染所引起奶牛乳腺炎的復雜程度。故在本試驗基礎上,后續將開展替米考星對由胞內金黃色葡萄球菌引發奶牛乳腺炎的臨床療效評價,以此驗證在本試驗中的關鍵發現。

